Le prix Nobel 2003 récompense deux chercheurs dont « les découvertes ont permis d'élucider la façon dont les sels (des ions) et l'eau sont transportés à travers la paroi de nos cellules ». En effet, les lauréats nous ont ouvert les yeux sur une merveilleuse famille de machines moléculaires : les canaux, barrières hydriques et ioniques, nécessaires au bon fonctionnement des cellules.
Introduction
Le prix Nobel de chimie 2003 a été attribué mercredi 8 octobre 2003, par l' Académie Royale des Sciences de Suède, pour moitié à l'américain Peter Agre (Johns Hopkins University School of Medecine, Baltimore, USA) pour « la découverte des canaux à eau », et pour l'autre moitié à l'américain Roderick MacKinnon (Howard Hughes Medical Institute, The Rockefeller University, New York, USA) « pour des études structurelles et mécanistiques sur les canaux à ions ».
Ce prix récompense donc deux chercheurs dont « les découvertes ont permis d'élucider la façon dont les sels (des ions) et l'eau sont transportés à travers la paroi de nos cellules ». En effet, les lauréats du prix Nobel de chimie 2003 nous ont ouvert les yeux sur une merveilleuse famille de machines moléculaires : les canaux, barrières hydriques et ioniques, nécessaires au bon fonctionnement des cellules.
Ces découvertes sur les canaux moléculaires nous permettent de « comprendre au niveau moléculaire comment, par exemple, le rein retire l'eau de l'urine primaire et comment les signaux électriques émis dans nos cellules nerveuses apparaissent et se propagent ». Ceci peut s'avérer d'une grande importance pour la compréhension de maladies rénales, cardiaques, musculaires ou affectant le système nerveux.
Les canaux moléculaires, passages dans la membrane cellulaire
Afin de maintenir une pression identique dans les diverses cellules vivantes, il est fondamental que l'eau puisse circuler à travers les membranes de celles-ci. Ceci est connu depuis longtemps. Cependant, l'existence et le fonctionnement des pores responsables du transport aqueux sont restés pendant longtemps des problèmes non résolus en biochimie. Il a fallu attendre l'année 1990 pour que Peter Agre découvre le premier canal à eau. Il s'agit en réalité d'une protéine, similaire à beaucoup d'autres macromolécules responsables et indispensables à la vie.
Le molécules d'eau ne sont pas les seules entités qui entrent et sortent des cellules. Pour des centaines de cellules qui fonctionnent comme un tout, une coordination est requise. C'est pourquoi toute communication entre cellules est nécessaire et indispensable. En fait, les signaux envoyés à l'intérieur et entre les cellules s'avèrent être des ions ou de petites molécules. Elles déclenchent des réactions en cascades, permettant à nos muscles de s'étendre, à nos yeux de s'humecter... contrôlant ainsi le bon fonctionnement de notre corps. Les signaux cérébraux impliquent aussi de telles réactions chimiques. En effet, lorsque nous nous heurtons un orteil, un signal part vers le cerveau. Le long d'une chaîne de cellules nerveuses, par des interactions entre les signaux chimiques et les courants ioniques, l'information est transmise de cellule à cellule, comme un témoin dans une course de relai.
C'est en 1998 que Roderick MacKinnon a pu montrer, pour la première fois, la structure des canaux ioniques à l'échelle de l'atome. Les conséquences médicales et biochimiques des découvertes de Agre et MacKinnon sont importantes. De nombreuses maladies peuvent être attribuées à des fonctionnements déficients de canaux hydriques et ioniques du corps humain. La connaissance de la structure et du fonctionnement de ces canaux permet à présent de créer de nouvelles possibilités de médicaments d'efficacité croissante.
Les canaux hydriques
Découverte des protéines membranaires responsables des canaux hydriques
Dès le milieu du 19ème siècle, on comprit qu'il devait y avoir des passages ou ouvertures dans les membranes cellulaires assurant la circulation de l'eau et des ions. Dans les années 1950, il a été découvert que la molécule neutre d'eau pouvait rapidement entrer et sortir des cellules par des pores de la taille d'une molécule. Durant ces 30 dernières années, cela fut étudié en détail et la conclusion fut qu'il devait y avoir des filtres sélectifs empêchant les ions de passer et permettant le libre passage des molécules neutres telles que l'eau. Ainsi des centaines de millions de molécules d'eau par seconde peuvent passer par un seul canal !
Bien que cela soit connu, personne n'était capable jusqu'en 1992 d'identifier vraiment ce à quoi pouvait ressembler cette machine moléculaire et plus particulièrement qu'elles étaient la (ou les) protéine(s) constituant ce canal hydrique. Dans les années 1980, Peter Agre étudia diverses membranes protéiques issues des globules rouges du sang et retrouva alors l'une d'elle dans le rein. Ayant découvert à la fois sa séquence peptidique et la séquence de l'ADN correspondante, il réalisa qu'il devait s'agir de la protéine à laquelle beaucoup d'autres avaient pensé avant lui : l'entité constitutive du canal hydrique. Cette protéine constituant le canal hydrique a pour nom : aquaporine 1 (AQP1).
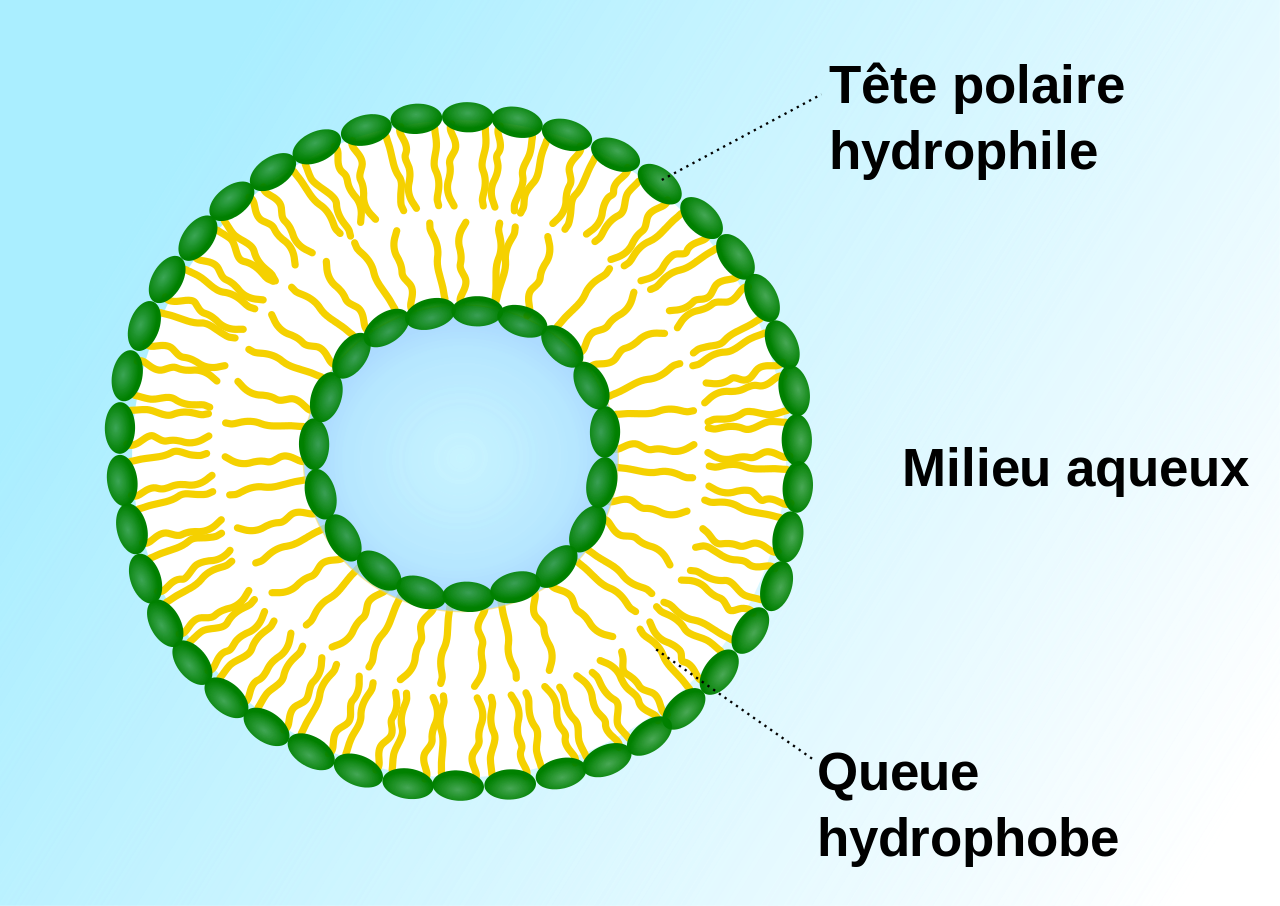
Agre testa son hypothèse en réalisant une expérience simple. Il compara les propriétés, vis à vis de l'eau, des cellules contenant cette protéine (aquaporine 1) à des cellules qui en étaient dépourvues. Quand ces différentes cellules furent placées dans une solution d'eau, les cellules qui possédaient cette protéine membranaire absorbaient l'eau par osmose1 et gonflaient, tandis que celles qui en étaient dépourvues n'étaient aucunement affectées. Agre renouvela cette expérience avec des cellules artificielles, des liposomes, qui sont des vésicules renfermant une partie du milieu (aqueux) où elles ont été formées (figure 1). Il découvrit alors que les liposomes devenaient également perméables à l'eau si l'aquaporine était implantée dans leurs membranes. Ainsi l'aquaporine s'avère être la protéine membranaire responsable du passage de l'eau à travers les membranes des cellules.
Peter Agre savait également que les ions mercuriques Hg2+ empêchent les cellules d'absorber ou de désorber l'eau. Il montra que le transport de l'eau par la protéine aquaporine est également empêché par la présence de ces ions Hg2+. Cela lui confirma que ce qu'il avait découvert s'avèrait être le canal hydrique, d'où le nom d'aquaporine, littéralement "pore à eau". En effet, la protéine membranaire AQP1 est sensible aux agents mercuriques qui bloquent sa perméabilité en s'associant à un résidu cystéine présent dans sa structure primaire, la cystéine 189.
Comment fonctionne le canal hydrique ?
En 2000, Peter Agre et d'autres équipes de recherche présentèrent les premières images à haute résolution de la structure tridimensionnelle de l'aquaporine. À l'aide de ces données, il a été possible de schématiser précisément le fonctionnement du canal hydrique. En effet, des modèles détaillés ont été proposés pour expliquer la stricte sélectivité vis à vis de l'eau, et la capacité de l'aquaporine à empêcher le passage des protons. En effet, les canaux hydriques n'assurent pas le passage des protons qui pourtant est fondamental, car la différence de concentration en protons entre l'intérieur et l'extérieur des cellules est la base du système de stockage d'énergie cellulaire.
Il s'avère que la structure tridimensionnelle de l'aquaporine permet aux molécules d'eau de traverser la membrane cellulaire grâce à des interactions électrostatiques favorables et n'assure pas le passage des entités chargées, telles que les ions oxonium H3O+ à travers celle-ci. Mais comment peut-on l'expliquer ? Le champ électrostatique local produit par la protéine inverse la polarité du milieu à mi-chemin du canal, forçant ainsi les molécules d'eau à subir une rotation. En effet, les moments dipolaires des molécules d'eau sont orientés selon des directions opposées dans la moitié supérieure et la moitié inférieure du canal hydrique. Cette réorientation empêche la formation d'un réseau continu de molécules d'eau et rend impossible l'établissement de liaisons hydrogènes à travers le canal hydrique. Elle bloque ainsi le passage des protons via le mécanisme de Grotthuss. Ainsi les molécules d'eau peuvent suivre librement leur chemin à travers les étroits canaux hydriques en s'orientant grâce au champ électrique local créé par les atomes des parois du canal hydrique et a contrario les protons H3O+ sont stoppés et repoussés de ce canal du fait de leur charge positive.
Conséquences médicales et biochimiques
Durant ces 10 dernières années, les canaux hydriques ont été l'objet de champs de recherches intenses. Les aquaporines semblent constituer une famille de protéines importante et fondamentale à la vie, dans la mesure où ces protéines assurent une fonction de régulation du volume d'eau de la cellule et par conséquent du corps tout entier. Elles existent dans les bactéries, dans les plantes, les animaux et l'homme. A l'heure actuelle, près de 200 aquaporines ont été découvertes, aussi bien dans le règne animal que végétal. Pour le seul corps humain, au moins 11 variantes ont été découvertes. Elle porte le nom d'AQP suivi d'un chiffre qui correspond à leur ordre de découverte.
Le fonctionnement de ces protéines a été établi pour les bactéries, les plantes et les animaux, en mettant l'accent sur leur rôle physiologique. Chez l'homme, les aquaporines jouent un rôle fondamental dans les mouvements d'eau au niveau des tubules rénaux. Pour comprendre l'importance de ces aquaporines, il suffit de prendre l'exemple du rein où les éléments fonctionnels filtrent le sang pour en éliminer les déchets, et réabsorbent les constituants nécessaires à l'organisme, comme l'eau, pour maintenir constant la composition sanguine et assurer la régulation de la pression artérielle.
En effet, le rein est un appareil ingénieux qui permet d'éliminer les substances dont le corps doit se débarrasser. Dans les glomérules rénaux (tubules rénaux), de fonctionnement similaire à un tamis, l'eau, les ions, et les autres petites molécules quittent le sang sous forme d'urine dite primaire. En 24 heures, environ 170 litres d'urine primaire est produite. Heureusement, l'essentiel est réabsorbé par une série de mécanismes astucieux de telle sorte que finalement, seul 1 litre d'urine quitte l'organisme par jour. Des glomérules, l'urine primaire passe à travers un tubule en zig-zag où environ 70 % de l'eau est réabsorbé dans le sang par l'aquaporine AQP1, située dans les membranes luminales et basolatérales du tubule proximal, dans le segment grêle descendant et les vasa recta. A la fin du tubule, 10 autres % d'eau sont réabsorbés par une aquaporine similaire, l'aquaporine de type 2 ou AQP2, située au niveau du tube collecteur. Indépendamment, les ions sodium, potassium et chlorure sont également réabsorbés dans le sang. Une hormone antidiurétique, HAD, appelée aussi vasopressine, ou encore arginine vasopressine1 stimule entre autre le transport des aquaporines AQP2 du cytoplasme jusque dans la membrane apicale et de ce fait augmente la réabsorption d'eau de l'urine primaire. Ainsi l'HAD augmente la perméabilité à l'eau du tube collecteur dans la partie corticale et médullaire du rein. Elle favorise l'incorporation de canaux aqueux ou aquaporines dans la membrane apicale du tube collecteur et favorise leur ouverture, ce qui permet la réabsorption de l'eau. Les personnes présentant un dysfonctionnement vis à vis de cette hormone sont affectés par la maladie du diabète insipide, se manifestant par une sécrétion journalière d'urine de 10 à 15 litres.
Les canaux ioniques
Transmission cellulaires des signaux par les ions
Le chimiste physicien allemand Wilhelm Ostwald (prix nobel de chimie 1909) indiqua en 1890 que les signaux électriques mesurés dans les tissus vivants pouvaient être créés par le mouvement ionique extra et intracellulaire. Cette idée électrochimique fut rapidement admise. La notion d'existence d'étroits canaux ioniques vit le jour en 1920. Les deux scientifiques britanniques Alan Hodgkin et Andrew Huxley découvrirent un concept révolutionnaire dans les années 1950 et reçurent pour cela le prix Nobel de physiologie ou médecine en 1963. Ils montrèrent comment la circulation des ions à travers la membrane des cellules nerveuses produit un signal qui est transmis de cellule nerveuse à cellule nerveuse tel un relai dans une course à pied. Ce sont principalement les ions sodium et potassium, Na+ et K+, qui sont actifs dans ces réactions.
Ainsi il y a plus de 50 ans, la connaissance des fonctions centrales des canaux ioniques étaient déjà bien avancée. Ces canaux ioniques sont très sélectifs vis à vis des ions, ils peuvent permettre le passage sélectif d'un type d'ion et pas des autres. De plus les canaux peuvent s'ouvrir ou se fermer et parfois ne permettre que le passage des ions dans une seule direction. Cependant la manière dont ce mécanisme moléculaire fonctionne demeura longtemps un mystère.
Sélectivité ionique des canaux ioniques
Dans les années 1970 il fut montré que les canaux ioniques pouvaient accepter uniquement certains ions puisqu'ils étaient équipés en quelque sorte de filtres ioniques. Un intérêt plus particulier fut porté sur la recherche des canaux qui permettent le passage des ions potassium, mais pas des ions sodium, même si les ions sodium sont plus petits que les ions potassium. On a alors suspecté que les atomes d'oxygène, dans la protéine, jouent un rôle important comme substituts vis à vis des molécules d'eau par lesquelles l'ion potassium est entouré en solution aqueuse et dont il doit se libérer dès qu'il franchit l'entrée du canal. Mais progresser plus loin dans cette hypothèse était difficile. Ce qui restait à présent nécessaire à acquérir, était alors obtenu via des images à haute résolution fournies par la technique de cristallographie à rayon X. Le problème était qu'il était alors extrêmement difficile de déterminer la structure de protéine membranaire par cette méthode, et les canaux ioniques n'étaient alors pas une exception. Les protéines membranaires végétales et animales sont plus compliquées et difficiles à travailler que celles des bactéries.
Beaucoup de chercheurs ont essayé en vain. C'est alors que la percée est venue d'une direction inattendue. Roderick MacKinnon, après avoir étudié la biochimie, s'est tourné vers la médecine et a été qualifié en tant que docteur médical. Après avoir travaillé en tant que médecin pendant quelques années, il s'est alors intéressé aux canaux ioniques dont il a commencé à faire la recherche : "ma carrière scientifique a en effet commencé à l'âge de 30 ans", a-t-il admis. Mais sa carrière s'est alors fortement accélérée. Se rendant compte que de meilleures et hautes résolutions de structures étaient nécessaires pour comprendre comment fonctionnaient les canaux ioniques, il a décidé d'apprendre les principes fondamentaux de la cristallographie de rayon X. C'est alors qu'il provoqua la surprise dans l'ensemble de la communauté scientifique lorsqu'il réussit, en avril 1998, à déterminer la structure spatiale d'un canal à potassium de Streptomyces lividans, appelé KcsA.
Première représentation des canaux ioniques, atome par atome
En 1998, MacKinnon a déterminé la première structure à haute résolution du canal ionique KcsA, à partir d'une bactérie appelée Streptomyces lividans. MacKinnon a alors expliqué, pour la première fois, comment un canal ionique fonctionnait au niveau atomique. Le filtre ionique, qui admet des ions potassium et arrête des ions sodium, peut à présent être étudié en détail. Non seulement il était alors possible de déterminer comment les ions pouvaient traverser le canal ionique, mais on pouvait également observer les ions dans la structure cristalline du canal ionique : ils sont entourés par des molécules d'eau juste avant d'entrer dans le filtre ionique de sélection, puis traversent sans ligand le filtre et enfin sont à nouveau complexés par des molécules d'eau. MacKinnon a pu expliquer pourquoi des ions potassium, et non des ions sodium, étaient admis par le filtre ionique : ceci est dû au fait que la distance entre l'ion potassium et les atomes d'oxygène dans le filtre ionique de ce canal est identique à celle entre l'ion potassium et les atomes d'oxygène des molécules d'eau entourant l'ion de potassium lorsqu'il est en dehors du filtre. Il peut ainsi traverser le filtre librement. Cependant, l'ion de sodium, qui est plus petit que l'ion de potassium, ne peut pas passer par le canal, car il ne s'ajuste pas correctement avec les atomes d'oxygène du filtre et reste donc dans la solution aqueuse. La capacité du canal pour dépouiller l'ion potassium de ses ligands (eau) et lui permettre de traverser le canal ionique n'a aucun coût du point de vue énergétique. Ainsi, le filtre à potassium se compose d'une série de fixations qui, en mimant l'hydratation de l'ion potassium, permettent de fixer des ions potassium sans leur couronne d'hydratation. Ce procédé semble donc être un procédé de transfert d'ions sélectif et catalysé.
La cellule est également susceptible de commander l'ouverture et la fermeture des canaux ioniques. En effet, des comparaisons de structure ont permis à MacKinnon de montrer que des changements de conformation des hélices membranaires des canaux ioniques permettent de les ouvrir et de les fermer. Ce changement de conformation bloque l'issue du canal, appelée "porte". Cette régulation est gérée par une sorte de "sonde" moléculaire. La sonde est située près de la porte. Ces sondes réagissent à certains signaux, par exemple une augmentation de la concentration des ions calcium, une tension électrique au-dessus de la membrane cellulaire... En reliant différentes sondes aux canaux ioniques, la nature a créé des canaux répondant à un grand nombre de signaux différents.
Conséquences médicales et biochimiques
Les canaux à ions sont vitaux au bon fonctionnement du système nerveux et des muscles. La principale fonction de ces canaux ioniques est celle de microgénérateurs d'électricité biologique qui permettent aux cellules du système nerveux de communiquer entre elles et avec leurs organes cibles, aux cellules musculaires et vasculaires de déclencher leur contraction, aux cellules cardiaques de déclencher la contraction rythmique, aux cellules du système endocrinien de déclencher la sécrétion d'hormones. Ces canaux ioniques sont des macromolécules protéiques situées dans les membranes cellulaires et permettent le transit sélectif de sodium, de potassium ou de calcium de l'extérieur vers l'intérieur de la cellule ou vice-versa...
Par exemple, le potentiel d'action des cellules nerveuses ou neurones apparaît lorsqu'un canal ionique, situé à la surface d'un neurone est ouvert par un signal chimique, envoyé par un neurone adjacent. Après quoi une impulsion électrique se propage le long de la surface de la cellule nerveuse grâce à l'ouverture et à la fermeture d'une série de canaux ioniques, cela en l'espace de quelques millisecondes.
Ainsi ces structures sont présentes dans les cellules nerveuses, musculaires et cardiaques. Leur étude nous fournit des renseignements sur de nombreuses pathologies et leur possible traitement, comme l'analyse du mode d'action des bloqueurs des canaux ioniques du calcium, classe thérapeutique contre l'hypertension artérielle. A l'heure actuelle, des médicaments ont déjà trouvé leur efficacité en agissant au niveau des canaux ioniques. Par exemple, on a pu montrer que les sulfonylurées antidiabétiques utilisées par des millions de patients, mais dont le mécanisme d'action était inconnu, avaient pour cible une classe particulière de canaux ioniques, perméables au potassium, dans les cellules pancréatiques qui assurent la sécrétion de l'insuline. Par ailleurs, on a pu découvrir une nouvelle classe de canaux au potassium jouant un rôle central dans le contrôle du potentiel de repos des cellules nerveuses du cerveau et de la moelle épinière. Ces canaux sont présents dans les neurones associés au processus de mémorisation ou liés aux activités motrices. Cette découverte peut permettre d'envisager par exemple la création de nouveaux éléments anesthésiques d'efficacité accrue.
Conclusion
Les canaux membranaires sont indispensables à la vie. Pour cette raison, l'éclaircissement de leur fonctionnement constitue une base importante dans la compréhension d'un grand nombre de maladies. Par exemple, la déshydratation d'origine diverse, la sensibilité à la chaleur sont reliées à l'efficacité des aquaporines. Les vagues de chaleur européennes de ces dernières années, ont eu pour conséquence désastreuse de compter de nombreux décès, dont l'une des causes peut s'avérer liée aux problèmes d'établissement des équilibres cellule-fluide. Dans ces processus, les aquaporines s'avèrent d'une grande importance.
Les perturbations dans le fonctionnement des canaux ioniques peuvent mener à de nombreuses pathologies du système nerveux ou musculaires, tels qu'un dysfonctionnement cardiaque. Par ailleurs ces canaux ioniques constituent une cible thérapeutique importante.
Ainsi ces découvertes posent les bases de nombreuses études en cours et à venir sur la compréhension moléculaire de nombreux mécanismes ou maladies rénales, cardiaques, musculaires ou affectant le système nerveux. Le prix Nobel de chimie 2003 illustre parfaitement la manière dont la biochimie permet de mieux comprendre les processus de la vie en étudiant ceux-ci à l'échelle atomique.
Références
Pour compléter cet article, vous pouvez consulter le site Nobel Prize et en particulier les ressources données par l'Académie Royale des Sciences de Suède, références sur lesquelles je me suis largement appuyée pour écrire cet article.