Le prix Nobel de chimie 2004 a été décerné le mercredi 6 octobre 2004, par l'Académie Royale de Suède, aux israéliens Aaron Ciechanover et Avram Hershko et à l'américain Irwin Rose pour la découverte du processus intracellulaire de dégradation des protéines. Tandis que la majorité des biochimistes des décennies précédentes ont cherché à comprendre la production des protéines au sein des cellules, ces trois chercheurs sont allés à contre-courant ...
Le prix Nobel de chimie 2004 a été décerné le mercredi 6 octobre 2004, par l'Académie Royale de Suède, aux israéliens Aaron Ciechanover et Avram Hershko et à l'américain Irwin Rose pour la découverte du processus intracellulaire de dégradation des protéines.
Tandis que la majorité des biochimistes des décennies précédentes ont cherché à comprendre la production des protéines au sein des cellules, ces trois chercheurs sont allés à contre-courant et ont découvert au début des années 80 l'un des processus cycliques les plus importants de la cellule : la dégradation des protéines.
Ils ont montré que la dégradation est un processus capital régulé et hautement sélectif : une protéine malformée ou désormais inutile parce qu'elle a fini d'accomplir la tâche pour laquelle elle a été synthétisée est repérée puis « étiquetée ». Cela revient à lui donner le « baiser de la mort ». En effet, la protéine ainsi marquée est alors reconnue par les protéosomes, structures dédiées à la dégradation, véritables « hachoirs à protéine », qui la débitent alors en courtes chaînes polypeptidiques de moins de 10 acides aminés. Au cours du processus, l'étiquette est libérée pour être réutilisée.
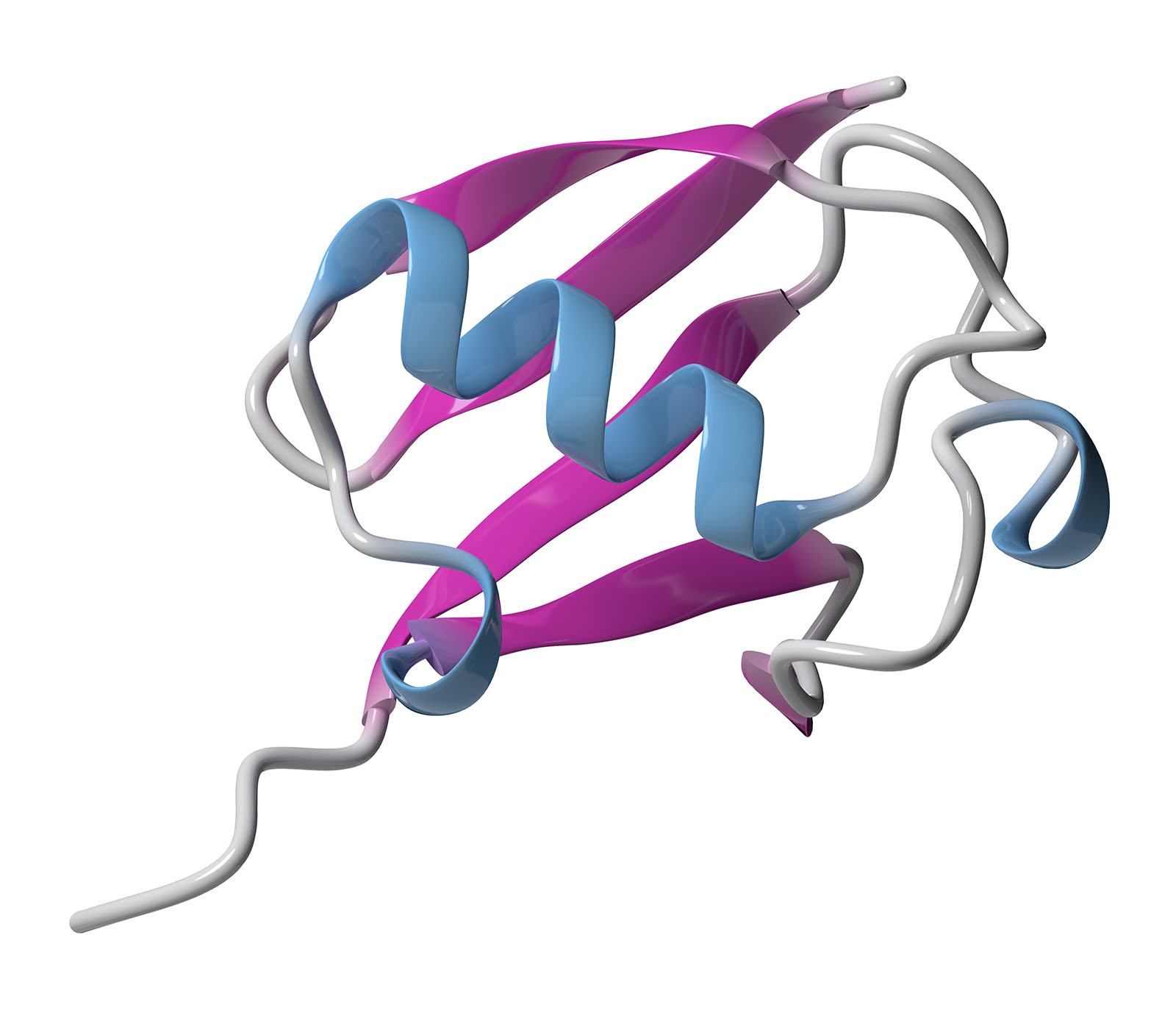
Les lauréats du prix Nobel ont découvert la nature de cette étiquette et élucidé son rôle dans la chaîne de dégradation. C'est un polypeptide composé de 76 acides aminés que l'on trouve dans la plupart des organismes vivants : l'ubiquitine (du latin ubique : partout) dont la strucure est donnée figure 11.
Les hélices α (en bleu) et les feuillets β (en rose) sont mis en évidence.
On distingue en général quatre niveaux de structure dans l'architecture des polypeptides et des protéines. La structure primaire correspond à l'enchaînement des acides aminés. La structure secondaire rend compte de l'arrangement spatial de ces acides aminés, on distingue principalement les hélices α et les feuillets β joints entre eux par des coudes. La structure tertiaire consiste en l'arrangement spatial des différentes structures secondaires. Dans le cas de protéines constituées de plusieurs chaînes polypeptidiques, ces chaînes s'arrangent suivant la structure quaternaire.
Cette découverte prouve que la cellule est un système dynamique au sein duquel synthèse et dégradation des protéines ont lieu continûment. La dégradation est une étape clé dans de nombreux mécanismes cellulaires : la division, la réparation de l'ADN et le contrôle qualité des nouvelles protéines (jusqu'à 30 % des protéines nouvellement synthétisées peuvent être immédiatement dégradées parce qu'elles ne vérifient pas les critères de qualité imposés par l'organisme). Une grande partie de l'activité du système immunitaire repose également sur la dégradation des protéines. Quand elle ne fonctionne pas correctement, nous tombons malades : inflammations, cancers, fibrose cystique1. Les implications médicales de cette découverte sont donc très importantes et un premier médicament agissant sur le processus de dégradation des protéines est commercialisé depuis l'année dernière aux États-Unis.
Pour aller plus loin