Le Prix Nobel de Chimie 2008 a été attribué au japonais Osamu Shimomura et aux américains Martin Chalfie et Roger Y. Tsien pour la découverte et le développement de la protéine fluorescente verte GFP (Green Fluorescent Protein). La protéine fluorescente verte GFP est depuis quelques décennies « le microscope » des biochimistes, biologistes et autres chercheurs dans le domaine médical.
Présentation
Le Prix Nobel de Chimie 2008 a été attribué au japonais Osamu Shimomura (Marine Biological Laboratory, Woods Hole, USA & Boston University Medical School, Boston, USA) et aux américains Martin Chalfie (Colombia University, New York, USA) et Roger Y. Tsien (University of California, San Diego, La Jolla, USA) pour la découverte et le développement de la protéine fluorescente verte GFP (Green Fluorescent Protein).
Dans les années 1960, Osamu Shimomura débute l'étude de la méduse bioluminescente Aequorea victoria sans se douter de la révolution scientifique que cela va provoquer. Trente ans plus tard, Martin Chalfie utilise la GFP afin de l'aider dans l'observation du plus petit édifice vivant, la cellule. Aujourd'hui, les scientifiques sont capables d'étudier de nombreux processus biologiques jusqu'alors invisibles grâce aux travaux de Roger Y. Tsien, dont les protéines GFP « brillent » de toutes les couleurs de l'arc-en-ciel.

Pourquoi le marqueur GFP est-il révolutionnaire ?
Lorsque les scientifiques développent des méthodes leur permettant de voir ce qui était invisible auparavant, la recherche fait toujours un grand bond en avant. Par exemple, quand Anton Van Leuuwenhoek est l'un des premiers à utiliser le microscope au 17ème siècle, un nouveau monde s'ouvre. Les scientifiques ont soudainement pris conscience de choses dont ils n'imaginaient même pas l'existence auparavant comme les bactéries ou les cellules.
Cette année, le Prix Nobel de Chimie récompense une découverte à l'effet similaire sur le monde scientifique. La protéine fluorescente verte GFP est depuis quelques décennies « le microscope » des biochimistes, biologistes et autres chercheurs dans le domaine médical ; la forte couleur verte de la GFP apparaissant sous lumière bleue ou UV. Ainsi dans les applications directes, la GFP permet d'illuminer la croissance des tumeurs cancéreuses, le développement de la maladie d'Alzheimer ou l'évolution de bactéries pathogènes.
L'utilisation la plus intéressante de la GFP consiste en la possibilité de suivre les différents processus biologiques et chimiques à l'intérieur même de la cellule. Une cellule - de l'ordre de 0,02 mm de diamètre - est constituée de protéines, d'acides gras, de carbohydrates et autres molécules dont l'observation nécessite une puissance de résolution dépassant celle d'un microscope classique. Pourtant c'est à ce niveau d'échelle d'étude que les chercheurs doivent travailler afin d'affiner leur compréhension du monde cellulaire.
Au sein de la cellule, les processus biochimiques sont en général régulés par les protéines, dont les variétés fonctionnelles sont multiples. En connectant la protéine GFP - facilement traçable de par sa fluorescence verte - à une de ces protéines cellulaires, les chercheurs peuvent à présent suivre son comportement, ses mouvements et ses interactions avec le milieu de la cellule.
La contribution de Osamu Shimomura : la découverte de la GFP
Osamu Shimomura, citoyen japonais, est né à Kyoto en 1928. Il obtient son doctorat en 1960 à l'Université de Nagoya au Japon. Actuellement Shimomura est Professeur émérite au Marine Biological Laboratory de Woods Hole et à la Boston University Medical School de Boston dans le Massachusetts.
C'est auprès du Professeur Yashimasa Hirata à l'université de Nagoya que Shimomura débute sa carrière scientifique en réussissant à isoler la protéine responsable de la brillance des restes d'un mollusque, le Cypridina, lorsque celui-ci est humidifié par l'eau. Ces travaux impressionnent le Professeur Hirata - directeur de la thèse de doctorat de Shimomura -, mais également l'équipe de Franck Johnson de l'Université de Princeton dans le New Jersey. Ce dernier décide de le recruter et tous deux se penchent alors sur un autre corps bioluminescent, la méduse Aequorea victoria.
Après avoir écumé les plages de la côte Ouest des USA pendant l'été 1961 afin de ramener plus de 10.000 spécimens de la méduse Aequorea victoria, Johnson et Shimomura isolent en 1962 une protéine - la future GFP - qui fluoresce dans la couleur verte lorsqu'elle est soumise à une lumière UV [1]. Ils montrent dans leur article de 1962 que la GFP possède un chromophore particulier, c'est-à-dire un groupe chimique qui absorbe et émet de la lumière (figure 2). Ainsi quand on soumet la GFP à une lumière UV ou bleue, le chromophore de la GFP passe dans un état excité du fait de l'absorption de cette énergie lumineuse. Il émet ensuite cette énergie sous forme de lumière - phénomène de fluorescence - afin de revenir à son état fondamental ; cette désexcitation est alors dans la longueur d'onde du vert.

La révolution de la protéine GFP par rapport à tout autre matériel luminescent réside dans le fait qu'elle ne nécessite pas d'additifs pour briller. Il suffit de soumettre la GFP à une radiation bleue ou UV pour observer une brillance verte. Ainsi une fois la GFP en place, il n'y a pas besoin d'injecter d'autres substances chimiques au sein de la cellule qui pourrait perturber l'étude.
La contribution de Martin Chalfie : utiliser la GFP comme traceur
Martin Chalfie, citoyen américain, est né en 1947 à Chicago. Il obtient son doctorat en 1977 en neurobiologie à l'Université d'Harvard. Depuis 1982, il est Professeur de sciences biologiques à l'Université Colombia de New York.
Au cours d'un séminaire sur les organismes bioluminescents organisés en 1988 à l'Université Columbia, Chalfie se passionne pour la GFP. Ses travaux portent sur l'étude d'un ver transparent, le Caenorhabditis elegans[1]. Chalfie réalise alors que cette protéine fluorescente verte pourrait se révéler être un formidable outil pour suivre le comportement interne de ce ver. La GFP agirait ainsi comme un signal lumineux vert, rendant compte des différentes activités des cellules du ver. Il a alors l'idée d'attacher le gène codant pour la GFP à ceux codant pour d'autres protéines. Quand la cellule a besoin d'une protéine pour son fonctionnement, elle envoie un signal au gène correspondant qui active alors la production de la dite protéine. Ainsi lorsqu'un gène, attaché à celui codant pour la GFP, est activé, on sera capable de voir les cellules pour lesquelles ce gène est activé ainsi que les lieux de production de la protéine correspondante. La lumière verte de la GFP sert de balise de ces différents événement.
Chalfie demande l'aide de Douglas Prasher de l'Institut Océanographique de Woods Hole (Massachussets) afin d'isoler le gène codant de la GFP [2]. En 1990, Chalfie et son équipe injectent ce gène au sein de la bactérie Eschérichia Coli qui se met à produire de la GFP. La bactérie E. Coli brille alors d'un vert intense quand elle est irradiée par une lumière UV : c'est cette découverte qui constitue l'utilisation actuelle révolutionnaire de la GFP.
L'étape suivante est l'insertion de ce gène au niveau des neurones impliqués dans la perception tactile du ver C. elegans. Les résultats sont publiés dans le journal Science en Février 1994 [3]; sur la couverture apparaissent alors les dits neurones illuminés d'une couleur verte intense (figure 3 et 4).
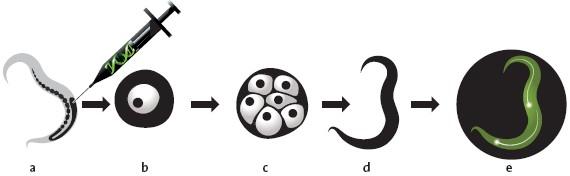
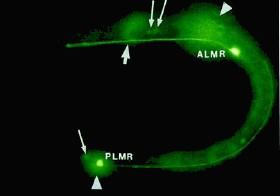
Cette méthode non invasive se multipliera dans les années à venir pour l'observation interne du vivant microscopique.
La contribution de Roger Y. Tsien : créer une palette de couleurs de la GFP
Roger Y. Tsien, citoyen américain, est né en 1952 à New York. Il obtient son doctorat en 1977 en physiologie à l'Université de Cambridge. Depuis 1989, il est Professeur à l'Université de Californie, San Diego.
Tsien développe alors des GFP capables d'émettre à des couleurs différentes plus longtemps et plus intensément. L'énorme intérêt de cette découverte est la faculté de pouvoir suivre simultanément le trajet de différentes protéines en affectant à chaque protéine une couleur différente. Ainsi, Tsien facilite par cette innovation l'étude des interactions entre protéines. Tsien s'intéresse donc au chromophore de la GFP, que l'on sait être formé des trois acides aminés en position 65-66-67 de la longue chaîne des 238 acides aminés composant la protéine GFP. Par des échanges astucieux des différents acides aminés de la GFP, Tsien et son équipe parviennent à créer des variantes de la GFP émettant dans différentes teintes de bleu et de jaune [4].
Néanmoins, la teinte la plus intéressante pour l'étude des tissus biologiques est le rouge car il y pénètre plus facilement. Le rouge devient la teinte à obtenir afin d'être utilisée pour tout ce qui touche à l'observation des organes d'un corps. Avec la collaboration de deux chercheurs russes - Mikhail Matz et Sergei Lukyanov - [5], Tsien relève le défi de la couleur « rouge » en mettant au point d'autres protéines type GFP à partir d'études de coraux fluorescents. Leurs noms sont évocateurs de leur teinte : mPlum, mCherry, mStrawberry, mOrange et mCitrine. A présent, de nombreuses équipes de recherche ont considérablement augmenté la palette de teintes des protéines type GFP [6].
Une expérience impressionnante, nommée « the brainbow » [2] et publiée dans Nature en 2007, consiste en la modification génétique des cellules nerveuses du cerveau d'une souris afin qu'elles produisent différentes couleurs [7]. Elle montre la possibilité de suivre les fibres nerveuses à partir de différentes cellules individuelles au sein du réseau dense du cerveau de la souris.

Bibliographie
[1] Shimomura, O., Johnson, F.H. and Saiga, Y. (1962) J. Cell. Comp. Physiol. 59 223-240.
[2] Prasher, D. et al. (1992) Gene 111 229-233.
[3] Chalfie, M. et al. (1994) Science 263 802-805.
[4] Tsien, R. (1998) Annu. Rev. Biochem. 67 509-544.
[5] Matz, M. et al. (1999) Nature Biotechnology 17 969-973.
[6] Shaner, N.C. et al. (2004) Nature Biotechnology 22 1562-1572.
[7] Livet et al (2007) Nature 450 56-63.
Pour compléter cet article, vous pouvez consulter le site concernant le Prix Nobel de Chimie 2008 et en particulier les ressources données par l'Académie Royale des Sciences de Suède, références sur lesquelles je me suis largement appuyé pour écrire cet article.
[1] Le Caenorhabditis elegans est un ver transparent constitué de seulement 959 cellules, possédant un cerveau. De plus, un tiers de ses gènes sont reliés à ceux de l'homme. Le fait qu'il soit transparent est également intéressant pour suivre l'évolution de ses organes au microscope.
[2]« the brainbow » pour contraction de brain (qui signifie cerveau) et rainbow (qui signifie arc-en-ciel).






