Cette ressource vise à présenter la bioélectrochimie.
Qu’est-ce que la bioélectrochimie ?
Pour un chimiste, l’analyse du terme « bioélectrochimie » ne semble pas poser de problème majeur et les différents préfixes laissent à entendre qu’il s’agit d’une sous-discipline de l’électrochimie et de son application à l’objet biologique. C’est en effet la définition donnée par les sociétés savantes comme la BES (BioElectrochemical Society) qui, fondée en 1979, se décrit comme une association scientifique internationale visant à promouvoir « the understanding and cooperation among scientists interested in the application of electrochemical concepts and techniques to the fundamental or applied study of living systems » [1]. Maurice Comtat, l’un des fondateurs de l’équivalent français de la BES, le GFB (Groupe Français de Bioélectrochimie qui fête ses 30 ans en 2016) donne une définition dans le même esprit en 1998 et décrit la bioélectrochimie comme « la discipline dont l’objet est l’application des concepts, théories et méthodes de l’électrochimie à l’étude des molécules biologiques ou de leurs modèles et des systèmes biologiques organisés.[…] » [2]. Afin de mieux percevoir ce que le terme de bioélectrochimie implique, il est donc nécessaire de resituer brièvement l’électrochimie.
Histoire de l’électrochimie
Les ouvrages spécialisés considèrent l’électrochimie comme la « discipline qui étudie la relation entre transformations chimiques et passage de courant électrique » [3] ou la « science qui analyse et décrit les transformations de la matière à l’échelle atomique par déplacement de charges électroniques » [4]. S’il est difficile de donner une date exacte à « l’an 1 de l’électrochimie », tous les scientifiques s’accordent pour situer son origine à la controverse entre Luigi Galvani et Alessandro Volta (fin du XVIIIème siècle) (Figure 1).
Leur conflit a essentiellement porté sur la nature de l’électricité (« animale » ou « métallique ») lors de la contraction musculaire d’une cuisse de grenouille où nerf et muscle sont reliés par un arc contenant deux métaux différents. Leur discorde a finalement abouti a l’élaboration de la première pile dite « pile Volta » qui permet l’obtention d’un courant électrique par l’intermédiaire de réactions aux électrodes impliquant à la fois un transfert électronique et une transformation chimique. La suite de l’histoire voit le développement de l’électrochimie en tant que telle, à travers les contributions de Michael Faraday (1791-1867 ; vocabulaire de l’électrochimie, lois de l’électrolyse…), Gaston Planté (1834-1889 ; accumulateur au plomb, Georges Leclanché (1839-1882 ; pile dite « Leclanché » à base de Zn et MnO2), Walther H. Nernst (1864-1941 ; thermodynamique électrochimique), Frederick Cottrell (1877-1948 ; équation du courant à l’électrode limité par le transfert de masse par diffusion), John A.V. Butler (1899-1977) et Max Volmer (1885-1965 ; théorie du transfert de charge, cinétique électrochimique). Ajoutons à cette liste partielle et partiale le nom de John Daniell (1790-1845) et sa pile dite « Daniell » qui en dépit d’une faible puissance représente un classique de l’enseignement. Notons enfin que la seconde moitié du XXème siècle et a fortiori le XXIème définissent la période de l’électrochimie « moderne ».1 Structurée à la fin des années 70, la bioélectrochimie s’inscrit donc dans cette mouvance.
Apport de la bioélectrochimie à l’électrochimie : biopiles et biocapteurs
Piles et électrolyseurs
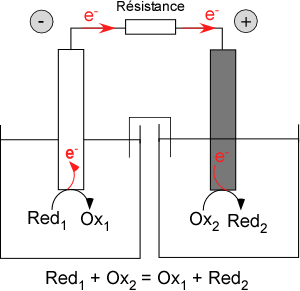
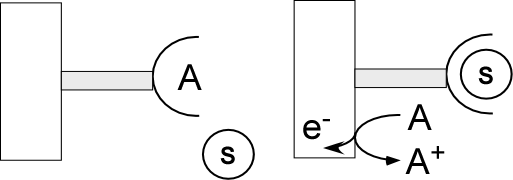
Même si cela est réducteur (sic), l’électrochimie peut être considérée sous la forme de deux configurations expérimentales « limites ». La première est celle qui correspond à l’association de deux compartiments contenant chacun une électrode et un couple oxydant/réducteur. La fermeture du circuit conduit à la circulation d’un courant résultant des réactions spontanées (oxydation ou réduction) ayant lieu dans chaque compartiment. C’est la configuration bien connue de type « pile » qui consiste à transformer l’énergie chimique d’une réaction d’oxydoréduction en énergie électrique : en empêchant le contact entre les protagonistes, ceux-ci échangent les électrons indirectement par le circuit extérieur (Figure 2). On remarquera que l’expérimentateur est « passif » dans cette configuration : il n’influe en rien sur le système qu’il laisse naturellement évoluer.
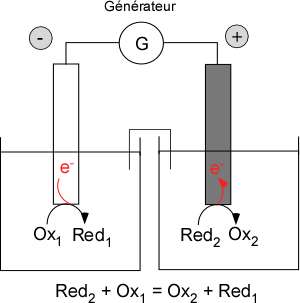
La seconde configuration est celle de l’électrolyseur (Figure 2). Similaire à celle de la pile, elle en diffère fondamentalement à travers le rôle de l’expérimentateur qui, « actif », contrôle la différence de potentiel (ou le courant) entre les deux électrodes pour réaliser une transformation globale « forcée ». Il est à noter que l’échelle expérimentale de cette configuration dépend grandement de la dimension de l’électrode par rapport au volume de solution. Une « petite » électrode dans un « grand » volume (typiquement quelques millimètres dans quelques dizaines de mL) correspond à une échelle analytique : une majeure partie de la solution n’est pas affectée par l’expérience et on utilisera l’information électrique (courant, potentiel) pour transcrire une information chimique (la concentration de l’espèce qui s’oxyde ou se réduit). On parle d’électroanalyse. Inversement, une électrode qui occuperait tout le volume de solution (barreau, toile, grille) correspond à une échelle préparative (électrolyse) : toute la solution est affectée par la transformation.
Biopiles
C’est notamment à ces deux configurations que le « bio » de bioélectrochimie s’adresse en leur permettant soit d’améliorer soit d’étendre le champ d’applications de l’électrochimie. Dans ce contexte, les deux applications les plus populaires de la bioélectrochimie sont les biopiles et les biocapteurs.
Ainsi, la production d’énergie électrique par le biais d’une pile peut être augmentée à travers l’utilisation de systèmes biologiques (enzymes, micro-organismes) greffés sur les électrodes et jouant alors un rôle de catalyseurs. On parle alors de biopiles. Ces dernières sont amplement décrites dans l'article d’Elisabeth LOJOU intitulé « Des biopiles à combustibles pour une production verte d'électricité » et ne seront pas détaillées plus avant.
Biocapteurs
Sans qu’une vision exhaustive ne soit adoptée, mettons à profit quelques lignes pour décrire les biocapteurs. Dans le cadre de la configuration de type « électrolyseur – électroanalyse », l’électrochimie usuelle offre la possibilité à l’expérimentateur d’imposer les réactions aux électrodes et de remonter, par analyse du courant électrique,1 à la concentration des espèces impliquées. On parle alors de capteurs. Leur mise en place nécessite donc un transfert d’électrons entre l’espèce ciblée (notée A) et l’électrode (Figure 4).2 C’est l’intérêt des biocapteurs à travers la modification de la surface d’électrode par une enzyme pour permettre/faciliter la détection.
Dans le dispositif illustré ci-dessus, les conditions expérimentales ne permettent pas l’oxydation de la molécule A. Cette oxydation peut être facilitée à travers la modification de surface de l’électrode par une enzyme (traits hachurés) qui jouera le rôle de médiateur ou d’agent de transfert. On parle alors de transducteur.
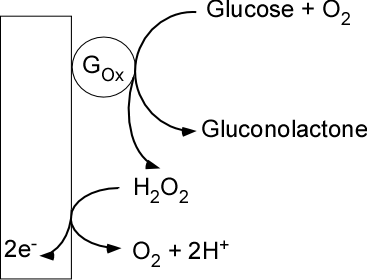
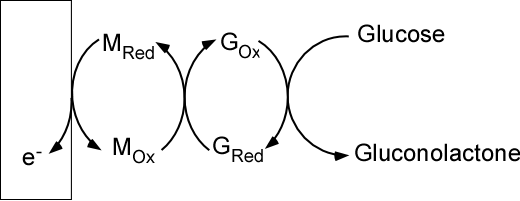
Il n’est pas de notre propos de lister tous les biocapteurs élaborés à ce jour dans cette contribution. Mentionnons toutefois à titre d’exemple l’un des plus populaires, à savoir le biocapteur à glucose. On devrait d’ailleurs parler de biocapteurs au pluriel puisque différentes générations/stratégies ont été élaborées dans les dernières décennies (Figures 5 et 6).
Dans ces premières générations, le glucose, qui ne peut être oxydé directement à l’électrode dans la gamme de potentiels appliqués est en premier lieu converti par l’enzyme en gluconolactone et en eau oxygénée H2O2 qui peut quant à elle être oxydée directement à la surface de l’électrode.
Dans ces secondes générations, le glucose est toujours converti en gluconolactone mais dans un second temps la forme « réduite » de l’enzyme est oxydée par le médiateur (Fe(CN)63- par exemple), dont la forme réduite est alors oxydée à la surface de l’électrode.
On remarquera que les aspects biologiques des biocapteurs sont multiples, que ce soient la modification de surface, la cible et son environnement puisque, pour ce qui est du glucose, il s’agit bien évidemment de le doser directement dans le sang. Il est évident que la mise en œuvre de ce type de capteurs correspond à de nombreux problèmes comme la sélectivité (seul le glucose doit être détecté, il faut éviter que d’autres espèces, nommées interférents, polluent l’analyse), la sensibilité (détecter de faibles quantités), la façon d’immobiliser ou de confiner l’enzyme…
Il va de soi que les biocapteurs ne se limitent pas à la détection du glucose et il en existe de nombreuses autres formes. Retenons la stratégie (Figure 7) qui consiste, toujours par modification de surface, à cette fois-ci empêcher la molécule A d’accéder à l’électrode pour s’oxyder. En présence d’un substrat d’intérêt S, A est libéré et permet d’obtenir un courant électrique qui témoigne indirectement de l’affinité de S pour la modification de surface.
Dans la stratégie illustrée ci-dessus, A peut parfaitement s’oxyder à la surface de l’électrode mais est retenu par la modification de l’électrode. C’est la présence d’un substrat S qui, en prenant la place de A, permet à ce dernier de générer un courant électrique via son oxydation.
Cette stratégie s’applique aux phénomènes de reconnaissance comme l’hybridation de l’ADN : on greffe un brin d’ADN à la surface de l’électrode en présence d’un médiateur. L’hybridation par le brin complémentaire libère alors le médiateur. Les études de complexation de protéines sont aussi envisageables la protéine cible est greffée à l’électrode et complexée par le médiateur. La présence en solution d’une molécule dont l’affinité est marquée pour la protéine libère le médiateur.
Autres apports de la bioélectrochimie
A travers biopiles et biocapteurs, la bioélectrochimie recense donc les applications qui consistent à mettre à profit la modification par voie biologique de la surface d’une électrode. Toutefois, il existe d’autres applications qui « échappent » aux biopiles et aux biocapteurs et la modification biologique de surface peut aussi être utilisée pour l’étude de la formation de biofilms sur une surface, c’est-à-dire la formation d’une structure particulière d’adhésion d’un organisme sur un matériau. L’étude de l’altération du matériau en raison de la présence de l’organisme correspond au phénomène de biocorrosion. Par ailleurs, le greffage d’une enzyme à la surface d’une électrode permet aussi l’étude du mécanisme de fonctionnement de l’enzyme en question. Il est important de noter que toutes ces thématiques supplémentaires sont complémentaires et interconnectées : fabriquer une biopile avec une enzyme nécessite la compréhension de son mécanisme de fonctionnement…
Cependant, il faut rester vigilant et ne pas se cantonner à une modification biologique de l’électrode. Ceci est d’ailleurs l’une des précautions de la définition donnée en introduction : la détection électrochimique de molécules biologiques ou de substances d’intérêt biologique (neurotransmetteurs, espèces réactives de l’oxygène, antioxydants…) émarge aussi en bioélectrochimie a fortiori sans nécessité de modification biologique de la surface de l’électrode. Le fait que ce type de travaux s’inscrive dans le domaine de la bioélectrochimie est d’ailleurs cohérent puisqu’il s’agit de considérer des (bio)molécules dans un environnement biologique (cellule vivante, cerveau, plasma sanguin…).
Conclusion
Les applications décrites plus haut représentent sans nul doute le corps et le cœur de la bioélectrochimie. Et si une définition claire se profile avec ses thématiques et applications, aucune de ces dernières ne l’épuise en totalité… Il peut en effet subsister des « doutes » sur l’appartenance d’autres thématiques qui associent un système biologique et un déplacement de charges sans qu’un transfert d’électrons entre une molécule et une électrode n’ait formellement lieu.1 C’est par exemple le cas de l’électrophysiologie (étude des canaux ioniques au sein des membranes cellulaires, des potentiels de membrane…), de l’électroporation (application d’une différence de potentiel à une cellule pour la rendre perméable et introduire de l’ADN) pour lesquelles aucune réaction « électrochimique » ne se produit. La question mérite aussi d’être posée pour l’étude des transports d’électrons dans les systèmes biologiques (chaîne respiratoire, chaîne photosynthétique2) qui ne nécessite pas forcément l’utilisation d’une électrode. Il faut d’ailleurs préciser que cet aspect est mentionné dans la présentation de M. Comtat en 1998 : « […] Par extension, c’est aussi la partie de l’électrochimie consacrée à l’étude des signaux électriques émis par les êtres vivants ou encore des réactions de ces derniers à l’application de champs électriques externes. » [2]. Remarquons qu’à la fin du XXème siècle, on parle prudemment d’extension… Si ce terme ne manque pas de pertinence, l’analyse du contenu des congrès scientifiques actuels posent toujours, un peu moins de 20 ans plus tard, la question de leur réelle appartenance à la bioélectrochimie. A cet égard, électrophysiologie, électroporation, photosynthèse représentent des domaines en soi, même si de nombreux arguments les rattachant à la bioélectrochimie restent parfaitement recevables.3
Il en ressort ainsi que la bioélectrochimie reste un vaste domaine dont le cœur est assez bien établi mais pas nécessairement les frontières qui le délimitent. Nous illustrerons cette ouverture avec un peu de provocation et de malice en citant Wikipedia, l’ami des étudiants, dont la définition de la bioélectrochimie ne manquera pas de faire réagir les principaux intéressés [5].
« La bioélectrochimie est une branche de l'électrochimie qui étudie des sujets comme le potentiel de membrane cellulaire, le transport cellulaire électron-proton et les réactions d'électrode d'enzymes d'oxydo-réduction. »
Finalement, Galvani et Volta étaient-ils bioélectrochimistes ?
Références
[1] http://www.bioelectrochemical-soc.org/.
[2] M. Comtat, Some aspects of bioelectrochemistry - introduction, Actualite Chimique, (1998) 74-74.
[3] F. Miomandre, S. Sadki, P. Audebert, R. Méallet-Renault, Electrochimie - des concepts aux applications, Dunod2014.
[4] C. Lefrou, P. Fabry, J.-C. Poignet, Electrochimie - concepts fondamentaux et illustrés, EDP Sciences2013.
[5] https://fr.wikipedia.org/wiki/Bio%C3%A9lectrochimie
Pour en savoir plus
Pour en savoir plus sur la controverse de GALVANI et VOLTA, consulter le site ampere.cnrs.fr, excellent site sur l'histoire de l'électricité. Vous y trouverez notamment des vidéos à montrer en classe.
Pour en savoir plus sur la bioélectrochimie, outre le site http://www.bioelectrochemical-soc.org/, consulter le site du Groupe Français de Bioélectrochimie.
Remerciements
Nous remercions le site ampere.cnrs.fr pour les portraits de Galvani et Volta.