La spectroscopie UV-Visible permet d’accéder qualitativement à des renseignements quant à la nature des liaisons présentes au sein de l’échantillon mais également de déterminer quantitativement la concentration d’espèces absorbant dans ce domaine spectral. Non destructive et rapide, cette spectroscopie est largement répandue en travaux pratiques de chimie ainsi qu'en analyse chimique ou biochimique.
Présentation
La nature de l’atome fait l’objet depuis des siècles de nombreuses tentatives de modélisation. A partir du XXème siècle, cette quête de l’infiniment petit a été marquée par la course effrénée entre les équipes de théoriciens qui, cherchant à unifier les différentes interactions fondamentales, prédisent l’existence de nombreuses particules élémentaires, et celles des expérimentateurs qui construisent des dispositifs complexes afin de prouver leur présence. La dernière particule élémentaire, le boson de Higgs, a ainsi été observée très récemment par le CERN, mettant un terme à des mois de suspense et validant la théorie unifiée des interactions fondamentales.
Principe de la spectroscopie UV - Visible
L’interaction électromagnétique est l’une des interactions concernées par ce modèle unifié. Elle rend compte de l’interaction entre une onde électromagnétique et une particule chargée. L’interaction matière-rayonnement en est une illustration parfaite. A l’échelle atomique, la matière n’étant pas continue mais constituée d’assemblage de particules élémentaires, l’énergie ne l’est pas non plus et ne peut prendre que des valeurs discrètes. L’énergie totale d’un édifice atomique peut se mettre sous la forme de la somme suivante :
E = Eél + Evib + Erot + Etrans
Eél représente l’énergie électronique, Evib l’énergie vibrationnelle, Erot l’énergie rotationnelle et Etrans l’énergie de translation du système.
Les trois premières sont de nature quantique, et par conséquent quantifiées, alors que le terme Etrans correspond à un mouvement macroscopique du centre de gravité de l’édifice. Ce dernier n’est donc pas quantifié et peut prendre ses valeurs dans un continuum d’énergie.
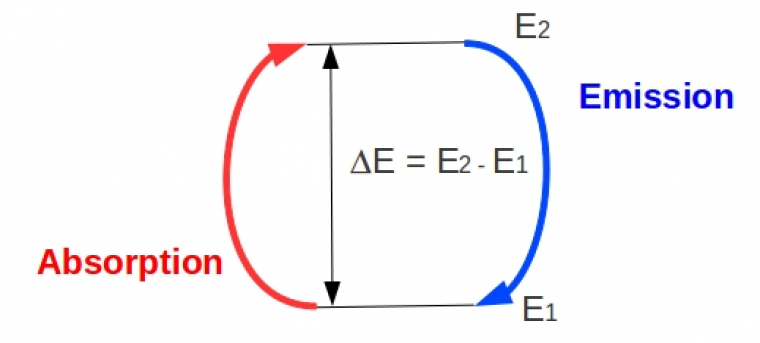
L’interaction électromagnétique caractérise l’aptitude d’un édifice atomique à voir son énergie modifiée par l’action d’un rayonnement électromagnétique. Soit un système atomique pouvant être caractérisé par deux niveaux énergétiques quantifiés E1 et E2 (avec arbitrairement E1 E2). Si le rayonnement électromagnétique permet de passer du niveau E1 au niveau E2, le système doit acquérir de l’énergie. On parle alors d’absorption. A contrario, le passage du niveau E2 au niveau E1 conduit à une libération d’énergie, il s’agit d’émission. L’absorption ou l’émission d’énergie se fait alors sous forme d’onde électromagnétique, dont l’énergie dépend fortement de l’ordre de grandeur de la différence d’énergie entre les deux états, notée ΔE, et donc intrinsèquement de la nature des niveaux concernés.
Dans le tableau ci-dessous sont rassemblés différents ordres de grandeur concernant les transitions énergétiques et le domaine des rayonnements électromagnétiques concernés.
| Transition électronique | Transition vibrationnelle | |
|---|---|---|
| Ordre de grandeur de ΔE (en eV) | 1 - 10 | 0,1 - 1 |
|
Ordre de grandeur de ΔE (en kJ.mol-1) |
100 - 1000 | 10 - 100 |
| Longueur d'onde du rayonnement émis ou absorbé | 300 - 800 nm | 1 µm |
| Domaine spectral | UV - Visible | Infrarouge |
Les ordres de grandeurs des transitions énergétiques présentées dans le tableau précédent illustrent le fait que les niveaux rotationnels sont des sous-structures des niveaux vibrationnels, eux-mêmes sous-divisions des niveaux électroniques. Cette structuration complexe des niveaux énergétiques permet donc un très grand nombre de transitions sous l’effet d’un rayonnement électromagnétique.
La fréquence ν du rayonnement émis ou absorbé et l’écart énergétique ΔE entre les niveaux initiaux et finaux sont reliés par la relation de Planck-Einstein : ΔE = ℎν, avec h la constante de Planck (h = 6,63.10-34 J.s).
Or, dans le vide, fréquence ν et longueur d’onde λ sont liées par la célérité de la lumière c : ν = c/λ. On en déduit alors la relation entre ΔE et λ : ΔE = ℎc/λ. On ne s’intéressera ici qu’aux transitions énergétiques absorbant ou émettant dans l’UV - Visible, c'est-à-dire mettant en jeu des transitions entre niveaux électroniques (mais modifiant évidemment les sous-structures vibrationnelles et rotationnelles). Ces niveaux électroniques correspondant à différentes configurations électroniques, le mécanisme d’absorption sera ainsi dû à l’excitation d’électrons de valence et l’émission à leur désexcitation.
D’un point de vue expérimental, la longueur d’onde (ou la fréquence) d’un rayonnement électromagnétique absorbé est donc caractéristique de la différence d’énergie entre deux niveaux électroniques. La spectroscopie d’absorption, conduisant expérimentalement à la détermination des longueurs d’ondes absorbées, permet ainsi d’obtenir les écarts ΔE entre niveau électroniques et par conséquent des renseignements sur la structure électronique de l’édifice. On ne s’intéressera par la suite qu’à la spectroscopie d’absorption.
Appareillage et fonctionnement
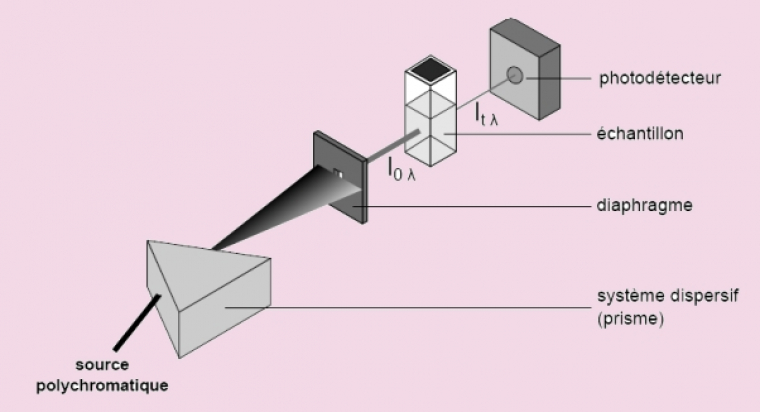
La détermination des longueurs d’onde des rayonnements électromagnétiques absorbés se fait grâce à l’utilisation d’un spectrophotomètre. L’appareil le plus utilisé en lycée est le spectrophotomètre mono-faisceau, dont le schéma de principe est présenté ci-dessous :
Une source polychromatique (émettant dans l’UV ou le visible) est placée devant un prisme. Ce système dispersif va décomposer le rayonnement polychromatique émis par la source. En orientant correctement le système diaphragme-échantillon-photodétecteur, la solution contenue dans la cuve sera irradiée avec un rayonnement quasi monochromatique. Le diaphragme, une simple fente fine, permet d’éclairer l’échantillon avec un faisceau de faible largeur, donc de bonne qualité monochromatique, le photodétecteur mesurant quant à lui l’intensité du rayonnement transmis après traversée de la solution échantillon, notée It,λ.
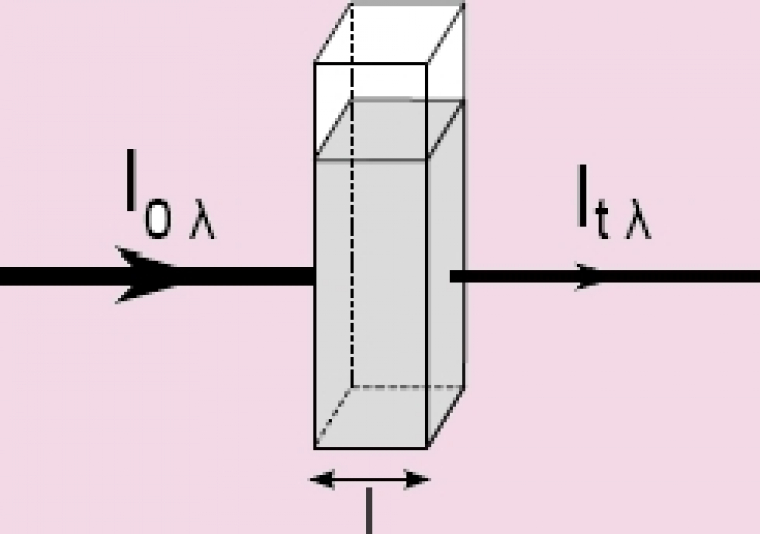
D’un point de vue pratique, l’échantillon est constitué de l’édifice à étudié, dissous dans un solvant et contenu dans une cuve. Il faut donc que solvant et cuve n’interfèrent pas dans les données mesurées. Ainsi on les choisira transparents dans le domaine choisi. Dans le commerce, il existe différentes cuves adaptées aux différents domaines spectraux rencontrés (plastique pour le visible, quartz de plus ou moins bonne qualité pour l’UV). Pour ce qui est du solvant, son influence est neutralisée en réalisant un blanc, c'est-à-dire en mesurant l’intensité du rayonnement transmis après traversée de la cuve ne contenant que du solvant. Les échantillons doivent être transparents afin d’éviter tout phénomène de diffusion : ne pourront être analysées que les solutions limpides dans des cuves propres.
Expérimentalement, l’appareil extrait comme donnée brute l’intensité It,λ, obtenue après traversée de la solution. Celle-ci étant dépendante de la source, on préfère calculer deux grandeurs dérivées : l’absorbance A et la transmittance T.
La transmittance T est définie par : T = It,λ / I0,λ. On l’exprime en pourcentage.
L’absorbance A se calcule par : A = log(I0,λ / It,λ) = - logT. C’est une grandeur positive.
Etude spectrophotométrique en UV-Visible
Dans une étude spectrophotométrique UV-Visible, il est d’usage de tracer le graphe de l’absorbance A en fonction de la longueur d’onde λ.
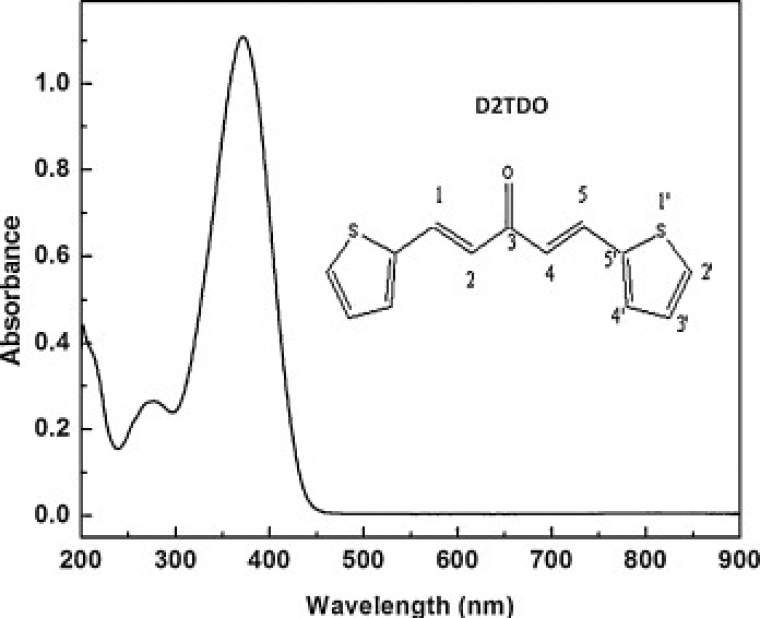
Par exemple, le spectre de la (1E,4E)-1,5-di-2-thiénylpenta-1,4-dièn-3-one (D2TDO) est représenté ci-dessous (25°C, acétonitrile) :
On remarque le spectre est constitué de bandes larges, et non de pics. De nombreuses transitions énergétiquement proches sont donc réalisées. Or si les transitions électroniques sont bien responsables de ces absorptions, les sous-structures vibrationnelles et rotationnelles, au sein d’un même niveau électronique, peuvent conduire à des transitions énergétiquement du même ordre de grandeur, partant et aboutissant aux même niveaux électroniques mais mettant en jeu des niveaux vibrationnels et rotationnels différents. Différents rayonnements électromagnétiques de longueurs d’ondes légèrement différentes conduisent alors à différentes transitions énergétiquement très proches et ainsi à des bandes d’absorption.
L’analyse d’un tel spectre mène à la détermination de la longueur d’onde du maximum d’absorption λmax. Dans l’exemple précédent, celle-ci est de 360 nm. Cependant, la donnée d’une telle longueur d’onde ne renseigne pas sur l’intensité de l’absorbance. Une donnée intensive et quantitative est nécessaire. Celle-ci est fournie par la loi de Beer-Lambert : pour une solution contenant une unique solution absorbante, A = ε.l.c, avec l la largeur de la cuve contenant l’échantillon (donc la longueur du chemin optique), c la concentration molaire de l’échantillon et ε le coefficient d’extinction molaire (exprimé usuellement en mol-1.L.cm-1 si l est exprimée en cm). Cette loi est valable pour les solutions transparentes, peu concentrées et dans ces conditions elle est également additive. Ainsi, la relation de linéarité est valide tant que l’absorbance garde des valeurs faibles (typiquement A inférieure à 1,5-2).
La relation de Beer-Lambert donne donc accès au coefficient d’extinction molaire ε qui caractérise l’absorption de l’édifice dans les conditions de l’expérience. Ainsi, il dépend de la température, de l’édifice et du solvant dans lequel est enregistré le spectre. En se plaçant à la longueur d’onde du maximum d’absorption, les coefficient εmax peut être calculé. La donnée de ces deux grandeurs (λmax ; εmax) est caractéristique de l’absorption d’un édifice dans des conditions expérimentales données, mais ne dépend pas de l’appareil utilisé.
Analyse de l'absorption
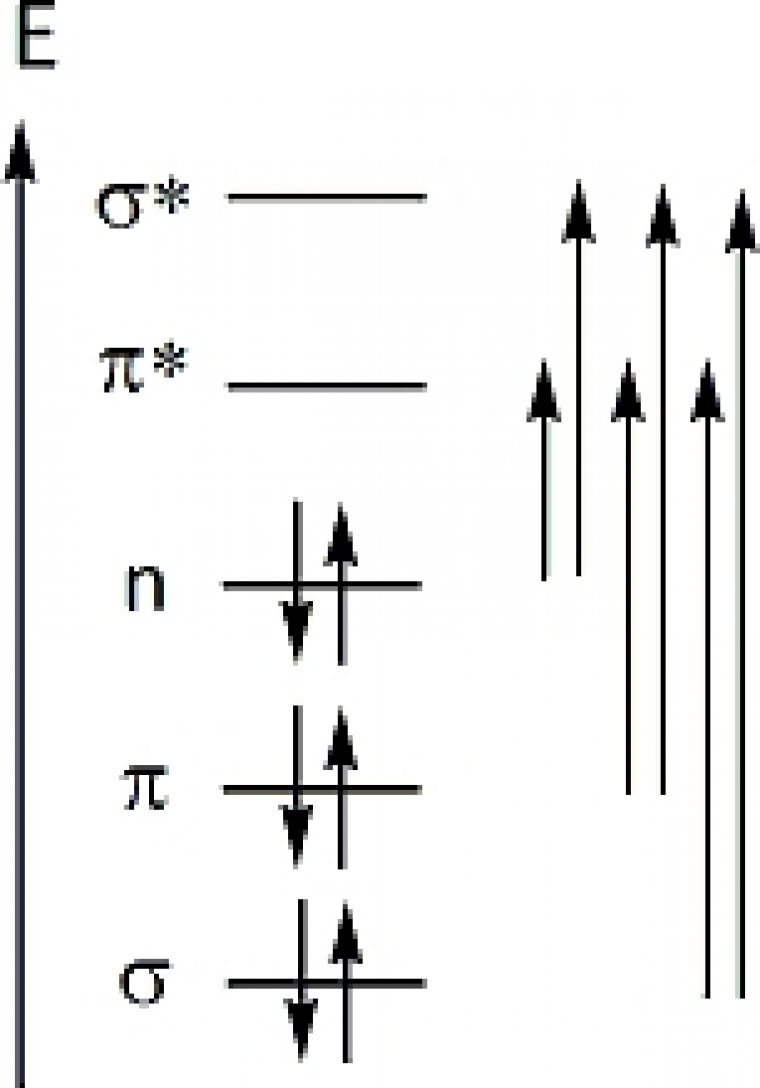
L’absorption provient d’une transition énergétique entre deux niveaux électroniques dont la nature joue fortement sur les deux grandeurs λmax et εmax. Dans le cas de molécules organiques les niveaux électroniques concernés par des transitions dans l’UV-Visible correspondent grossièrement aux orbitales de valence de l’édifice et leur énergie est dépendante de leur nature (σ, π) et de leur caractère (liante, antiliante, non liante). Schématiquement, l’ordre relatif des niveaux électroniques est le suivant :
De nombreuses transitions sont donc possibles mais seules celles de plus faibles énergies conduisent à une absorption dans l’UV-Visible. La nature σ ou π des niveaux impliqués reflètent la nature du groupe fonctionnel présent dans l’édifice. Certaines fonctions organiques provoqueront donc une absorption, ce sont des chromophores. L’enregistrement d’un spectre UV-Visible peut donc, à l’instar de la spectroscopie Infrarouge, conduire à l’identification des fonctions présentes dans une molécule organique. Les ordres de grandeurs de nombreux chromophores caractéristiques sont tabulés :
| Chromophore | Transition | λmax | log(εmax) |
|---|---|---|---|
| Alcène | π-π* | 175 | 3,0 |
| Alcool | n- σ* | 180 | 2,5 |
| Aldéhyde - Cétone | π-π* n-π* |
180 280 |
3,0 1,5 |
| Acide carboxylique | n-π* | 205 | 1,5 |
| Nitro | n-π* | 271 | inférieur à 1 |
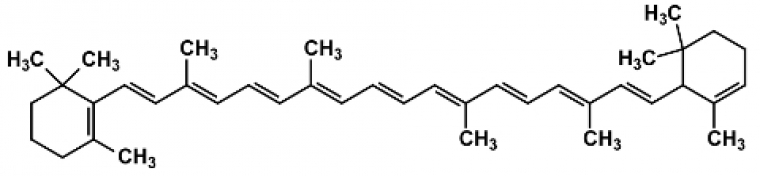
La présence de liaisons multiples et de doublets non liants permet en général une bonne absorption dans l’UV-Visible. De plus, la conjugaison du système π conduit à un resserrement des niveaux π et π* et par conséquent une augmentation du λmax. Il s’agit de l’effet bathochrome. Si les alcènes absorbent de façon caractéristique dans l’UV, les polyènes voient leur λmax augmenter avec le nombre de liaisons π conjuguées pour finir par atteindre le domaine du visible pour les grandes molécules conjuguées. Ainsi, le β-carotène, contenant 11 liaisons C=C conjuguées, a son maximum d’absorption vers 450 nm.
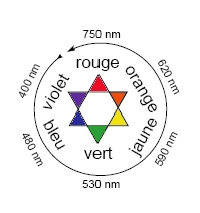
Une solution de β-carotène absorbant dans le bleu, elle ne laisse passer que les radiations peu absorbées et apparait alors de sa couleur complémentaire, l’orange. Le cercle chromatique permet de la retrouver facilement.
Dans le cas des complexes des métaux de transitions, les transitions électroniques sont réalisées entre orbitales d, dont la dégénérescence a été levée par les ligands. Il s’agit alors de transitions d-d, en général peu intenses et qui conduisent souvent à des absorptions dans le visible. C’est le cas par exemple des complexes hexaaqua des métaux : [Cu(H2O)6]2+ (bleu), [Ni(H2O)6]2+ (vert)…
Conclusion
La spectroscopie UV-Visible permet ainsi d’accéder qualitativement à des renseignements quant à la nature des liaisons présentes au sein de l’échantillon (via l’ordre de grandeur de λmax et εmax) mais également de déterminer quantitativement la concentration d’espèces absorbant dans ce domaine spectral (via la loi de Beer-Lambert). Non destructive et rapide, cette spectroscopie est largement répandue en travaux pratiques de chimie (après construction d’une droite d’étalonnage et report d’une mesure expérimentale) ainsi qu'en analyse chimique ou biochimique. On peut citer par exemple le dosage des ions nitrates dans les eaux de piscine (après adjonction d’un additif formant un complexe coloré) ou la détermination de la pureté de l’ADN et de certaines protéines après leur extraction.
Bibliographie
Techniques expérimentales en Chimie, Anne-Sophie Bernard et al., Dunod, 2012.