ette revue de presse est le fruit des lectures de divers périodiques par des enseignants de sciences physiques au cours des mois de septembre et octobre 2022. Elle vise à proposer une sélection d'articles utiles pour les professeurs de chimie. Bonne lecture !
Le Bup — octobre 2022
Intérêt de la méthode des ajouts dosés en spectroscopie UV-Visible d’absorption et d’émission : application aux boissons Tonic — Partie 4 : dosage de la quinine dans le Pink Tonic Schweppes®
BUP, octobre 2022, p. 911-927.
J. Piard, S. Sripathy
Après l’étude d’une boisson de Schweppes dans les parties I, II et III publiés récemment dans le BUP, ce quatrième volet se propose d’étudier un dérivé commercial de la marque : le Pink Tonic Schweppes®. L’article montre la pertinence de la spectroscopie de fluorescence par rapport à celle d’absorption pour doser la quinine présente dans ce breuvage. Si la quinine est l’unique fluorophore de la boisson, la présence de colorants (des anthocyanes), donnant à la boisson de « Pink Tonic » sa couleur rose, freinent la détermination de la concentration de la quinine par spectroscopie d’absorption. En effet, alors que tous les chromophores contribuent au spectre d’absorption UV-visible, seule la quinine contribue au spectre d’émission de fluorescence. Le choix pertinent de la fluorescence comme technique de dosage spectroscopique se justifie d’autant plus que la quinine est présente en des concentrations très faibles (4,0 × 10−6 mol∙L−1). Les auteurs reviennent ensuite (comme dans les premières parties) sur l’intérêt de la méthode des ajouts dosés par rapport à celle d’étalonnage par droite externe, les effets de matrice y étant moins marqués dans le premier cas.
Détermination de la balance hydrophile lipophile critique (HLB critique) des émulsions huile dans l’eau (H/E) par conductimétrie
BUP, octobre 2022, p. 929-934.
B. Devallez, L. Solé-Violán
Un article qui n'est plus en adéquation avec le référentiel de BTS Métiers de la Chimie mais qui présente une application intéressante de la conductimétrie aux émulsions.
Les auteurs mettent en évidence le choix de la conductimétrie pour déterminer la quantité optimale de tensioactifs à ajouter à une émulsion de type huile/eau.
Si la fabrication d’émulsion est aisée, sa stabilisation est plus délicate. Un mélange de deux tensioactifs (non ioniques) : l’un plutôt hydrophile (ici du Tween), l’autre plutôt lipophile (ici du Span) est généralement ajouté à une émulsion pour la stabiliser. On associe à ce mélange de tensioactifs une grandeur appelée HLB (hydrophilic lipophilic balance). Le HLB dit critique (noté HLBcritique) détermine la quantité optimale de chaque tensioactif à ajouter pour stabiliser l’émulsion. Pour connaître ce HLBcritique, une mesure de la conductivité des différentes émulsions préparées est réalisée. La conductivité (non nulle) s’explique par la présence d’ions formés par autoprotolyse de l’eau et de charges présentes en surface des gouttelettes d’huile dispersées.
Pour les deux émulsions (huile d’amande douce / eau et huile de vaseline / eau) on observe une même évolution de la conductivité avec le HLB. L’augmentation de la conductivité pour un HLB inférieur au HLBcritique s’explique par l’ajout de plus en plus grand de tensioactifs qui diminuent la tension de surface huile/eau. Ceci participe à la formation de gouttelettes d’huile plus petites entraînant alors un nombre de porteurs de charge croissant dans le milieu. La diminution de la conductivité au-delà du HLBcritique s’explique quant à elle par un encombrement de plus en plus important entre les molécules de tensioactif à l’interface huile/eau. Cet encombrement entraîne une augmentation du volume des gouttelettes de l’émulsion conduisant à une diminution de la mobilité des porteurs de charge. L’extrapolation des deux portions de droite permet d’obtenir le HLBcritique.
L’Actualité Chimique — septembre et octobre 2022
Numéro de septembre
La découverte des acides tartriques : un pas vers la compréhension de la chiralité
Actualité Chimique, septembre 2022, p. 42-48.
H. This
Une mise en perspective riche et documentée pour découvrir les expériences et réflexions qui ont mené au concept actuel de chiralité. Avec les développements parallèles de la cristallographie et de l’étude d’une lumière polarisée, de nombreux physiciens et chimistes, du 16e jusqu’au 20e siècle, ont forgé des notions nous permettant aujourd’hui de contrôler la synthèse des carbones asymétriques. C’est avec intérêt que l’on rencontre de grands noms — tels Seignette, Haüy, Malus, Arago, Scheele, Laurent — et leurs travaux novateurs à l’époque. L’auteur tient par ailleurs à réhabiliter tous ces pionniers ou contemporains de Pasteur, qui ont été parfois oubliés dans l’avènement de la chiralité. Un article de qualité pouvant aider à l’introduction d’un cours sur la stéréochimie des molécules organiques.
Le CO2 supercritique pour la régénération des masques FFP2
Actualité Chimique, septembre 2022, p. 63-64.
C. Aymonier, A. Cario, G. Aubert, T. Voisin
Le CO2 supercritique (sc), principalement utilisé dans l’extraction (de la caféine notamment), trouve aussi de nombreuses utilisations dans les domaines du recyclage et de la régénération des matériaux.
Les auteurs.trices ont développé un procédé innovant de décontamination des masques FFP2 : ces derniers sont placés dans une autoclave, tout d’abord en présence de CO2(g) puis la température et la pression sont ajustées pour une conversion du dioxyde de carbone l’état supercritique. Après une heure de traitement et évacuation du CO2(sc), les masques ressortent nettoyés, sans trace microbienne,
et ne présentent pas d’altération de leurs fibres, ce qui leur confère toujours d’excellentes propriétés filtrantes. Un exemple original et d’actualité pour illustrer le cours sur les digrammes de phase.
Numéro d’octobre : dossier thématique sur la diffusion de neutrons
La diffusion de neutrons, une technique majeure et interdisciplinaire
Actualité Chimique, octobre 2022, p. 13-17.
S. Petit, F. Damay
La diffraction des rayons X est une technique majeure de détermination de structures, développée dès le début du 20e siècle. Les neutrons peuvent également être diffractés à la rencontre de la matière. Contrairement aux rayons X, sensibles à la densité électronique d’un atome, les neutrons interagissent avec les noyaux via l’interaction forte. Cette méthode permet ainsi la distinction entre deux isotopes d’un même élément. Par ailleurs, le neutron présente un spin non nul (+½) : sa diffraction est influencée par les propriétés magnétiques de la matière. Enfin, en comparaison des rayons X, les neutrons présentent une forte profondeur de pénétration, permettant de sonder un matériau sur des distances importantes. Un article pour découvrir cette technique et certaines de ses applications.
Vers l’atome quantique
Actualité Chimique, octobre 2022, p. 47-52.
A. Dumon
Un article d’histoire des sciences de qualité, comme nous les propose souvent Alain Dumon.
Nous (re)découvrons avec plaisir comment Niels Bohr, alors stagiaire chez Rutherford, propose une première description quantique de l’atome, en opposition au modèle planétaire de son maitre de stage. Bohr agrège toutes les preuves de discontinuité avancées par Planck, Einstein, Balmer ou encore Rydberg pour présenter son modèle révolutionnaire, où les électrons occupent des orbites stationnaires, ne pouvant en changer que par transfert de quanta d’énergie h.n. Au nombre quantique principal introduit par Bohr, s’ajoutent progressivement les nombres quantiques azimutal et magnétique, permettant de comprendre la structure fine associée aux effets Zeeman et Stark. Avec le 4e nombre quantique, relatif au spin de l’électron, il devient possible de décrire la structure électronique de tous les éléments du tableau de Mendéléiev. Les apports de Schrödinger et sa mécanique ondulatoire, d’Heisenberg et sa mécanique matricielle ou encore de Born et son interprétation probabiliste sont autant de points de vue à confronter lors de la célèbre conférence de Solvay (1927). L’auteur cite dans le texte les réflexions et oppositions des plus éminents savants de l’époque, qui semblent converser entre les lignes. Un article à lire et relire pour préparer son cours sur l’atome et tenter de saisir toute la difficulté qu’il a fallu surmonter pour glisser d’une description classique vers un modèle quantique de l’atome.
Journal of Chemical Education — octobre 2021 à octobre 2022
Revue de presse sur le thème « équilibres entre phases liquides »
Miscibilité partielle en phase liquide
a. Liquid−Liquid Demonstrations: Phase Equilibria and the Lever Rule, J. C. Williamson, J. Chem. Educ. 2021, 98, 2356−2363 (juillet 2021)
b. Liquid−Liquid Demonstrations: Critical Opalescence, J. C. Williamson, J. Chem. Educ. 2021, 98, 2364−2369 (juillet 2021)
c. Liquid−Liquid Demonstrations: Spinodal Decomposition, J. Chem. Educ. 2021, 98, 2370−2375 (juillet 2021)
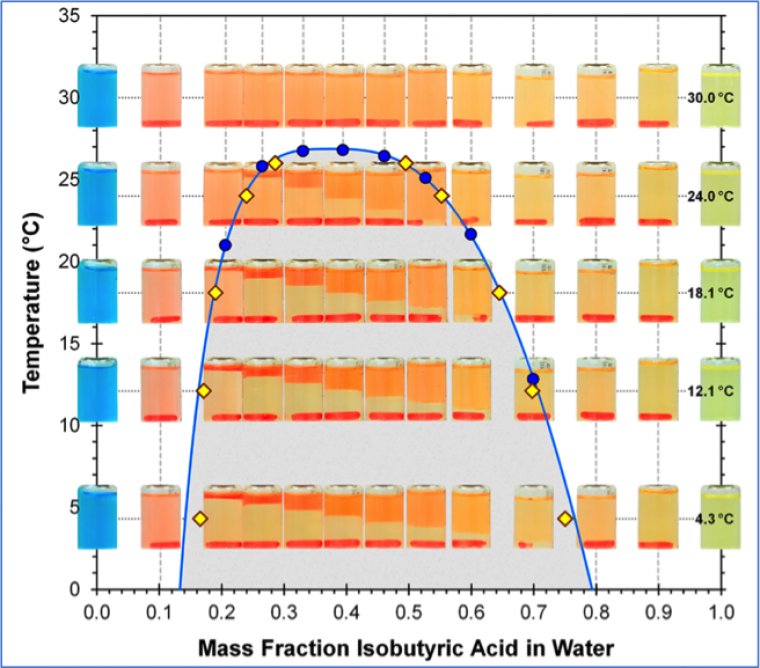
Cette série de trois articles décrit la miscibilité partielle de l’acide isobutyrique et de l’eau.
Le premier (a.) décrit le tracé expérimental de la courbe de démixtion, tracé qui s’effectue au voisinage de la température ambiante et pose peu de problèmes de sécurité et de coût (seule l’odeur de l’acide isobutyrique peut poser problème !). Les nombreuses photos des expériences peuvent être utiles pour illustrer un cours, et des expériences de cours inspirées de l’article peuvent être envisagées.
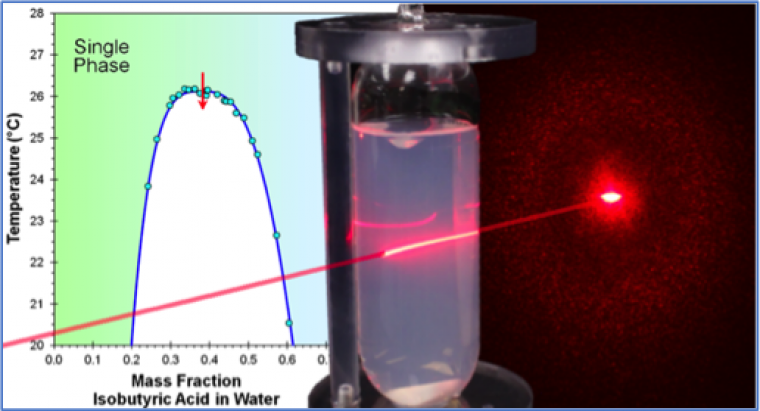
Les deux autres articles (b. et c.) s’intéressent aux propriétés optiques de ces mélanges en lien avec le phénomène de démixtion.
d. Student Discovery of the Relationship between Molecular Structure, Solubility, and Intermolecular Forces, B. L. Baldock et al., J. Chem. Educ. 2021, 98, 4046−4053 (décembre 2021).
Cet article propose une activité expérimentale d’étude semi-quantitative de la solubilité de quelques alcools dans l’eau. Ces expériences simples permettent de discuter les interactions entre entités, le caractère plus ou moins hydrophobe des alcools selon la taille et la structure du squelette carboné…
Partage d’un soluté entre deux phases liquides, extractions liquide/liquide
a. Colorful Approach to Teaching Extraction Using Azo Dyes and Comparison of Hands-On vs Distance Learning Assessment, M. A. Grimminger et al., J. Chem. Educ. 2021, 98, 3509−3513 (novembre 2021)
L’extraction liquide/liquide est illustrée expérimentalement à l’aide de colorants azoïques présentant différentes propriétés acidobasiques, qui sont dissous dans un solvant organique (acétate d’éthyle) puis extraits par des phases aqueuses de différents pH.
b. A Colorful Solvent Extraction Demonstration for Teaching the Concept of “Like Dissolves Like”, D. Dobberpuhl et al., J. Chem. Educ. 2022, 99, 3342−3345 (septembre 2022).
Cet article présente une expérience de démonstration très simple d’extraction par un solvant organique (pentanol) d’un colorant organique initialement dissous en solution aqueuse avec du sulfate de cuivre.
c. A Multioutcome, Guided Inquiry-Based Liquid–Liquid Extraction Laboratory for Introductory Organic Chemistry,
Kylie L. Luska, Journal of Chemical Education Article ASAP DOI: 10.1021/acs.jchemed.2c00396
Dans cet article décrivant une activité avec démarche d’investigation, des mélanges de trois espèces colorées en solution sont séparés en jouant sur les propriétés des colorants : un des colorants passe dans la phase aqueuse quel que soit le pH de celle-ci, un autre passe en phase organique quel que soit le pH de la phase aqueuse, et le troisième passe dans l’une ou l’autre des phases selon le pH de la phase aqueuse.
Mesure du coefficient de partage octanol/eau comme caractérisation du produit d’une synthèse organique
“Bitter” Results: Toward Sustainable Synthesis of the Most Bitter Substances, Denatonium Saccharinate and Denatonium Benzoate, Starting from a Popular Anesthetic, Lidocaine, W. Stchowiak et al., J. Chem. Educ. 2022, 99, 1604−1611
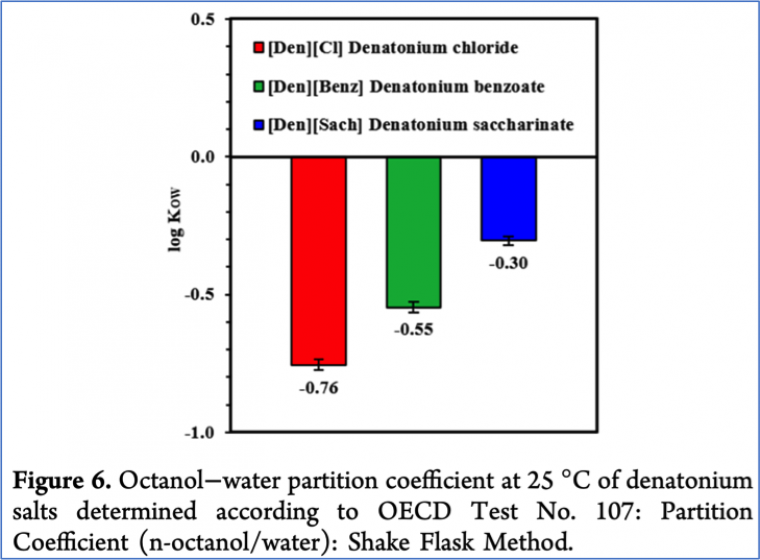
Cet article décrit la synthèse à partir de la lidocaïne de différents sels de dénatonium, cation utilisé pour son goût extrêmement amer comme additif destiné à éviter des intoxications accidentelles. En plus de la synthèse, la mesure de la solubilité des sels dans l’eau ainsi que celle des coefficients de partage octanol/eau (log P) sont réalisées. La réalisation de l’ensemble des expériences est assez exigeante mais les discussions possibles autour de cette synthèse sont riches : contextualisation (applications du produit de la synthèse, discussion sur les anesthésiques), réactions de substitution nucléophile, choix du solvant et enjeux environnementaux, substitution du contre-ion et conséquences sur les propriétés, utilisation de log P comme propriété intéressante dans un contexte pharmaceutique.