Le minerai aurifère extrait des différentes exploitations contient d'autres composés chimiques qu'il faut séparer de l'or. Après un broyage fin de ce minerai, celui-ci est plongé dans une solution aqueuse de cyanure. Ainsi, l'or contenu dans le minerai se dissout dans la solution cyanurée afin de former les complexes aurocyanures étudiés. Il reste ensuite à traiter cette solution.
Or et Oxydation
L'or est qualifié de métal noble du par sa très grande inertie chimique face aux acides ou face à l'oxydation, notamment celle de l'air (dioxygène) ou de l'eau. Les potentiels standards associés aux couples de l'or Au(I)/Au et Au(III)/Au sont en effet très élevés, expliquant cette inertie chimique face aux oxydants. La constante d'équilibre thermodynamique associée à la réaction d'oxydoréduction entre l'or et l'eau ou bien entre l'or et le dioxygène est ainsi très inférieure à 11.
Les potentiels standards des couples mis en jeu sont :
E°(H+/H2) = 0,0 V ; E°(O2/H2O) = 1,23 V ; E°(Au3+/Au) = 1,50 V ; E°(Au+/Au) = 1,68 V.
L'oxydation de l'or par l'eau ou le dioxygène de l'air est impossible. Le pouvoir réducteur de l'or est trop faible.
En présence d'ions cyanure
Si l'on place une feuille d'or à la surface d'une solution aqueuse d'ions cyanure (préparée à partir de cyanure de potassium KCN), on observe la disparition de cette feuille d'or au bout de quelques minutes1. L'oxydation de l'or par l'eau est ainsi effective, rendu possible par la diminution du potentiel standard des couples Au(I)/Au et Au(III)/Au par complexation des ions aureux - Au(I) - et aurique - Au(III) - par le cyanure (figure 2). On assiste alors à un renforcement du pouvoir du réducteur conjugué - Au -, perdant ses propriétés de métal noble.
Par complexation avec le cyanure, le pouvoir réducteur de l'or est accru ; son oxydation par l'eau (et le dioxygène dissous dans l'eau) devient possible.
Cette diminution du potentiel standard des couples associés aux ions aureux Au+ et aurique Au3+ s'explique par la valeur des constantes de dissociation KD correspondantes à ces réactions de complexation :
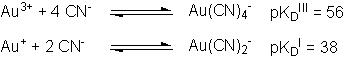
Les demi-équations électroniques - RédOx - associées à ces deux complexes s'écrivent alors :
Au(CN)4- + 3 e- = Au + 4 CN-
Au(CN)2- + e- = Au + 2 CN-
Une application simple de la loi de Nernst permet d'exprimer les potentiels standards des couples Au(CN)4-/Au et Au(CN)2-/Au en fonction des potentiels standards des couples Au3+/Au et Au+/Au et des constantes de dissociation pKDIII et pKDI respectivement.
E°(Au(CN)4-/Au) = E°(Au3+/Au) – 0,06/3 pKDIII
A.N. : E°(Au(CN)4-/Au) = 0,38 V
E°(Au(CN)2-/Au) = E°(Au+/Au) – 0,06 pKDI
A.N. : E°(Au(CN)2-/Au) = -0,60 V
En utilisant la figure 2, on peut alors conclure sur l'observation expérimentale : la feuille d'or disparaît en milieu cyanure car l'or est devenu un métal réducteur. Notamment, il peut être oxydé par l'eau au degré (I), sous forme du complexe Au(CN)2-, ou bien par le dioxygène de l'air au degré (III), sous forme du complexe Au(CN)4-.
Application dans l'extraction de l'or
Le minerai aurifère extrait des différentes exploitations contient d'autres composés chimiques qu'il faut séparer de l'or. Après un broyage fin de ce minerai, celui-ci est plongé dans une solution aqueuse de cyanure. Ainsi, l'or contenu dans le minerai se dissout dans la solution cyanurée afin de former les complexes aurocyanures étudiés ci-avant, en particulier le complexe Au(CN)2-.1
Il reste ensuite à traiter cette solution ; on retiendra la méthode par adsorption de ces complexes aurocyanures sur charbon actif. Les complexes aurocyanures vont ainsi se fixer au moyen d'interaction de type Van der Waals sur le charbon actif ; on parle de physisorption [4]. On recueille alors ce charbon dont on extrait une solution enrichie en ions aureux et auriques. Cette solution est finalement soumise à une électrolyse, permettant de récupérer l'or métallique sur électrodes. Celui-ci sera fondu puis coulé en lingots (figure 3).
Bibliographie
[1] B. Fosset, J.-B. Baudin, F. Lahitète, V. Prévost, « Chimie «tout-en-un» 2e année PC-PC* », 2006, Dunod.
[2] J. Sarazin, M. Verdaguer, « L'Oxydoréduction : Concept et Expériences », 1991, Ellipse.
[3] P.-W. Atkins, J. de Paula, « Chimie Physique », 2004, De Boeck.