L'inhalation ou l'ingestion chronique de particules de peinture à base d'oxydes de plomb ou de cérusite par les peintres ou les occupants de logements insalubres notamment des enfants en bas-âge, peut être la source de graves contaminations.
Sources de contamination
Mentionnée probablement pour la première fois dans le Livre de l'Exode, la consommation de plomb a traversé les âges depuis la haute antiquité en dépit de sa toxicité déjà décrite 2 siècles avant J.-C. par Nicander [1]. Des travaux archéologiques récents ont mis en évidence des sites de production à partir de la galène (PbS) en Asie centrale datant d'environ 6 500 ans avant notre ère [2] et le développement d'une chimie du plomb en Egypte ancienne vers 3 000 avant J.-C. essentiellement liée à l'élaboration de cosmétiques [3]. Des récipients datés approximativement à 1 000 avant J.-C. ont été mis à jour en Chine. En Europe, l'exploitation minière du gisement de Laurion en Grèce qui fut la plus importante de l'antiquité, a débuté vers 850 avant J.-C. [2]. La Rome antique a fait grand usage de ce métal et de ses alliages pour manufacturer une myriade d'objets de la vie courante comprenant des ustensiles de cuisine, des jarres, des urnes, des canalisations... La révolution industrielle a entraîné de nouvelles utilisations massives dans l'agriculture, la construction, l'industrie et l'imprimerie. En 1998, la production mondiale de plomb était de 6 millions de tonnes. La consommation française était de 273 000 t, dont 72 % pour la production de batteries et accumulateurs, 10 % pour des produits divers ouvrés en plomb, 7 % pour la chimie (production de certains plastiques, sels...) et 15 % pour des usages divers.
Les dommages physiques occasionnés par l'utilisation de la cérusite (Pb(CO3)), du minium (2PbO·PbO2), du massicot ou de la litharge (PbO) comme cosmétiques, pigments de peinture ou de poterie, dans les encres [4] sont également bien connus [5,6]. L'inhalation ou l'ingestion chronique de particules de peinture à base d'oxydes de plomb ou de cérusite par les peintres1 ou les occupants de logements insalubres notamment des enfants en bas-âge [7], peut être la source de graves contaminations [8]. L'utilisation du plomb dans les batteries automobiles, les munitions2 ou dans les verres techniques, écrans de télévision ou d'ordinateur, peut conduire à une pollution de l'environnement, en l'absence actuelle de circuits de retraitement totalement sécurisés. Des composés organiques du plomb ont été utilisés jusqu'à une époque très récente comme additifs anti-détonants dans l'essence.
Les sources d'exposition professionnelles sont nombreuses et pour l'essentiel par voie aérienne. Elles concernent notamment les métiers liés à l'extraction minière, à la préparation du plomb pour fabriquer des objets manufacturés, à l'assemblage et la réparation automobile, à la fabrication d'accumulateurs électriques (batteries), de céramiques, d'armes à feu ou de munitions, au soufflage du verre, etc. Tous les métiers concernant la fusion et le raffinage du plomb comportent un risque élevé d'intoxication.
Dans la vie quotidienne, les sources d'exposition sont multiples. L'ingestion du plomb par voie respiratoire représente environ 30 % de l'absorption totale. L'augmentation du taux de plomb dans l'air ambiant est particulièrement notable dans les grandes villes ou à proximité de sites artisanaux ou industriels émettant du plomb dans l'atmosphère (fonderies primaires et de recyclage, métallurgie, combustion du charbon, incinération des déchets...). La directive du 22/04/99 a fixé la valeur limite moyenne annuelle de plomb dans l'air à 0,5 µg.m-3, valeur qui était déjà respectée dans la majorité des villes, sauf influence directe de sources industrielles. En site éloigné de sources d'émission, les concentrations mesurées sont typiquement inférieures à 0,5 µg.m-3. Jusqu'à très récemment, les échappements de véhicules à essence sans pot catalytique, qui utilisaient encore de l'essence au plomb (il s'agit dans ce cas de composés organo-métalliques où le plomb est au degré d'oxydation +IV), constituaient une source de pollution très importante de l'air. La directive européenne du 13/10/98 a proscrit l'usage des additifs alkylés du plomb dans les carburants depuis le 1er janvier 2000. Les mesures législatives prises depuis 1990 ont permis de réduire considérablement l'augmentation des risques diffus pour la population, en Europe et en France. Les émissions aériennes de plomb ont ainsi été réduites de 4 576 t en 1990 à 1 190 t en 1998, soit une diminution de 75 %. A Paris, les analyses au milieu du trafic indiquent une très nette amélioration de la qualité de l'air, la teneur en plomb est passée de 8 µg.m-3 en 1978 à 0,2 µg.m-3 en 1997. Les anciennes peintures de certaines habitations vétustes sont particulièrement dangereuses, puisqu'elles sont responsables de la plupart des cas de saturnisme relevés en France ces dernières années. Généralement absorbées par les enfants en bas âge sous la forme d'écailles, celles-ci peuvent contenir jusqu'à 3 mg.g-1 de plomb. Le tabagisme représente un apport important pour les fumeurs, à raison de 8 à 23 µg de plomb par cigarette. Les aliments sont, en moyenne, à l'origine de 63 % des apports journaliers . La teneur en plomb est extrêmement variable, s'échelonnant par exemple entre 15 µg.L-1 dans le lait à 70 µg.L-1 dans le vin voire jusqu'à 200 µg.L-1 dans certains vins blancs ou rosés. En 1991, la concentration moyenne dans la viande de boeuf était de l'ordre de 100 µg.kg-1. Cependant, la consommation de certaines viandes équines, de poissons et crustacés peut entraîner l'absorption de doses nettement plus importantes (1 mg.kg-1).
Bref aperçu toxicologique
Chez l'homme, les effets biologiques liés à l'ingestion gastro-intestinale chronique du plomb présent dans l'alimentation et/ou les boissons (saturnisme hydrique), l'absorption de particules et composés chargés en plomb par voies respiratoires et cutanées sont particulièrement sévères, voire irréversibles. Au début des années 80, on dénombra plus de 200 cas d'hospitalisation en France pour intoxication saturnine liée à la circulation de l'eau dans des canalisations en plomb [10]. En 20 ans, le taux de plomb dans le sang (la plombémie) a en moyenne diminué de 50 % dans la population française, atteignant en moyenne 65 µg.L-1. Cependant des efforts importants restent nécessaires : à titre de comparaison, la plombémie moyenne de la population est de 23 µg.L-1 aux Etats-Unis.
Les intoxications touchent de nombreuses fonctions vitales [11]. L'insolubilité in-vivo de la majorité des composés du plomb limite la quantité retenue dans l'organisme à environ 10 % de la totalité ingérée. Lorsque le plomb pénètre dans le milieu sanguin, le métal est rapidement mobilisé à plus de 95 % par les erythrocytes puis distribué dans tous les organes mous. Il s'accumule ainsi dans le foie, les reins, le cerveau, le coeur et seuls 3 % environ restent dans le plasma sanguin [12]. En l'absence de voie d'excrétion, il se dépose à raison de 90 % dans les os sous la forme de phosphates insolubles où il s'insère dans le réseau cristallin de l'hydroxyapatite (Ca10(PO4)6(OH)2), le principal constituant des tissus osseux [12]. Le plomb constitue par ailleurs un poison du système nerveux, et peut provoquer des dommages irréversibles dans le développement de l'enfant [11]. Cette neurotoxicité est due à la perturbation des mécanismes de libération de neurotransmetteurs, régulés par le calcium [13]. Les conséquences sont surtout marquées au cours de deux périodes critiques : la petite enfance car l'absorption de plomb est beaucoup plus importante qu'à l'âge adulte, et la vieillesse, car le plomb, fixé dans les os pendant la vie, est alors relargué dans le sang.
La toxicité de ce métal, amplement décrite dans la littérature [8], est intimement liée aux propriétés électroniques particulières de l'ion Pb2+ et notamment de son caractère acide intermédiaire dans la classification HSAB (Hard and Soft Acids and Bases) développée par Pearson [14,15]. Selon cette théorie, l'interaction entre deux entités est assimilée à un équilibre acide-base. Les ions ou les atomes (soufre) aisément polarisables sont considérés comme "mous", tandis que ceux qui possèdent une densité de charge plus élevée sont dits "durs" car leur nuage électronique est moins apte à se déformer. Dans le premier cas, les liaisons formées possèdent un caractère covalent contrairement au second, où la liaison est de type ionique. Les ions susceptibles d'être présents dans l'eau du robinet ainsi que certains métaux toxiques peuvent être ainsi répartis en trois catégories rappelées dans le tableau 1. L'affinité d'un ion métallique pour un atome donneur peut ainsi être prédite puisqu'un métal "mou" se lie préférentiellement à des ligands "mous" (groupes thiol ou thiolate par exemple), il en va de même pour les partenaires "durs" (amines, groupements oxygénés...). De par son caractère intermédiaire, le plomb ne présente pas de préférence marquée pour l'une ou l'autre catégorie des atomes donneurs puisqu'il s'accommode aussi bien à un environnement oxygéné, azoté ou soufré avec une grande adaptabilité de la géométrie de coordination. Ainsi, l'ion Pb2+ peut former entre deux et dix liaisons avec les atomes qui l'entourent.
| Acides durs | Acides intermédiaires | Acides mous |
|---|---|---|
| H+, Li+, Na+, K+ | Co2+, Ni2+, Cu2+, Zn2+ | Cs+ |
| Mg2+, Ca2+, Sr2+, Sn2+ | Pb2+ | Ag+ |
| Al3+, Sc3+, Ga3+, In3+ | Hg2+, Cd2+ | |
| Cr3+, Fe3+, As3+ |
Tableau 1. Classification selon la théorie HSAB des cations susceptibles d'être contenus dans l'eau [14,15].
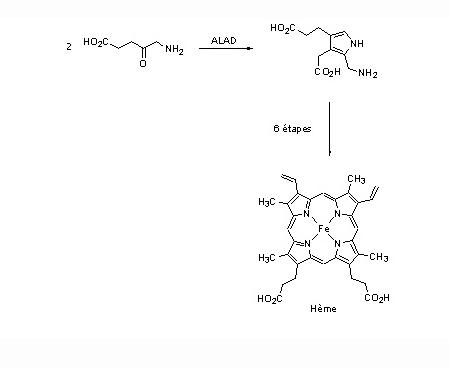
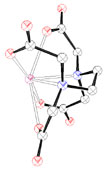
L'interaction des ions Pb2+ avec les résidus phosphate [16] et thiolate [17] présents dans de nombreuses enzymes, les acides nucléiques, en particulier avec les ARN de transfert, est à l'origine de nombreux troubles physiologiques car ils perturbent ainsi la biosynthèse des protéines. Ils se fixent de la même manière au niveau des membranes cellulaires des testicules, des reins, du foie et du cerveau conduisant à un dysfonctionnement total ou partiel des organes touchés. Ainsi, des sucres et des amino-acides franchissent la barrière rénale tandis que l'excrétion de l'acide urique est fortement diminuée [12]. Le plomb bloque aussi le fonctionnement des enzymes à zinc, telles que la phosphatase acide, l'ATPase, l'anhydrase carbonique ou l'acétylcholine estérase [18]. Il possède également une action inhibitrice sur la synthèse de l'hémoglobine provoquant une forme d'anémie et une augmentation du taux sanguin de l'acide 5-aminolévulinique qui est un agent neuropathogène. Ainsi, la substitution du zinc par le plomb au niveau des quatre sites actifs du type B, constitués de résidus cystéines (figure 1), de l'acide δ-aminolévulinique déshydratase (ALAD) altère son activité biologique en empêchant la formation de porphobilinogène (voir figure 1), un intermédiaire clé de la biosynthèse de l'hème, le centre de fixation du dioxygène de l'hémoglobine [18,19]. Bien que les ions Zn2+ normalement liés aux sites B de cette métalloenzyme ne semblent pas essentiels à l'activité catalytique, leur remplacement par le plomb bloque le fonctionnement de l'ALAD soit pour des raisons d'ordre stérique (obstruction du site), soit en raison de l'inaptitude des cations Pb2+ à jouer le rôle d'acide de Lewis c'est-à-dire d'accepteur d'électrons.
Mécanismes biologiques de défense contre les surcharges en plomb
Contrairement à d'autres métaux tels que le fer, le cuivre ou le zinc indispensables au bon fonctionnement du corps humain, le plomb n'intervient dans aucun processus physiologique de notre organisme. En l'absence de rôle biologique, aucun récepteur naturel spécifique du plomb n'a été identifié à ce jour.
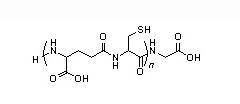
Les organismes vivants ont toutefois développé des mécanismes de défense contre la contamination par les métaux toxiques qui sont essentiellement passifs et non spécifiques. Ainsi, les végétaux sécrètent des phytochélatines, polypeptides de faible masse moléculaire dont la structure primaire est constituée d'un enchaînement de résidus gamma-glutamate, cystéine et glycine (figure 3), bien que d'autres amino-acides aient été identifiés à la place de la glycine [20].
Cependant, le rôle exact de ces phytochélatines dans les mécanismes d'hyperaccumulation du plomb par certaines plantes telles que la légumineuse Sesbania drummondii (60 g de Pb par kg de matière sèche racinaire) ou celles du genre Thlaspi, Pelargonium, Agrostis, Phaseolus... croissant sur des sols pollués, n'est pas certain [21]. L'hyperaccumulation se traduit par des dépôts de granules riches en pyromorphite (Pb5(PO4)3Cl) au niveau de la membrane cytoplasmique et des vacuoles.
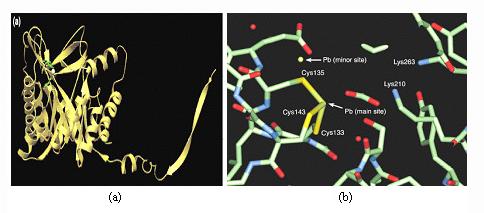
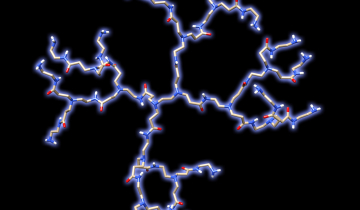
Dans le règne animal, la réponse aux surcharges repose sur la biosynthèse de métallothionéines, polypeptides de faible masse moléculaire (~ 6 000 Da ou g.mol-1) constitués d'une soixantaine d'amino-acides, riches en résidus soufrés cystéine qui favorisent l'élimination des métaux toxiques [5,20]. Les informations structurales obtenues par diffraction des rayons X [22] et par des études de spectroscopie par résonance magnétique nucléaire (RMN) [20,23] pour des métallothionéines de type I rencontrées chez les mammifères, indiquent que seuls les atomes de soufre des résidus cystéine entrent dans le schéma de coordination tétraédrique des sept cations métalliques divalents incorporés (figure 4). Ces peptides peuvent se lier à plusieurs ions pontés entre eux par les atomes de soufre formant ainsi deux agrégats métalliques distincts inaccessibles aux molécules de solvants [20].
Seuls les atomes de soufre des résidus cystéine sont représentés (sphères oranges). Les cinq cations Cd2+ et les deux cations Zn2+ tétracoordinés par les groupements thiolate des cystéines sont respectivement représentés par des sphères magentas et bleues. La vue complète a été générée directement à partir des coordonnées atomiques déposées à la Protein Data Bank de Brookhaven.
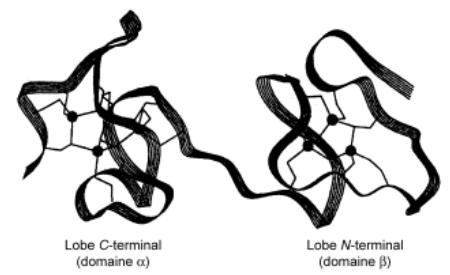
La chaîne peptidique s'enroule deux fois de manière hélicoïdale autour des deux sites métalliques définissant ainsi un lobe N-terminal (domaine alpha) et C-terminal (domaine béta) dont le diamètre est compris entre 15 et 20 Å. Les deux domaines sont reliés entre eux par un enchaînement flexible de deux résidus lysine centraux (figure 5).
Le saturnisme
L'intoxication aiguë par le plomb, appelée saturnisme, est une maladie à déclaration obligatoire dont le dépistage repose sur la recherche de la plombémie (taux de plomb dans le sang). Il a été établi par les experts qu'à partir d'une concentration de plus de 100 µg.L-1 de plomb dans le sang, l'effet toxique était certain. Les individus en bas âges représentent une population particulièrement exposée pour des raisons physiologiques mais aussi comportementales (exploration orale de l'environnement). L'INSERM a évalué à 250 000 le nombre d'enfants exposés en France. Cet organisme estime que cette pathologie touche près de 85 000 enfants de 1 à 6 ans dans le pays. En 2001, 423 cas de saturnisme chez des enfants mineurs ont été signalés aux DDASS avec plus de 70 % des cas recensés en Ile de France, région dans laquelle se trouve une proportion élevée d'habitat ancien dégradé. Les huit départements les plus touchés (Paris : 150 cas, Seine Saint-Denis : 120 cas, Val de Marne : 28 cas, Pas de Calais : 27 cas, Rhône : 17 cas, Nord : 15 cas, Essonne : 10 cas, Hauts de Seine : 10 cas) sont très urbanisés et concentrent le quart du parc de logements anciens. En revanche, 70 départements n'ont eu connaissance d'aucun cas de saturnisme infantile en 2001.
La loi n° 98-687 du 29 juillet 1998 de prévention et de lutte contre les exclusions a introduit deux types de mesures visant à lutter contre les sources de contamination par le plomb des peintures dans l'habitat dégradé en engageant des procédures de diagnostic et d'élimination de ces sources :
-
Lorsqu'un cas de saturnisme est signalé chez une personne mineure, il y a obligation de déclaration au médecin inspecteur de santé publique de la DDASS ou au médecin de PMI dans le cadre d'une convention entre l'Etat et le Conseil Général. Le Préfet fait alors procéder à un diagnostic de l'habitat afin d'évaluer le risque et de déterminer les travaux à réaliser. Il procède de même lorsqu'un risque d'accessibilité au plomb pour les occupants lui est signalé. En cas d'urgence, il est recommandé de reloger la famille au minimum pendant la durée des travaux afin d'éviter l'exposition aux poussières de plomb.
-
Un état des risques d'accessibilité au plomb doit être annexé à tout contrat ou promesse de vente pour tout immeuble affecté en tout ou partie à l'habitation construit avant 1948 et situé dans une zone à risque d'exposition au plomb délimitée par arrêté préfectoral. A ce jour, 36 départements sont concernés par un tel arrêté.
Afin de renforcer la lutte contre le saturnisme, le Ministère de la santé a engagé les mesures suivantes :
-
Sensibilisation des médecins.
-
Information des parents.
-
Gratuité du dépistage.
-
Prise en charge par les caisses d'Assurance Maladie à 100 % des intoxications saturnines.
-
Système national de surveillance du saturnisme infantile.
-
Mise en place d'un Comité Technique Plomb.
Traitement thérapeutique des intoxications par chélation du plomb
L'identification suivie de l'éradication des sources de contamination (amélioration de l'hygiène, grattage des peintures vétustes au plomb, suppression des erreurs diététiques) est primordiale afin de prévenir l'aggravation de l'intoxication ou des rechutes. Le protocole thérapeutique (nature et posologie de l'antidote, durée du traitement) et l'urgence de sa mise en place sont déterminés en fonction de la plombémie constatée et de l'âge du patient.
Le traitement du saturnisme repose essentiellement sur l'administration d'agents chélatants, molécules destinées à fixer le plomb in-vivo, à le mobiliser puis à faciliter son élimination de l'organisme [24]. Il est toujours associé à une hyperhydratation et peut dans certains cas être accompagné de mesures symptomatiques telles que la correction d'éventuelles carences phospho-calciques et martiales (déficience en fer). L'existence d'un stock osseux important de plomb dû à une ingestion chronique, représente une source permanente d'intoxication endogène compte tenu de la durée de demi-vie de 10 à 20 ans (durée nécessaire pour éliminer la moitié de la quantité initiale). Par ailleurs, le bénéfice à moyen et long terme de traitements par chélation répétés, notamment sur l'amélioration des capacités intellectuelles, n'est actuellement pas encore établi.
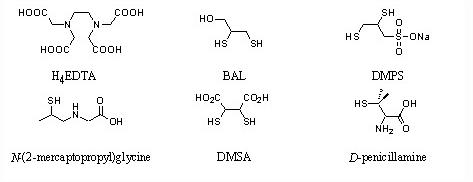
Paradoxalement, la pharmacopée ne dispose pas d'antidote spécifique au plomb et ce en dépit d'une riche chimie de coordination de cet élément [25]. Quelques exemples de substances médicamenteuses testées chez l'animal et l'homme dans le but d'éliminer le plomb immobilisé in-vivo sont représentés figure 5. Il s'agit d'agents chélatants dérivés de l'acide éthylènediaminetétraacétique (H4EDTA) ou d'antidotes qui incorporent des groupements thiol tels que le 2,3-dimercapto-1-propanol (BAL), le 2,3-dimercapto-1-propanesulfonate de sodium (DMPS), la N-(2-mercaptopropyl)glycine, l'acide méso-2,3-dimercaptosuccinique (DMSA) ou la D-pénicillamine.
Par souci de clarté, les ions sodium et les molécules d'eau ne sont par représentés. La vue a été générée directement à partir des coordonnées atomiques déposées sous le n° CCDC-141288 au Cambridge Crystallographic Data Centre.
Les complexes calcique et zincique de l'acide éthylènediaminetétraacétique (Na2[Ca(EDTA)] et Ca[Zn(EDTA)]) administrés par voie intraveineuse ou intramusculaire permettent d'éliminer efficacement le plomb de l'organisme et contribuent en particulier à résorber le plomb sanguin et osseux par excrétion via les urines. Néanmoins, le manque de sélectivité de ce ligand provoque une déplétion importante d'oligo-éléments (Cu, Zn...). De plus, la neurotoxicité de l'espèce [Pb(EDTA)]2- formée (figure 7) constitue un obstacle certain à son utilisation clinique, en particulier chez les patients présentant une forte plombémie ou des symptômes d'une encéphalopathie. En effet, la redistribution du plomb des tissus mous vers le système nerveux central a été démontrée aussi bien chez l'homme que chez l'animal [26]. Par ailleurs, l'administration par injection intramusculaire du composé Na2[Ca(EDTA)] est très douloureuse tandis que l'absorption par voie intraveineuse est susceptible de provoquer localement des effets secondaires, cette spécialité présentant une certaine néphrotoxicité.
A l'origine, la British Anti-Lewisite (BAL) ou Dimercaprol a été mise au point comme antidote d'un gaz de combat vésicant à base d'arsenic, la Lewisite. Cette molécule favorise l'élimination des espèces à base d'arsenic(III) et plus généralement des métaux lourds fixés par les enzymes riches en résidus soufrés. Cette molécule est administrée exclusivement par voie intramusculaire et mobilise préférentiellement le plomb contenu dans les tissus mous par formation d'un complexe apolaire de stoechiométrie 2:1 éliminé par voie urinaire et biliaire. Son utilisation est préconisée dans le traitement des formes de saturnisme les plus sévères, notamment en cas d'atteinte neurologique et généralement en association avec le Na2[Ca(EDTA)], mais les effets secondaires sont nombreux (augmentation du taux d'histamine, fièvre) et fréquents puisque 50 % des patients traités en souffrent. Pour ces raisons, sa prescription est de plus en plus limitée.
Dans les intoxications infantiles aiguës caractérisées par une plombémie supérieure à 700 µg.L-1, le traitement chélateur est une urgence thérapeutique et le bénéfice clinique est avéré. Le protocole classique associe la BAL (300 mg.m-2.j-1) administrée à la dose de 50 mg.m-2, par voie intra-musculaire, toutes les 4 h et le Na2[Ca(EDTA)] (1 000 mg.m-2.j-1) perfusé en continu dans du soluté glucosé à 5 %, à partir de la 4ème heure. La durée du traitement est de 5 j.
Les enfants dont la plombémie est comprise entre 450 et 699 µg.L-1 sont classiquement soignés par 1 000 mg.m-2.j-1 de Na2[Ca(EDTA)], en perfusion continue ou en deux perfusions d'une heure par jour au moins, dans du soluté glucosé à 5 %. L'injection intra-musculaire est également possible, mais elle est douloureuse. L'acide dimercaptosuccinique (DMSA), peut être substitué à Na2[Ca(EDTA)]. Il s'administre à la dose de 30 mg.m-2.j-1, en 3 prises quotidiennes par cures de 5 j.
Les enfants dont la plombémie est comprise entre 250 et 449 µg.L-1 sont traités comme ceux du groupe précédent, si leur épreuve de plomburie (taux de plomb dans l'urine) provoquée est positive ; les autres n'ont pas besoin d'un traitement chélateur, son efficacité étant dans ce cas très limitée.
La D-pénicillamine a été initialement utilisée pour traiter des patients atteints de la maladie de Wilson, trouble caractérisé par des surcharges en cuivre. Elle est le seul chélateur efficace par voie orale et offre ainsi une alternative intéressante au traitement du saturnisme. Chez l'enfant, l'utilisation de ce médicament est recommandée dans les cas asymptomatiques et lorsque la plombémie se situe entre 500 et 800 µg.L-1. La posologie est de 30 à 40 mg.kg-1.j-1 chez l'enfant et de 900 à 1 500 mg.j-1 chez l'adulte pour une durée du traitement comprise entre 4 et 12 semaines. Le plomb osseux semble être mobilisé plus efficacement que le plomb contenu dans les tissus mous. Des études conduites sur des animaux ont mis en évidence une redistribution du métal vers les organes mous après un traitement à la pénicillamine. Sa toxicité se manifeste par des nausées et des vomissements, et provoque des leucopénies (diminution du nombre de globules blancs dans le sang) et des thrombopénies (diminution du nombre de plaquettes) chez 5 % des patients traités [26].
Plus récemment, d'autres séquestrants soufrés du plomb ont été proposés tels que des dérivés thiohydroxamate [28] ou hydroxypyridinethione [29] mais aucun n'a été soumis à des tests cliniques.
[1] P. Grandjean, Lead (Editeurs : T. B. Friffin, J. H. Knelson, F. Coulston, F. Korte), Academic Press, New York, 1975, p. 6.
[2] L. E. Wittmers, A. Aufderheide, G. Rapp, A. Alich, Acc. Chem. Res. 2002, 35, 669.
[3] P. Walter, P. Martinetto, G. Tsoucaris, R. Breniaux, M. A. Lefebvre, G. Richard, J. Talabot, E. Dooryhee, Nature 1999, 397, 483.
[4] D. Mc Arthur, Techné (Paris) 1995, 2, 39.
[5] R. B. Martin, Encyclopedia of Inorganic Chemistry (Editeur : R. B. King), Wiley Interscience, Chichester, 1994, Vol. 2, p. 2195.
[6] L. R. Ember, Chem. Eng. News 2001, 79 (31), 51.
[7] V. T. Breslin, S. A. Sanudo-Wilhelmy, J. Chem. Educ. 2001, 78, 1647.
[8] J. J. Chisolm, Diagnosis and Treatment of Lead Poisoning (Editeurs : J. J. Chisolm, K. R. Mahaffey, A. L. Aronson), MSS Information, New York, 1976, p. 158.
[9] R. Vilagines, P. Leroy, Bull. Acad. Natl. Méd. 1995, 179, 1393.
[10] G. Miquel, Rapport sur la qualité de l'eau et de l'assainissement en France , Rapport de l'Office Parlementaire d'Evaluation des Choix Scientifiques et Technologiques, rapport N° 705 de l'Assemblée Nationale et N° 215 du Sénat, 2003.
[11] R. L. Boeckx, Anal. Chem. 1986, 58, 275A.
[12] M. R. Moore, B. C. Campbell, A. Goldberg, The Chemical Environment (Editeurs : J. Lenihan, W. W. Fletcher), Academic Press, New York, 1977, Vol. 6, p. 64.
[13] H. A. Godwin, Curr. Opin. Chem. Biol. 2001, 5, 223.
[14] R. G. Pearson, J. Am. Chem. Soc. 1963, 85, 3533.
[15] R. G. Pearson, Inorg. Chem. 1988, 27, 734.
[16] H. Sigel, C. P. Da Costa, R. B. Martin, Coord. Chem. Rev. 2001, 219-221, 435.
[17] J. C. Payne, M. A. Horst, H. A. Godwin, J. Am. Chem. Soc. 1999, 121, 6850.
[18] N. N. Grennwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, Oxford, 1984.
[19] M. J. Warren, J. B. Cooper, S. P. Wood, P. M. Shoolingin-Jordan, Trends Biochem. Sci. 1998, 23, 217.
[20] M. Vasak, J. H. R. Kagi, Encyclopedia of Inorganic Chemistry (Editeur : R. B. King), Wiley Interscience, Chichester, 1994, Vol. 2, p. 2229.
[21] S. V. Sahi, N. L. Bryant, N. C. Sharma, S. R. Shree R. Singh, Environ. Sci. Technol. 2002, 36, 4676.
[22] A. H. Robbins, D. E. McRee, M. Williamson, S. A. Collett, N. H. Xuong, W. F. Furey, B. C. Wang, C. D. Stout, J. Mol. Biol. 1991, 221, 1269.
[23] W. Braun, M. Vasak, A. H. Robbins, C. D. Stout, G. Wagner, J. H. R. Kagi, K. Wuthrich, Proc. Natl. Acad. Sci. U.S.A. 1992, 89, 10124.
[24] O. Andersen, Chem. Rev. 1999, 99, 2683.
[25] A. E. Martell, R. D. Hancock, Metal Complexes in Aqueous Solutions, Modern Inorganic Chemistry, Plenum Press, New York, 1996.
[26] C. M. Berlin, R. L. Gorman, D. G. May, D. A. Notterman, D. N. Weismann, G. S. Wilson, J. T. Wilson, Pediatrics 1995, 96, 155.
[27] A. B. Ilyukhin, V. B. Logvinova, R. L. Davidovich, Zh. Neorg. Khim. 1999, 44, 1654.
[28] S. Rupprecht, K. Langemann, T. Lugger, J. M. McCormick, K. N. Raymond, Inorg. Chim. Acta 1996, 243, 79.
[29] K. Abu-Dari, T. B. Karpishin, K. N. Raymond, Inorg. Chem. 1993, 32, 3052.
Au cours du colloque "Pharmacie et archéologie" tenu le 22 mai à la faculté de Pharmacie de Châtenay-Malabry, trois communications ont été présentées ayant pour titre :
-
" Les formulations cosmétiques à base de plomb de l'Egypte ancienne ",
-
" Production de céruse et gestion de sa toxicité en France au XIXème siècle ",
-
" Plomb dans l'environnement et ses effets sur la santé ".
Les actes de cette journée ont été publiés par le CNRS dans le numéro 79 (mars 2003) des Lettres du Département des Sciences Chimiques.
L'Office Parlementaire d'Évaluation des Choix Scientifiques et Technologiques a publié un rapport sur le sujet consultable en ligne à l'adresse suivante : G. Miquel, "Effets des métaux lourds sur l'environnement et la santé" (365 p.), rapport N° 261 du Sénat, 2001.
Un dossier sur les risques sanitaires du plomb est consultable sur le site internet du Ministère de la Santé (nombreux liens vers d'autres sites qui traitent du sujet).
Santé Publique France fournit de nombreux articles sur le saturnisme infantile.