Les dendrimères, aussi appelés arbres moléculaires à cause de leur structure qui ressemble à la ramure des arbres, sont des macromolécules hyper-ramifiées tri-dimensionnelles. N'existant pas dans la nature, elles proviennent uniquement de la synthèse. Cet article présente les voies de synthèse de quelques dendrimères et leurs applications en médecine, notamment en nanomédecine (puces de diagnostic).
Introduction
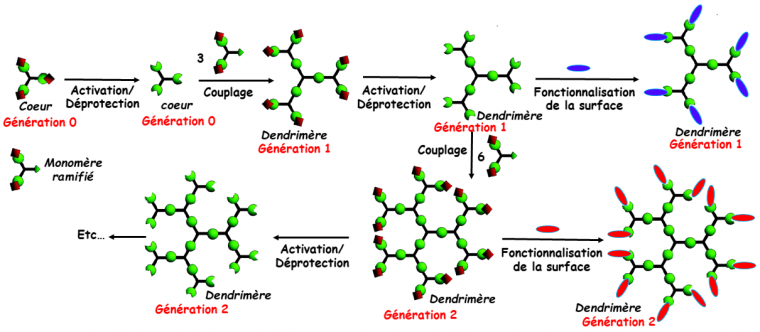
Les dendrimères, aussi appelés arbres moléculaires à cause de leur structure qui ressemble à la ramure des arbres, sont des macromolécules hyper-ramifiées tri-dimensionnelles. Les dendrimères sont synthétisés par la répétition d’une séquence de réactions, qui permet à la fois de faire grandir leur structure, et de multiplier le nombre de fonctions en surface, d’une façon prédéterminée et parfaitement contrôlée. Une nouvelle génération est créée chaque fois que le nombre de fonctions terminales est multiplié, généralement par 2 ou 3. Deux étapes sont généralement nécessaires pour créer une nouvelle génération, une étape de modification/activation des fonctions terminales pour les rendre compatibles avec le greffage d’un monomère ramifié qui constitue la deuxième étape. La Figure 1 illustre le principe de synthèse des dendrimères par une méthode divergente, c’est-à-dire à partir d’un cœur central, ayant lui-même plusieurs fonctions. Il existe aussi une méthode de synthèse convergente, de la périphérie vers le cœur, mais elle est beaucoup moins utilisée. À chaque étape de la synthèse, il est possible de modifier les fonctions terminales pour donner aux dendrimères les propriétés que l’on souhaite, par exemple la solubilité dans l’eau, qui facilite en particulier leur utilisation dans le domaine de la biologie.
Il existe de nombreux types de dendrimères et différentes méthodes de synthèse, qui supposent toutes la propriété d’être quantitatives à chaque étape. En effet, lorsque le nombre de générations augmente, et donc aussi le nombre de fonctions terminales, une réaction qui ne serait pas quantitative entrainerait des défauts de structure, impossibles à éliminer. Les premiers dendrimères ont été synthétisés il y a une quarantaine d’années, et font l’objet de recherches dans divers domaines, tels que la catalyse, les (nano)matériaux, et la biologie / nanomédecine [1]. Nous examinons dans les paragraphes suivants les propriétés biologiques les plus avancées de quelques types de dendrimères, y compris tous les exemples d’utilisation actuelle en santé humaine.
Les dendrimères PAMAM
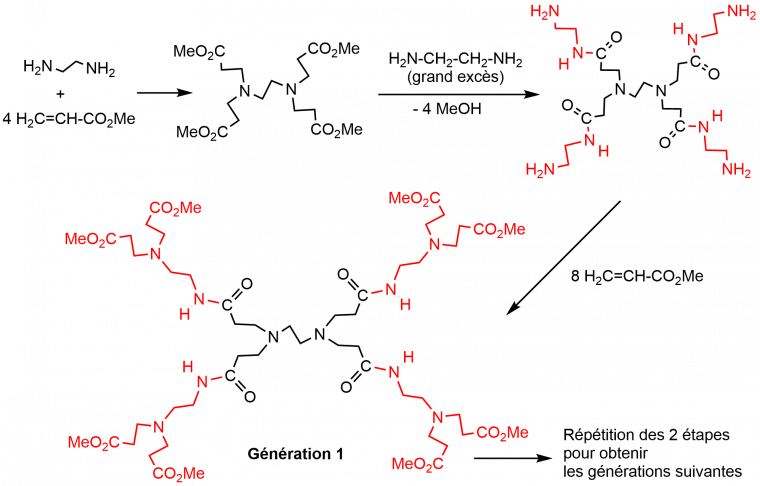
Les dendrimères de type PolyAMidoAMine (PAMAM) ont été synthétisés aux USA dans les années 80 par Donald A. Tomalia [2], qui a aussi créé le mot « dendrimère » à partir du grec « dendros » (arbre) et « meros » (partie). Ces dendrimères sont généralement synthétisés à partir d’un cœur éthylène diamine, sur lequel sont greffés 4 équivalents d’acrylate de méthyle, la deuxième étape étant une réaction avec un excès d’éthylène diamine, qui donne des amines primaires en surface à partir desquelles le processus réactionnel est répété (Figure 2).
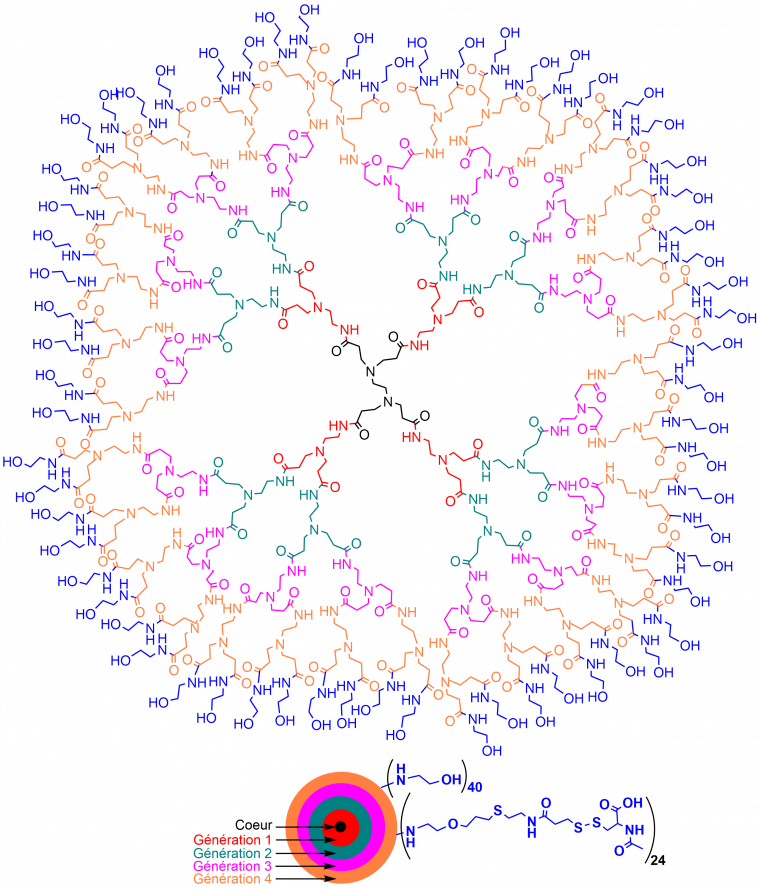
Ces dendrimères ont été synthétisés jusqu’à la dixième génération. La 4ème génération d’un dendrimère PAMAM, fonctionnalisé en surface par des groupement hydroxy, est illustrée sur la Figure 3. Ces dendrimères PAMAM ont été les premiers commercialisés (ils le sont toujours), ils sont les plus connus et les plus utilisés en recherche. Cependant, du fait de la difficulté à les obtenir avec une pureté suffisante, et de leur relative fragilité chimique, très peu d’essais cliniques ont été effectués avec les dendrimères PAMAM. Malgré ces problèmes, quelques essais cliniques dans les domaines de l’ophtalmologie, la neurologie, les maladies inflammatoires (y compris les effets du Covid-19), et l’oncologie ont été menés ou sont en cours avec des dendrimères PAMAM. Ces dendrimères PAMAM sont fonctionnalisés par des groupements hydroxy et aléatoirement par diverses autres fonctions en surface. Un exemple, schématisé dans la Figure 3, a été utilisé comme anti-inflammatoire sur des patients hospitalisés, souffrant d’une forme sévère de la Covid-19, chez lesquels il a permis une diminution forte de la morbidité1 et surtout de la mortalité [3].
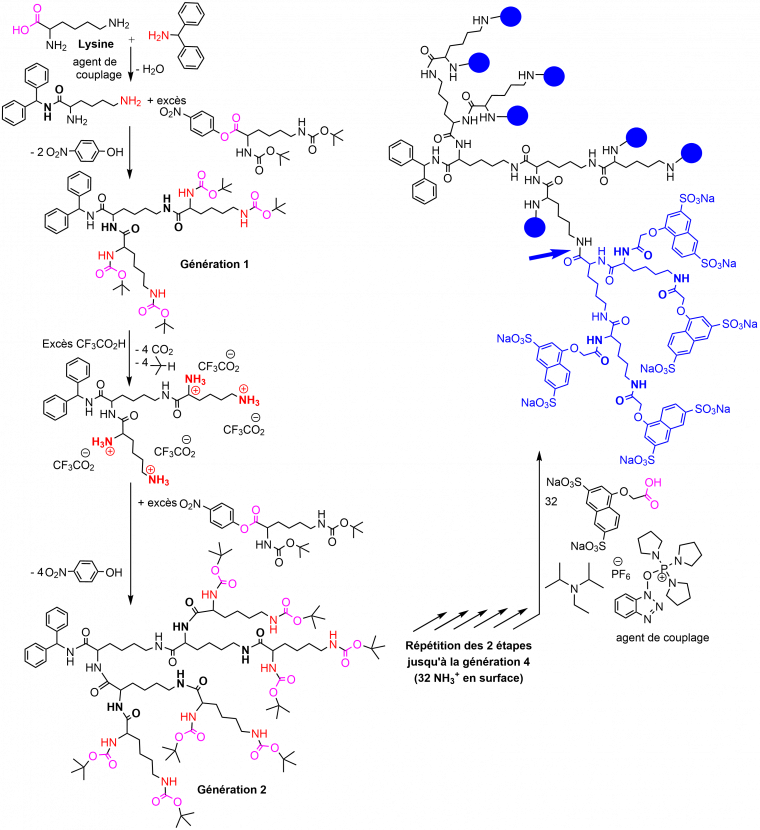
Les dendrimères poly(L-Lysine)
Les dendrimères poly(L-Lysine) ont été les premiers brevetés [4]. Ils sont généralement synthétisés à partir d’un cœur benzhydrylamine, par la répétition d’une séquence de protection/déprotection du N,N’-bis(tert-butoxycarbonyl)-L-lysine nitrophénylester, comme illustré dans la Figure 4. Comme les PAMAM, ces dendrimères ont aussi été synthétisés jusqu’à la dixième génération. Du fait de leur constitution à base d’aminoacides, qui permettait de penser qu’ils seraient bien tolérés, ces dendrimères ont été très tôt utilisés dans de nombreux essais de phases cliniques. La génération 4, fonctionnalisée en surface par 32 groupes 1-(carboxyméthoxy)-naphthalène-3,6-disulfonate sel de sodium (Figure 4), est commercialisée sous forme de gel pour le traitement de la vaginose bactérienne, sous le nom de VivaGel®. Ce gel est également utilisé comme lubrifiant de certains préservatifs. Les premières phases cliniques avec ce gel, il y a une vingtaine d’années, avaient aussi concerné les virus, en particulier le VIH, mais ils ont été abandonnés pour cette utilisation, par manque d’efficacité. Ce même dendrimère a été récemment reformulé sous forme de spray nasal pour prévenir les infections contre la Covid-19, sous le nom de VIRALEZETM [3].
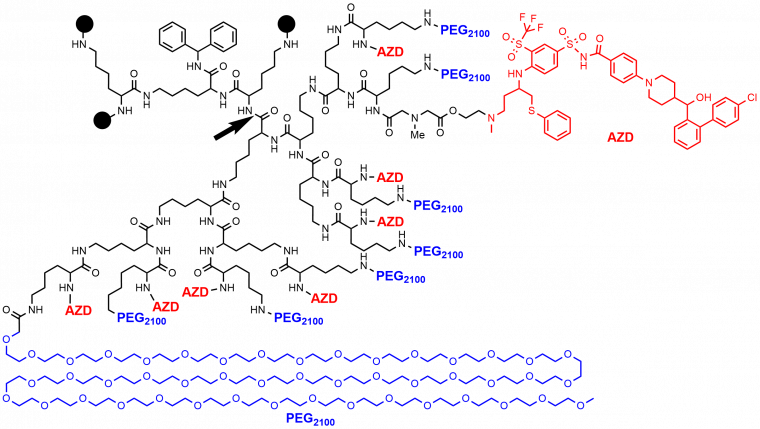
Des dendrimères poly(L-Lysine) de génération 5 ayant deux types de fonctions différentes en surface, en particulier celui appelé AZD0466 (Figure 5), ont fait récemment (2019-2022) l’objet d’essais cliniques de phases 1 et 2, dans le domaine de l’oncologie (tumeurs solides dans un état avancé, lymphomes, myélome multiple, cancers hématologiques, lymphomes non-Hodgkiniens) [3].
Les dendrimères poly(phosphorhydrazone)
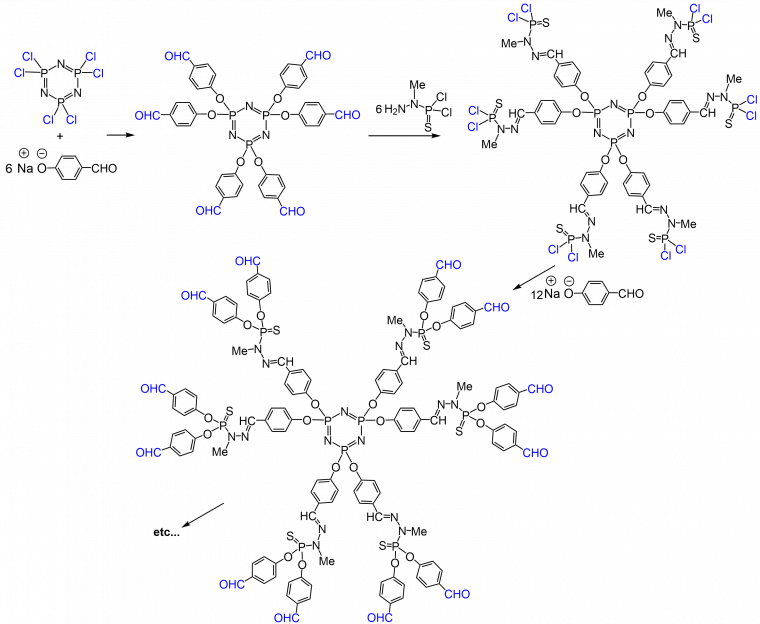
À la différence des dendrimères PAMAM et Poly-L-Lysine, qui ont une structure interne hydrophile, les dendrimères poly(phosphorhydrazone) (PPH) ont une structure interne hydrophobe, constituée en particulier de cycles aromatiques. Ils sont construits à partir d’un cœur trifonctionnel (S=PCl3) [5] ou hexafonctionnel (N3P3Cl6) sur lequel est greffé le 4-hydroxybenzaldéhyde en milieu basique. La deuxième étape est une réaction de condensation des aldéhydes avec le phosphorhydrazide H2NNMeP(S)Cl2 (Figure 6). Cette méthode de synthèse est très modulable et a permis d’obtenir des architectures dendritiques très sophistiquées [6]. Ces dendrimères ont été synthétisés jusqu’à la douzième génération à partir du cœur trifonctionnel, et jusqu’à la huitième génération à partir du cœur hexafonctionnel. Ces dendrimères étant hydrophobes, il est nécessaire de greffer des groupements hydrophiles en surface, tels que des groupements ammoniums ou phosphonates pour les rendre solubles dans l’eau, et donc utilisables en milieu biologique.
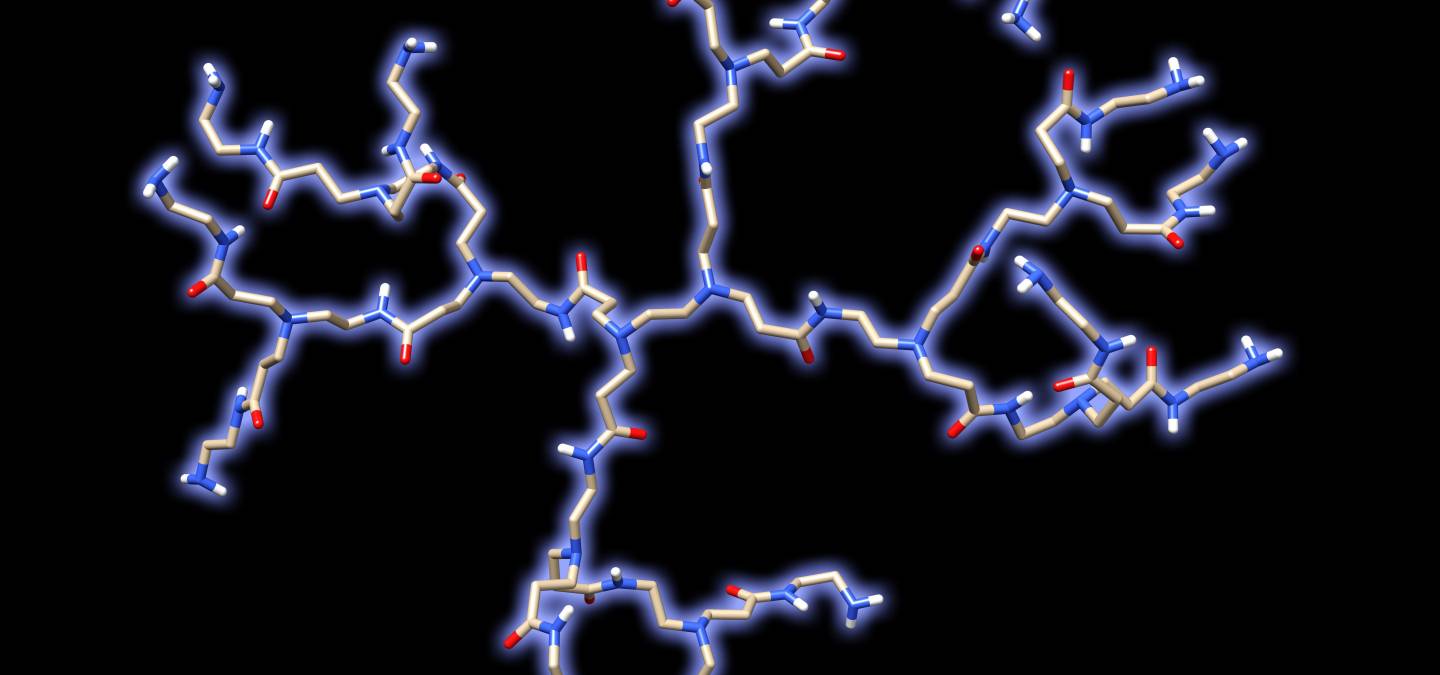
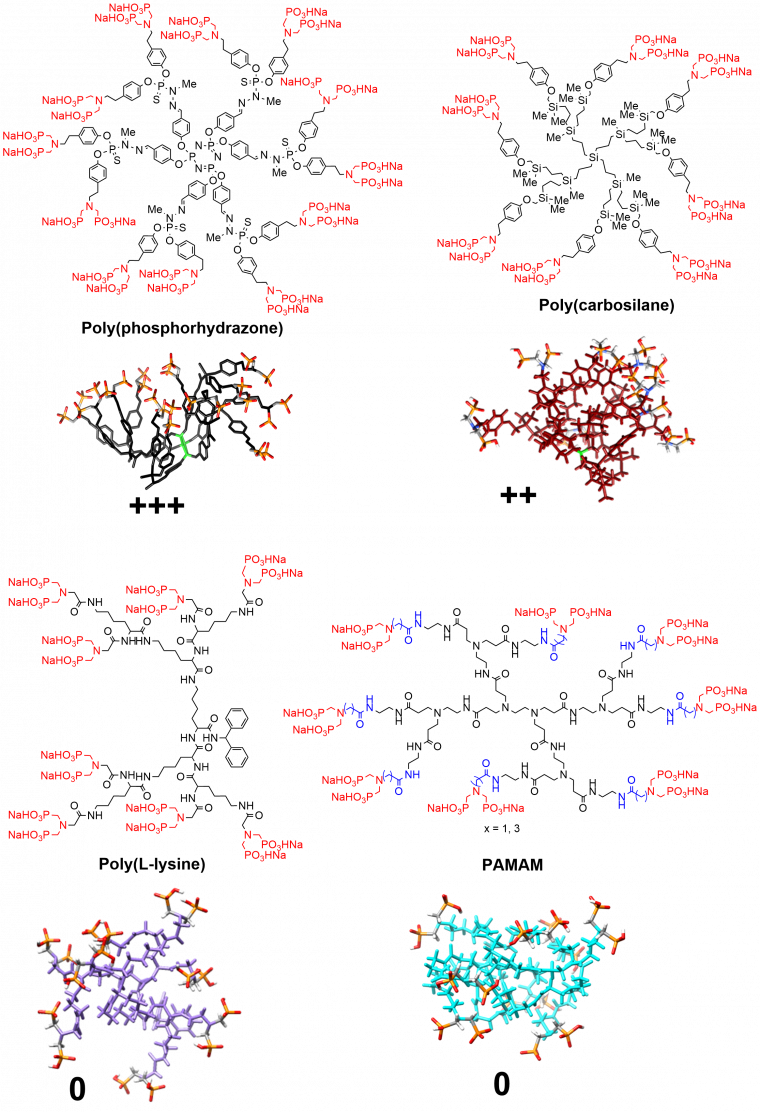
L’utilisation biologique la plus avancée avec les dendrimères poly(phosphorhydrazone) permet de rééquilibrer le système immunitaire humain (les globules blancs), grâce un dendrimère de 1ère génération ayant 12 groupements azabisphosphonates en surface. Lors de l’étude de structure / activité effectuée après cette découverte, une série de dendrimères, ayant des intérieurs différents mais les mêmes fonctions de surface, a été synthétisée. Contrairement à un consensus qui considérait que l’intérieur des dendrimères servait seulement de support aux fonctions terminales, qui seules avaient une activité, ces travaux ont montré que la structure interne des dendrimères pouvait avoir une influence cruciale sur les propriétés, en particulier dans le domaine biologique. La Figure 7 montre certains des dendrimères qui ont été synthétisés pour cette étude, leur efficacité sur l’activation anti-inflammatoire des monocytes (un type de globules blancs), et leur structure tridimensionnelle dans l’eau, obtenue par modélisation en dynamique moléculaire. Cette modélisation s’est avérée cruciale pour comprendre les différences d’activité observées. En effet, seuls les dendrimères ayant toutes leurs fonctions terminales rassemblées d’un côté de la molécule (cas des dendrimères à structure interne hydrophobe, comme poly(phosphorhydrazone) et poly(carbosilane)) sont actifs. Par contre, les dendrimères ayant les fonctions terminales réparties sur toute la surface (cas des dendrimères à structure interne hydrophile, comme poly(Lysine) et PAMAM) ne sont pas actifs. La start-up IMD-Pharma a été créée pour amener dans les années prochaines le dendrimère le plus actif dans un essai clinique de phase 1 [8].
Les dendrimères pour augmenter l’efficacité des outils de diagnostic
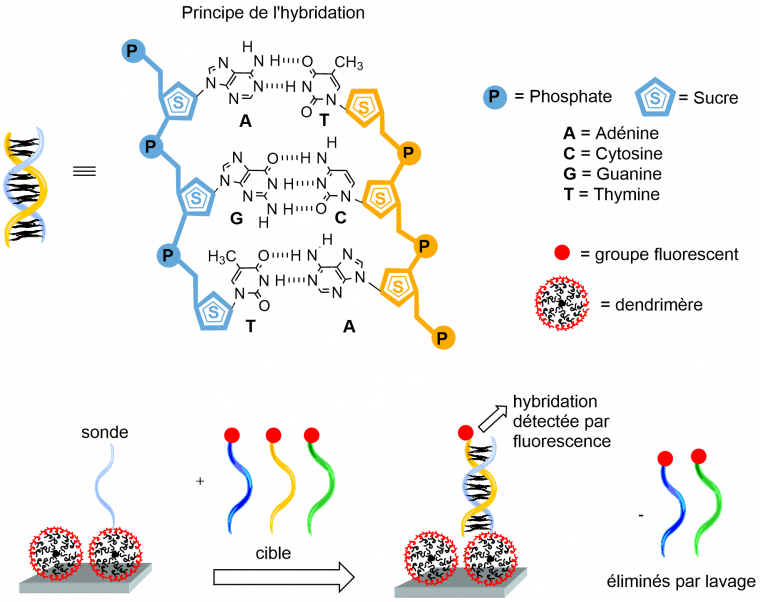
Des dendrimères sont utilisés comme espaceurs tridimensionnels sur des puces de diagnostic (puces à ADN). Le processus est basé sur la capacité d’association de deux brins d’ADN complémentaires, qui s’appelle l’hybridation. L’un des deux brins est synthétisé : sa structure est parfaitement connue, et il est greffé sur la puce. L’autre brin est naturel et prélevé chez le patient ; il est légèrement modifié par le greffage d’un groupement fluorescent. L’association des deux brins d’ADN ne peut se faire que si le brin naturel est complémentaire au brin synthétique, et leur hybridation est détectée par fluorescence. Les dendrimères augmentent la distance entre la surface solide de la puce et le brin synthétique (appelé « sonde »), permettant d’accroître l’efficacité du piégeage du brin naturel (appelé « cible ») par hybridation. Ce processus d’hybridation devient alors aussi efficace qu’en solution, ce qui n’est pas le cas en l’absence de dendrimère. Ce concept, illustré sur la Figure 8, a été appliqué très tôt avec des dendrimères PAMAM. Il est notamment utilisé dans l’analyseur Stratus®CS*, qui fournit des tests cardiaques quantitatifs, pour une évaluation rapide et précise des patients présentant une suspicion d’ischémie myocardique1 dans les services d’urgence [9]. Différents types de puces, selon la maladie à détecter, ont aussi été élaborés par la start-up Dendris [10] avec des dendrimères phosphorés. « DendrisKIT RD » concerne la détection simultanée de 10 bactéries couramment impliquées dans les infections respiratoires (pneumonies) et est actuellement utilisée dans les services pneumologiques d’une quinzaine d’hôpitaux français. « DendrisKIT OA » permet la détection de 22 bactéries responsables d’infections ostéoarticulaires2. « DendrisKIT DP » est dédié à l’identification de 12 champignons impliqués dans la dermatophytose3, tandis que « DendrisKIT ST » est dédié à l’identification de 10 pathogènes (bactéries, levures, et virus) responsables d’infections sexuellement transmissibles [10]. Des puces à façon peuvent aussi être produites, en modifiant le design des sondes (l’ADN synthétique).
En bleu clair est représenté le brin d’ADN synthétique. En bleu foncé, jaune-orangé et vert sont représentés des brins d’ADN naturel rendus fluorescents grâce à un groupement représenté en rouge. Seul le brin jaune-orangé est complémentaire du brin bleu clair : les deux s’associent selon le processus d’hybridation, dont la détection se fait par fluorescence.
Conclusion
Les dendrimères ont une structure moléculaire très originale dont il n’existe aucun exemple parmi les molécules naturelles. C’est peut-être la raison pour laquelle il a fallu beaucoup de temps pour que les dendrimères soient utilisés dans le domaine de la santé humaine. On peut espérer que ces premiers exemples de dendrimères auront ouvert le chemin vers de nouvelles utilisations médicales de ceux-ci.
Références
[1] Dendrimers. Towards Catalytic, Material, and Biomedical Uses. Caminade A.M., Turrin C.O., Laurent R., Ouali A., Delavaux-Nicot B. Eds, Wiley, 2011.
[2] Tomalia D.A., Baker H., Dewald J., Hall M., Kallos G., Martin S., Roeck J., Ryder J., Smith P., A new class of polymers—Starburst-dendritic macromolecules. Polym. J. 1985, 17, 117–132.
[3] Pour une mise au point récente sur les essais cliniques avec des dendrimères : Caminade A.M., Dendrimers, an Emerging Opportunity in Personalized Medicine? J. Person. Med., 2022, 12, 1334.
[4] Denkewalter R.G., Kolc J., Lukasavage W.J. Macromolecular Highly Branched Homogeneous Compound Based on Lysine Units. US Patent 4,289,872, 15 September 1981.
[5] Launay N., Caminade A.M., Lahana R., Majoral J.P. A general synthetic strategy for neutral phosphorus containing dendrimers. Angew. Chem. Int. Ed. Engl. 1994, 33, 1589-1592.
[6] Galliot C., Larré C., Caminade A.M., Majoral J.P. Regioselective stepwise growth of dendrimer units in the internal voids of a main dendrimer. Science 1997, 277, 1981-1984.
[7] Caminade A.M., Fruchon S., Turrin C.O., Poupot M., Ouali A., Maraval A., Garzoni M., Maly M., Furer V., Kovalenko V., Majoral J.P., Pavan G.M., Poupot R. The key role of the scaffold on the efficiency of dendrimer nanodrugs. Nature Comm. 2015, 6, 7722.
[8] IMD-Pharma. Disponible en ligne
[9] Siemens-Healthineers. Disponible en ligne
[10] Majoral J.P., Francois J.M., Fabre R., Senescau A., Mignani S., Caminade A.M. Multiplexing technology for in vitro diagnosis of pathogens: The key contribution of phosphorus dendrimers. Sci. China-Mater. 2018, 61, 1454–1461.