Pour comprendre les mécanismes responsables du climat terrestre et de ses variations il faut examiner attentivement ce que devient l’énergie rayonnée par le soleil à son arrivée sur la terre, c’est à dire faire un « bilan radiatif ». La terre reçoit quotidiennement du soleil une énergie d’environ 1,5.10²² J. À titre de comparaison, cette quantité suffirait à assurer les besoins énergétiques de l’humanité pour environ 70 ans à notre rythme de consommation actuel
En parvenant à la terre ce rayonnement rencontre en premier lieu l’atmosphère. Il subit différentes interactions avec ses constituants dont la diffusion et la réflexion qui sont détaillées dans l’article « Le rayonnement thermique, bilan radiatif et effet de serre » en ligne sur le site Planet-Terre [1]. Dans le présent article, nous examinons un troisième type d’interaction : l’absorption du rayonnement solaire par les constituants de l’atmosphère. Après avoir rappelé la structure de l’atmosphère et les caractéristiques du spectre solaire, nous détaillerons le rôle de l’ozone dans le phénomène d’absorption des rayons ultraviolets et l’influence de cette absorption sur la température de l’atmosphère.
Qu’est-ce que l’atmosphère ?
Constituants
L’atmosphère est l’enveloppe gazeuse qui entoure la terre. Ses constituants principaux sont le diazote N2 (78 %[1]) et le dioxygène O2 (21 %). On y trouve également de l’argon (0,9 %) et de nombreux gaz dits « gaz mineurs » pour moins de 0,1 % (CO2, hélium, néon, méthane, dihydrogène, ozone…) Elle contient également de l’eau sous tous ses états physiques : vapeur, liquide, solide (nuage, pluie, neige…)
Structure verticale
L’atmosphère terrestre présente une structure en couche dont les limites sont fixées aux changements de signe des variations de la température avec l’altitude [2]. Les couches rencontrées de bas en haut sont (figure 1) :
-
La troposphère : son épaisseur varie entre 13 et 25 km suivant les régions. Elle contient 80 à 90 % de l’air en masse et la quasi-totalité de la vapeur d’eau. C’est le siège de la plupart des phénomènes météorologiques. La température y décroît d’environ 6°/km jusqu’à - 60 °C environ. Sa frontière est la tropopause.
-
La stratosphère : elle s’étend jusqu’à 50 km d’altitude. On y trouve la plus grande partie de l’ozone atmosphérique. La température y est d’abord constante autour de - 60 ° puis remonte jusqu’à 0 °C environ. Sa frontière est la stratopause.
-
La mésosphère jusqu’à 80 km environ. La température y décroît à nouveau jusqu’à - 90 °C. Sa frontière est la mésopause.
-
La thermosphère : les molécules de l’air y sont très rares, son épaisseur et sa température dépendent de l’activité solaire, elle peut s’étendre de 350 à 800 km d’altitude et la température y varie de plusieurs centaines à plusieurs milliers de degrés.
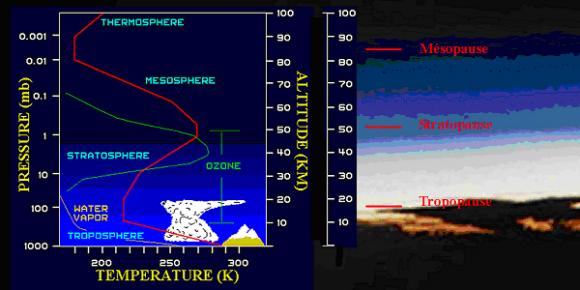
Figure 1. Profil thermique de l’atmosphère. La limite entre deux couches est fixée au changement de pente de la courbe des températures. (Image : planet-terre [2])
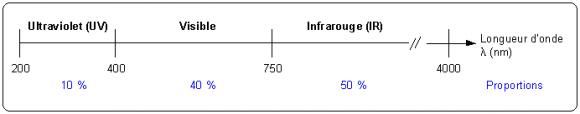
La surface du soleil est la principale source du rayonnement électromagnétique reçu par la terre[2]. Ce rayonnement est constitué d’ondes électromagnétiques dans le domaine de l’ultraviolet (UV), du visible et de l’infrarouge (IR). Les longueurs d’onde de ces différents rayonnements ainsi que la proportion de chacun d’entre eux dans la lumière solaire sont donnés à la figure 2.
L’énergie E d’un rayonnement électromagnétique est liée à sa longueur d’onde λ par la relation (1)
E = hc / λ (1)
où h est la constante de Planck (6,62.10-34 J.s) et c la vitesse de la lumière dans le vide (3.108 m.s-1). On voit que l’énergie est inversement proportionnelle à la longueur d’onde, les rayonnements les plus énergétiques sont donc ceux de plus courte longueur d’onde. Ce sont les UV, vient ensuite le rayonnement visible, du violet au rouge puis l’infrarouge.
Le rayonnement UV est potentiellement nocif pour les êtres vivants du fait de sa haute énergie . On subdivise les UV émis par le soleil en trois classes en fonction de leur activité biologique et du pouvoir de pénétration dans la peau humaine.
-
Les UV-A : 315 - 400 nm, responsables du bronzage immédiat et du vieillissement de la peau. Ils ont un effet cancérigène, longtemps ignoré, mais aujourd’hui prouvé, qui reste toutefois très inférieur à celui des UV-B.
-
Les UV-B : 315 - 280 nm, responsables du bronzage à retardement et des coups de soleil, ils favorisent également le vieillissement de la peau et l'apparition de cancers cutanés.
-
Les UV-C : 280 - 200 nm. Ce sont les UV les plus énergétiques et les plus nocifs ; ils sont toutefois totalement filtrés par l’atmosphère. Leur effet germicide est exploité pour stériliser des objets ou l’eau.
Heureusement pour les êtres vivants, le rayonnement UV arrivant dans l’atmosphère ne se retrouve pas intégralement au niveau du sol. Son interaction avec l’atmosphère est telle qu’il ne subsiste presque plus que des UV-A au niveau du sol (95 à 98 %) ainsi que des UV-B en faible proportion (2 à 5 %). Le rayonnement transmis par l’atmosphère ne contient plus d’UV-C.
Que sont devenus les UV-C ? Ils ont été, de même qu’une fraction importante des UV-B, absorbés par l’ozone présent dans la stratosphère.
L’ozone est un de ces « gaz mineurs » présents dans l’atmosphère en quantité très faible par rapport à l‘azote et à l’oxygène. Sa proportion est comprise entre 10 et 100 ppb[3] [3].
Environ 90 % de l’ozone atmosphérique est concentré dans la stratosphère (courbe en cloche verte sur la figure 1 gauche.) Les 10% restants se situent dans la troposphère.
L’ozone est perçu différemment suivant qu’il se trouve dans l’une ou l’autre de ces couches : c’est un protecteur indispensable à la vie dans la stratosphère puisqu’il absorbe les rayons UV nocifs. Dans ce cas on parle de la « couche d’ozone », même si la couche en question s’étend de manière diffuse sur une épaisseur de plusieurs dizaines de kilomètres. En revanche, il est considéré comme un polluant dans la troposphère, en particulier au niveau du sol où il est nocif aux êtres humains : il peut provoquer des irritations du nez, des yeux et de la gorge ainsi que des essoufflements, de la toux [5]...
L’ozone est une molécule de formule brute O3. Elle consiste en l’enchaînement de trois atomes d’oxygène, soit un de plus que dans le cas du dioxygène. La formule de Lewis de l’ozone est donnée à la figure 3.
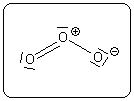
Figure 3. Formule de Lewis de l’ozone. L’oxygène doit être entouré de quatre doublets pour être neutre, il apparaît donc une séparation de charge dans la molécule, mais elle est globalement neutre.
Dans les conditions de température et de pression ambiante c’est un gaz bleu pâle possédant une odeur caractéristique à laquelle il doit son nom. C’est Christian Schonbein, chimiste suisse, qui lui a attribué ce nom en le découvrant vers 1840 ; il dérive de ozein, racine grecque de sentir. Il se forme dans l'air en présence de tensions électriques élevées (plusieurs milliers de volts), on peut sentir cette odeur après les éclairs pendant un orage ou près des photocopieurs.
Nous allons rappeler ici les bases de l’absorption du rayonnement par la matière [6]. Au niveau microscopique, ce sont les lois de la mécanique quantique qui régissent les interactions des systèmes que nous étudions ici : atomes, molécules et rayonnement électromagnétique. Ces lois stipulent que l’énergie de ces systèmes est quantifiée : elle ne peut prendre que des valeurs précises, qui dépendent de leur nature, toutes les autres valeurs sont interdites.
Supposons qu’un atome présente deux niveaux d’énergie E0 et E0 + ΔE avec ΔE > 0. On observe qu’il peut passer du niveau E0 le plus bas au niveau plus élevé E0 + ΔE lors d’un choc avec un photon incident d’énergie ΔE : c’est l’absorption (figure 4) Pour que le photon convienne, sa longueur d’onde λ doit correspondre à l’énergie ΔE, donc d’après la relation (1) : λ = hc / ΔE. L’atome est alors dans un état excité.
S’il est soumis à un rayonnement de longueur d’onde différente de λ, l’atome n’interagira pas avec les photons, on dit qu’il est transparent au reste du rayonnement.
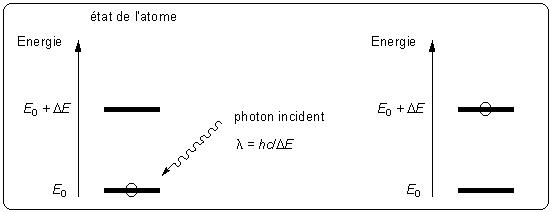
Figure 4. Absorption d’un photon.
Dans le cas des atomes, on constate que les niveaux d’énergie les plus élevés se rapprochent de plus en plus et tendent vers une limite qui correspond à l’arrachement d’un électron (figure 5). À partir d’un certain seuil appelé « énergie d’ionisation », tout photon d’énergie supérieure provoquera l’ionisation de l’atome par éjection d’un électron. On parle dans ce cas de photo-ionisation. Dans le cas des molécules il existe une autre possibilité : la dissociation. Si l’énergie du photon incident est supérieure ou égale à l’énergie des liaisons au sein de la molécule, alors on peut observer la rupture d’une liaison, c’est la photodissociation. Cette réaction est dite « photochimique » parce qu’elle est engendrée par les photons qui véhiculent le rayonnement électromagnétique. C’est une photodissociation qui est responsable de l’absorption des UV par l’ozone stratosphérique.
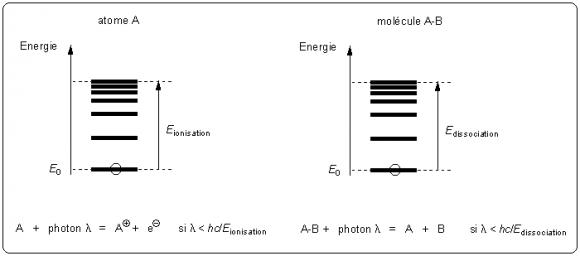
Dans le cas de l’ozone, l’énergie requise pour la dissociation d’une liaison covalente entre deux atomes d’oxygène est de l’ordre de 100 kJ.mol-1. Cela correspond à un rayonnement de longueur d’onde 1180 nm qui se situe dans l’infrarouge. En pratique, l’absorption est observée dès que la longueur d’onde des photons incidents sur l’ozone est inférieure à 1180 nm ce qui déclenche la réaction de dissociation suivante :
(1) O3 + photon → O2 + O
Le rayonnement UV étant de longueur d’onde inférieure à 400 nm, il possède une énergie largement suffisante pour provoquer photodissociation de l’ozone. Il faut signaler que dans le cas d’une longueur d’onde inférieure à 310 nm, la photodissociation libère un atome d’oxygène excité, c’est à dire porté à une énergie supérieure à son énergie minimale. Un tel atome est noté O* et on écrit la réaction de dissociation de deux façons différentes suivant la longueur d’onde absorbée :
(2) O3 + photon → O2 + O si 310 ≤ λ ≤ 1180 nm
(3) O3 + photon → O2 + O si λ ≤ 310 nm
La photodissociation (2) est responsable de l’absorption d’une partie des UV-A et la réaction (3) explique l’absorption de la quasi-totalité des UV-B dans la stratosphère. Les UV-C sont totalement absorbés selon (3) entre 242 à 280 nm et pour les longueurs d’onde inférieure à 242 nm on observe également la réaction de photodissociation du dioxygène (4) dont la contribution à l’absorption des UV-C devient déterminante :
(4) O2 + photon → 2 O si λ ≤ 242 nm
On peut signaler que ce sont les atomes d’oxygène ainsi formés qui vont permettre la formation de l’ozone stratosphérique par réaction sur le dioxygène (5) :
(5) O2 + O → O3
Enfin, ces atomes d’oxygène peuvent également réagir sur l’ozone pour former du dioxygène selon (6) :
(6) O3 + O → 2 O2
L’ozone est donc au coeur d’un équilibre dynamique au sein duquel il est continuellement créé et détruit. C’est le cycle de Chapman [3] dont le bilan est l’équilibre (7) :
(7) 3 O2 → 2 O3
Pour comprendre l’influence de l’ozone stratosphérique sur la température de l’atmosphère, il faut examiner plus en détail la réaction (5) de formation de l’ozone. Pour former l’ozone à partir du dioxygène, il faut former une liaison O-O, or la formation de liaison est une réaction exothermique : elle libère de l’énergie dans le milieu. Cette énergie est égale à l’énergie de la liaison créée (on note la symétrie par rapport à la réaction de dissociation qui nécessite elle d’apporter au moins l’énergie de la liaison pour la briser.)
Pour que la dissociation soit complète, l’énergie libérée doit impérativement être récupérée par une troisième entité également engagée dans le choc. En effet, dans le cas contraire, l’énergie est immédiatement réutilisée pour briser la liaison à peine formée, on parle alors d’un choc non-réactif (réaction 8). La troisième entité est appelée « auxiliaire de choc ». Elle peut être n’importe quelle espèce du milieu, en l’occurrence c’est une des espèces les plus abondantes dans l’atmosphère : N2 ou O2, nous la noterons M. La réaction de formation de l’ozone s’écrit donc (9) :
(8) O2 + O → O3 → O2 + O
(9) O2 + O + M → O3 + M*
Il apparaît donc une espèce M* excitée lors d’un choc réactif. Celle-ci se désexcite rapidement au cours de chocs avec les autres constituants de l’atmosphère durant lesquels elle leur transfère une partie de son énergie sous forme d’énergie cinétique. Cette augmentation de l’agitation moléculaire se traduit par un échauffement du milieu [7].
Le bilan énergétique de l’absorption du rayonnement solaire et en particulier UV par l’ozone stratosphérique est donc le suivant :
-
L'énergie radiative est absorbée par l’ozone ce qui entraîne sa photodissociation.
-
La réaction de recombinaison de l’ozone libère une énergie absorbée par un auxiliaire de choc qui passe à l’état excité.
-
L’auxiliaire de choc se désexcite en transférant son énergie sous forme d’énergie cinétique aux molécules environnantes.
C’est ainsi qu’une fraction importante[5] de l’énergie radiative solaire est convertie en énergie cinétique dans la stratosphère. Ce mécanisme est la principale source de chaleur dans la stratosphère, il est responsable de l’accroissement de température observé à mesure qu’on s’élève dans cette couche de l’atmosphère (figure 1, gauche.)
La conversion de l’énergie radiative en énergie cinétique par le cycle photodissociation du dioxygène et de l’ozone / formation de l’ozone est la principale source de chaleur dans la stratosphère. Ce cycle permet la conversion d’une partie du rayonnement solaire parvenant à la terre. Il permet également de filtrer les rayons UV les plus énergétiques, donc les plus dangereux pour les êtres vivants.
La diminution de la quantité globale d’ozone (« amincissement de la couche d’ozone ») et la forte diminution de cette quantité dans les régions polaires (« trous d’ozone ») repérés dans le dernier quart du vingtième siècle constituent donc un sujet de préoccupation majeure [8]. Cette diminution est aujourd’hui attribuée aux émissions de composés organo-halogénés liées aux activités humaines.
[1] « Le rayonnement thermique, bilan radiatif et effet de serre » V. Daniel, 2003, en ligne sur le site ENS-DGESCO Planet-Terre
[2] « La structure de l’atmosphère » G. Vidal, en ligne sur le site ENS-DGESCO Planet-Terre
[3] « Chimie de l'environnement. Air, eau, sols, déchets », C. Bliefert, R. Perraud, 2001, DeBoeck.
[5] « Les effets de l’ozone sur la santé » en ligne sur le site Santé Publique France
[6] « Chimie physique » P. W. Atkins, J. De Paula 2ème éd. 2004, DeBoeck
[7] « Quel est le rôle de l'ozone dans la séparation troposphère / stratosphère ? », G. Mégie, P. Thomas, en ligne sur le site ENS-DGESCO Planet-Terre
[8] a. « Ozone stratosphérique et émissions de chlorofluorocarbures » B. Urgelli, en ligne sur le site ENS-DGESCO Planet-Terre
b. « Pourquoi y a-t-il moins d'ozone au-dessus de l'Antarctique ? » » B. Urgelli, en ligne sur le site ENS-DGESCO Planet-Terre
Notes
[1] Ces pourcentages sont donnés pour une atmosphère sèche au voisinage de la surface terrestre [3].
[2] Le rayonnement solaire est reproduit de manière correcte par le modèle du corps noir à une température de l’ordre de 6 000 K [1].
[3] ppb : partie par billiard, soit une fraction de 10-9.
[4] Formule de Lewis : représentation dans laquelle un trait plein figure une paire d’électron réunis au sein d’un « doublet électronique ». Ce dernier peut être partagé entre deux atomes pour former ce qu’on appelle une « liaison covalente », ou bien rester localisé sur un des atomes sous la forme d’un « doublet non-liant ».