Cet article est le premier d'une série sur la pénicilline. Après avoir rappelé la définition d'un antibiotique ainsi que ses modes d'action possibles, il développe l'histoire de la pénicilline, premier antibiotique produit industriellement et diffusé largement, depuis sa découverte jusqu'au développement de sa production. L'élucidation de sa structure et sa synthèse seront étudiés dans l'article suivant : « détermination de la structure et synthèse d'un antibiotique ».
Les antibiotiques
On appelle « antibiotiques » des substances chimiques qui agissent sur les bactéries de manière ciblée. Ils peuvent empêcher leur développement, ils sont alors dits « bactériostatiques » ou bien les détruire complètement : ils sont alors « bactéricides ». On connaît aujourd'hui plus de dix mille molécules antibiotiques dont une centaine sont utilisées en médecine.
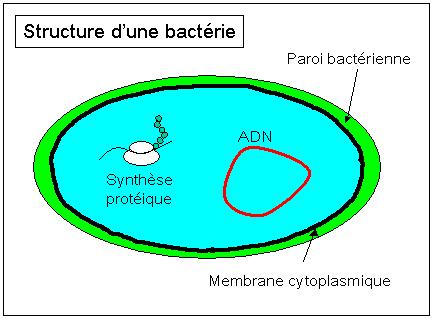
Les antibiotiques peuvent être classés en fonction de leur mode d'action sur les bactéries [1]. Les bactéries sont des organismes parmi les plus simples du monde vivant, ils sont unicellulaires et dénués de noyau (« procaryotes »). Leur structure est rappelée à la figure 1. Le cytoplasme est le milieu interne à la cellule, il contient le patrimoine génétique (ADN circulaire) et les éléments de la synthèse protéique. Il est séparé de l'extérieur par une membrane plasmique et une paroi cellulaire.
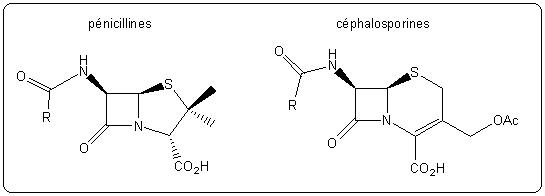
Les antibiotiques agissent généralement sur un des éléments de la structure bactérienne. Les principaux modes d'action sont détaillés ci-après; les structures de quelques antibiotiques sont fournies (les groupements R désignent des chaînes latérales). Les médicaments qui contiennent ces antibiotiques peuvent être retrouvés en ligne sur le site du Vidal, site de référence des professionnels de santé.
- Action sur la paroi bactérienne : l'antibiotique bloque la synthèse de la paroi, ce qui empêche la formation de nouvelles bactéries et peut entraîner la destruction de celles déjà existantes. Les β-lactames (famille à laquelle appartient la pénicilline) agissent suivant ce mode d'action.
- Action sur la membrane cellulaire : l'antibiotique a des propriétés de surfactant* qui lui permettent de s'insérer parmi les phospholipides de la membrane externe. Cela perturbe la perméabilité membranaire qui augmente de façon anormale. Cela permet la diffusion de substances hydrosolubles hors de la bactérie, ce qui entraîne sa destruction. Les polymyxines (peptidiques cycliques) agissent suivant ce mode d'action.
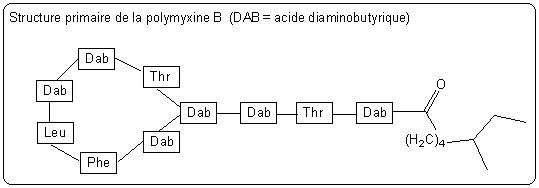
*Un surfactant est une molécule amphiphile, c'est à dire qui présente une tête polaire qui a des affinités pour l'eau et une queue apolaire qui a des affinités pour les substances apolaires comme l'huile. Une telle molécule permet de diminuer la tension de surface entre deux phases.
- Action sur l'ADN:
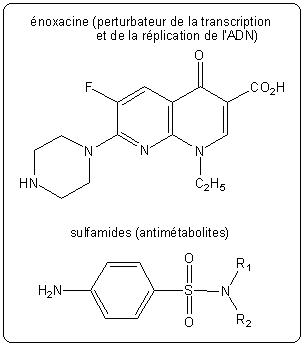
- l'antibiotique va se fixer sur l'ADN et empêcher la progression de l'ADN polymérase. Cela inhibe la réplication de l'ADN, indispensable à la formation de nouvelles bactéries, ainsi que la transcription. Les fluoroquinolones agissent suivant ce mode d'action (énoxacine).
- l'antibiotique est un analogue structurel d'une molécule précurseur des bases entrant dans la composition des acides nucléiques. La bactérie va l'insérer dans son métabolisme mais les légères différences de structure entre l'antibiotique et le précurseur vont entraîner le blocage des voies métaboliques. La cellule ne peut plus synthétiser les acides nucléiques. Les sulfamides agissent suivant ce mode d'action.
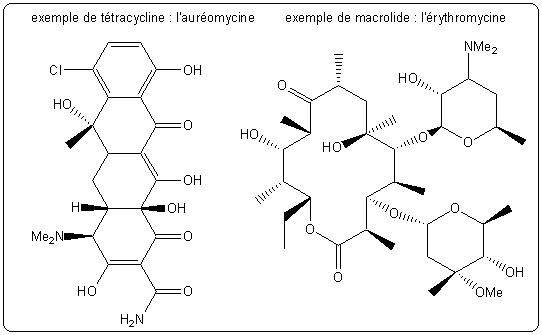
- Action sur la synthèse protéique : l'antibiotique interfère avec la synthèse protéique bactérienne. Les tétracyclines (auréomycine) et les macrolides (érythromycine) agissent suivant ce mode d'action.
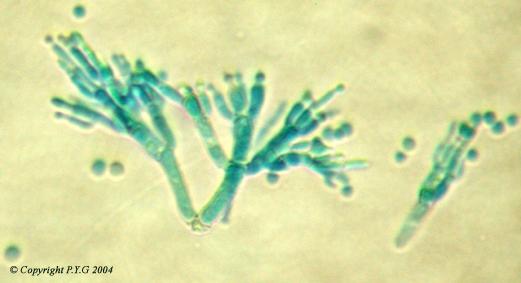
Les pénicillines naturelles sont des molécules synthétisées par certains champignons microscopiques de la famille des Penicillium (cf figure 2). Elles ont des propriétés antibiotiques bactériostatiques : elles empêchent la synthèse de la paroi bactérienne et stoppent donc la prolifération des bactéries. Ce sont les premiers antibiotiques obtenus à l'échelle industrielle et leur utilisation pour traiter les infections a entraîné une véritable révolution médicale au cours de la deuxième moitié du vingtième siècle.
Les phénomènes de compétition chez les micro-organismes sont étudiés dès la fin du dix-neuvième siècle : en 1877 Pasteur et de Joubert constatent que lorsque des bactéries du charbon, Bacillus anthracis [3], sont injectées à un animal en même temps que des bactéries usuelles les animaux ne contractent pas la maladie. En 1897, le médecin français Ernest Duchesne soutient sa thèse de doctorat « Contribution à l’étude de la concurrence vitale chez les micro-organismes : antagonisme entre les moisissures et les microbes ». Il montre que les moisissures présentent une activité antimicrobienne : une culture d'Escherichia coli peut être éradiquée par l'introduction de Penicillium glaucum. Il observe également cette activité in vivo : « certaines moisissures (Penicillium glaucum), inoculées à un animal en même temps que des cultures très virulentes de quelques microbes pathogènes (B. coli et B. typhosus d'Eberth), sont capables d'atténuer dans de très notables proportions la virulence de ces cultures bactériennes » [4]. Ses travaux ne seront pas poursuivis et il faut attendre près de trente ans pour que le hasard permette à Fleming de remettre en évidence l'action bactériostatique des moisissures.
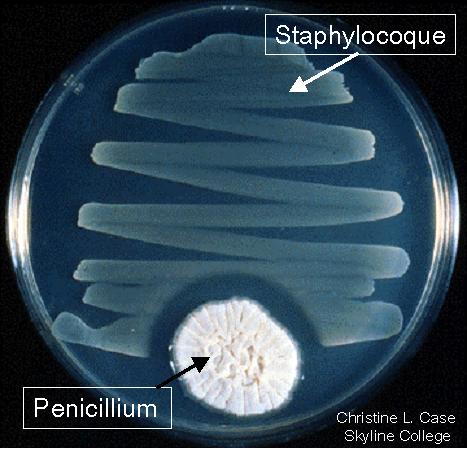
En septembre 1928, de retour de vacances, le docteur Alexander Fleming retrouve son laboratoire londonien et ses cultures de staphylocoques. Il a la mauvaise surprise de constater leur contamination par un champignon microscopique, Penicillium notatum, utilisé dans un laboratoire voisin. Ce genre de contamination n'est pas rare, mais avant de se débarrasser des cultures désormais inutilisables, il a le réflexe de les examiner attentivement. Il constate que les staphylocoques ne se développent pas à proximité du champignon (cf figure 3), il émet alors l'hypothèse que ce dernier synthétise une substance qui bloque le développement de la bactérie et l'appelle « pénicilline ». Fleming publie sa découverte en 1929 et signale les possibilités thérapeutiques « la pénicilline utilisée en doses massives n’est ni toxique ni irritante… elle peut constituer, par applications ou en injections, un antiseptique efficace contre les microbes ». Mais la pénicilline est très difficile à purifier et isoler en quantités appréciables et elle est bientôt oubliée. Il faut attendre une dizaine d'années avant qu'elle revienne sur le devant de la scène.
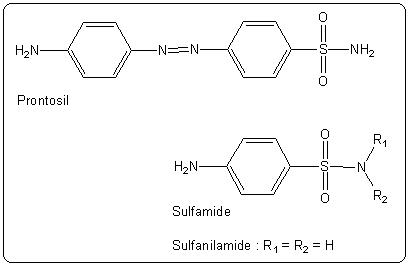
La recherche d'agents anti-infectieux a été très active dès le début du vingtième siècle et en particulier pendant la première guerre mondiale. En effet, en temps de guerre, l'infection des blessures est la première cause de mortalité des combattants. La première grande avancée thérapeutique a lieu entre 1932 et 1935 quand le médecin allemand Domagk[1] découvre les propriétés antibactériennes d'un colorant, le prontosil (cf figure 4). Une équipe française de l'institut Pasteur montre que le prontosil est dégradé en sulfanilamide (cf figure 4) dans l'organisme et que c'est cette molécule qui est le principe actif contre les bactéries. Elle appartient à la famille des sulfamides dont de nombreuses molécules seront synthétisées et testées. Les sulfamides deviennent ainsi les premiers antibiotiques synthétiques et sont encore utilisés aujourd'hui. Mais leur spectre d'action est relativement étroit et leur métabolisation par l'organisme fait souvent apparaître des produits toxiques. Au début de la seconde guerre mondiale, la recherche d'anti-infectieux est encore très active et quelques scientifiques de l'université d'Oxford se souviennent des travaux de Fleming sur la pénicilline.
Au début des années 1940, à l'université d'Oxford, le pharmacologiste Howard Florey et le biochimiste Ernst Chain reprennent les travaux sur la pénicilline. Ils mettent en place une culture à grande échelle d'une souche de Penicillium notatum obtenue grâce à Fleming et parviennent ainsi à en isoler une quantité très faible. Le chimiste Edward Abraham est chargé de la purifier. Pour cela, il met en oeuvre une technique alors toute récente : la chromatographie sur colonne d'alumine [5]. En 1940, les premiers essais in vivo montrent que la pénicilline permet de sauver des souris infectées par des streptocoques. Les essais sur les êtres humains commencent dès 1941 : les résultats sont spectaculaires, des infections auparavant potentiellement mortelles sont guéries en quelques semaines grâce à la pénicilline. Elle acquiert très vite le statut de « médicament miraculeux », mais les stocks sont quasiment inexistants en raison des grandes difficultés d'obtention. En effet, d'une part Penicillium notatum ne produit qu'une quantité faible de pénicilline et uniquement dans un milieu riche en oxygène. Cela impose d'utiliser des cultures en surface, beaucoup plus difficiles à mettre en oeuvre que les cultures en cuve. D'autre part, la pénicilline est très instable, en particulier aux pH faibles et élevés, ce qui rend son extraction et sa purification extrêmement difficile. La pureté de la pénicilline utilisée dans les premiers essais in vivo a été rétrospectivement évaluée de l'ordre de 1% !
Les premiers essais sur les êtres humains sont très encourageants et Florey essaie d'impliquer les firmes pharmaceutiques britanniques dans le développement de la production. Mais la deuxième guerre mondiale empêche la réalisation de ce projet en Grande Bretagne, c'est pourquoi les chercheurs s'expatrient aux États-Unis avec leur précieuse souche de Penicillium notatum. Ce qui arrive alors est aujourd'hui considéré comme le point de départ des biotechnologies. En effet, de multiples techniques seront mises au point pour accroître le rendement et elles sont depuis au coeur de nombreux procédés. On peut citer, entre autres, les dispositifs d'extraction [6] et de lyophilisation[2] à grande échelle et l'amélioration des souches productrices par mutagénèse et sélection.
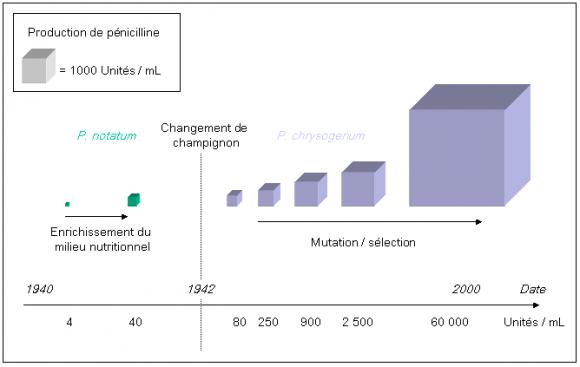
Les efforts concentrés sur l'amélioration de la production ont permis de gagner plusieurs ordres de grandeur en quelques années : initialement, un millilitre de culture permettait d'obtenir 4 unités de pénicilline en 200 heures[3]. À titre de comparaison, le traitement d'une angine à la pénicilline requiert en général 3 millions d'unités par jour pendant une dizaine de jours soit la production de 7 500 litres de cette culture. La première étape a consisté en un changement du milieu de culture. Son enrichissement en nutriments plus adaptés à la souche utilisée a permis de passer à 40 unités / mL de culture, soit un accroissement d'un facteur 10. Mais la culture en surface était intrinsèquement limitée et les chercheurs n'ont eu de cesse de passer à une culture en volume. Il a été rapidement clair que Penicillium notatum ne permettrait pas ce changement de technologie. En effet, l'approvisionnement en oxygène est plus faible dans une culture en volume que dans une culture en surface et le rendement en pénicilline de Penicillium notatum devient alors très faible. Après un criblage d'échantillons de moisissure en provenance de tout le globe, c'est un champignon trouvé sur un melon dans la région du laboratoire de recherche qui permettra la migration vers le procédé volumique : Penicillium chrysogenum permettra de produire 80 unités / mL de culture en volume, avec une capacité de production accrue par rapport à la variété notatum. En effet, le passage en cuves de fermentation permet un changement d'échelle. La sélection génétique d'un mutant a rapidement permis d'atteindre 250 unités / mL de culture puis 900 puis 2500 unités / mL. Aujourd'hui, les sélections successives ont abouti à des souches qui produisent plus de 60000 unités / mL de culture en 200 heures, soit plus de quinze mille fois plus que la souche de départ (cf figure 5).
À partir de 1942, les grandes firmes pharmaceutiques américaines (Merck, Pfizer...) sont associées au projet dans le but de permettre un changement d'échelle de la production. La pénicilline est alors considérée comme une substance stratégique par les pouvoirs publics américains et sa production devient un effort de guerre : les quantités obtenues sont prioritairement allouées aux forces armées. En 1944, Pfizer inaugure sa première usine de production de la pénicilline et les soldats alliés disposent de pénicilline le jour du débarquement en normandie. Dès 1945, la production est suffisante pour que les restrictions sur sa distribution soient levées; elle est bientôt disponible dans toutes les pharmacies du pays. Fleming, Florey et Chain recevront le prix Nobel de physiologie-médecine pour « la découverte de la pénicilline et ses effets curatifs de nombreuses maladies infectieuses » en 1945 [7].
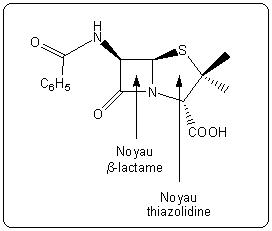
Il est intéressant de remarquer que la pénicilline est devenue un médicament produit en quantité industrielle alors même que sa structure chimique n'était pas encore complètement élucidée et son mode d'action totalement inconnu. Cette structure, donnée à la figure 6, est relativement inattendue car elle fait apparaître un bicycle assez tendu. Elle est étudiée de manière plus détaillée dans l'article suivant, « détermination de la structure et synthèse d'un antibiotique ».
Des maladies bactériennes mortelles comme la tuberculose, la pneumonie, la diphtérie, la syphilis ou encore le tétanos contre lesquelles il n'existait aucun remède il y a 60 ans peuvent désormais être traitées grâce aux antibiotiques. On considère aujourd'hui que leur utilisation thérapeutique a permis d'allonger la durée moyenne de la vie humaine d'une dizaine d'année. Toutefois, on constate partout une augmentation de l'antibiorésistance des bactéries, c'est à dire de leur capacité à résister aux antibiotiques. La lutte contre l'antibiorésistance passe bien sûr par la recherche de nouveaux antibiotiques, mais elle commence surtout par une utilisation plus raisonnée des antibiotiques disponibles [8], au risque de se retrouver dans dix ou vingt ans aussi démunis qu'au début du vingtième siècle contre les maladies infectieuses [9].
[1] a) G. L. Patrick « Chimie pharmaceutique » 2003, De Boeck. b) Y. Landry, J-P. Gies « Pharmacologie moléculaire » 1990, Medsi / McGraw-Hill. c) W. C. Bowman, M. J. Rand « Textbook of pharmacology » 2ème éd. 1980, Blackwell.
[2] Le site du Vidal, site de référence des professionnels de santé
[3] « La maladie du charbon ou anthrax : un exemple d'infection bactérienne », publié sur le site Planet-Vie
[4] Thèse d'Ernest Duchesne, 1897 « Contribution à l’étude de la concurrence vitale chez les micro-organismes : antagonisme entre les moisissures et les microbes ».
[5] La chromatographie sur colonne, publié sur CultureSciences-Chimie
[6] L'extraction liquide-liquide, publié sur CultureSciences-Chimie
[7] Le prix Nobel de physiologie-médecine attribué à Fleming, Florey et Chain.
[8] Site de l'Assurance Maladie sur l'usage raisonné des antibiotiques : « les antibiotiques c'est pas automatique ».
[9] Rapport de l'Organisation Mondiale de la Santé sur la santé dans le monde (1996).
[10] La pénicilline II - Détermination de la structure et synthèse d'un antibiotique, publié sur CultureSciences-Chimie
Notes
[1] G. Domagk, prix Nobel de physiologie-médecine 1939.
[2] La lyophilisation, ou cryodessication, est un procédé de déshydratation à froid qui consiste à éliminer l'eau contenue dans un produit par sublimation. L'activité biologique de la substance lyophilisée est conservée.
[3] Une unité de pénicilline correspond à 0,6 microgrammes.