Cet article en deux volets présente une nouvelle voie de recherche en chimie médicinale pour le traitement de la maladie d'Alzheimer, pathologie neuro-dégénérative affectant près d'un million de personnes en France.
Le premier volet de cet article traite du rôle du cuivre dans la maladie d'Alzheimer et présente des molécules conçues pour réguler sa concentration au sein de l'organisme d'un malade. Le second volet (ci-dessous) expose le principe de ce traitement et les résultats très encourageants obtenus avec ces molécules.
Le lecteur est invité à lire le premier volet de cet article avant de poursuivre sa lecture.
Principe de cette voie thérapeutique
Extraction du cuivre des plaques amyloïdes
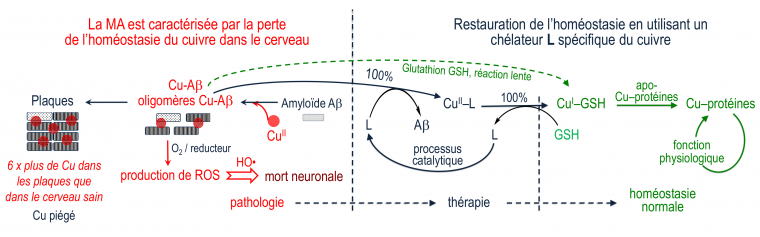
Des ligands L ont été conçus pour extraire le Cu(II) se trouvant dans des complexes cuivre - peptide amyloïde (Cu-Aβ) pour donner le complexe CuII–L [10]. Par une suite de réactions, le Cu(II) est ensuite transféré au glutathion, puis à d'autres protéines de l'organisme fonctionnant avec ce métal, afin de restaurer l'homéostasie du cuivre.
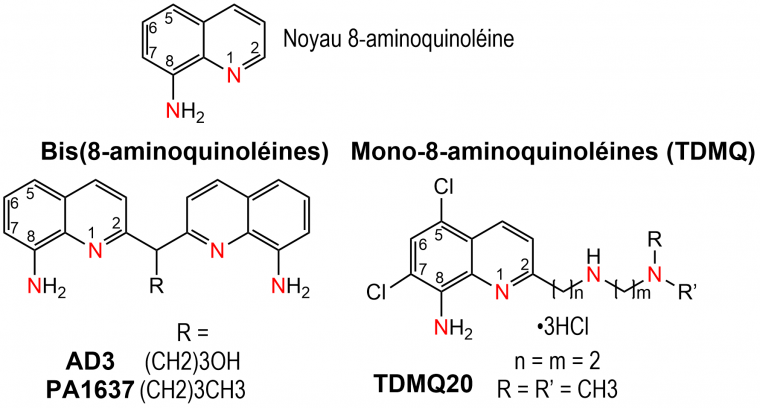
Les ligands utilisés (Figure 1), possédant un squelette 8-aminoquinoléine, sont spécifiques de l'ion cuivre (II).
La géométrie de ces ligands est adaptée pour une coordination plan-carré, structure stable des complexes de cuivre(II), mais pas de ceux de cuivre(I).
Implication du glutathion et restauration de l'homéostasie du cuivre
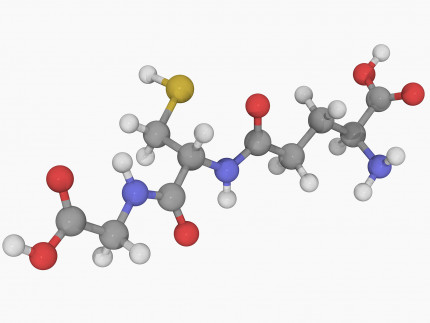
Le glutathion (tripeptide γ-L-glutamyl-L-cystéinylglycine) est un réducteur physiologique, du fait de la fonction thiol de la cystéine. Les atomes sont représentés par des sphères de différentes couleurs (gris : carbone, blanc : hydrogène, rouge : oxygène, bleu : azote, jaune : soufre).
Le glutathion (GSH, Figure 2) est un tripeptide physiologique, concentré dans la plupart des cellules, qui est un réducteur puissant. Il agit sur le complexe CuII–L à la fois comme réducteur, et comme ligand compétiteur du Cu(I) formé. Après réduction par GSH, le Cu(I) est alors libéré par le complexe CuII–L et transféré au glutathion avec lequel il forme un complexe Cu(I)-glutathion, qui est le "fournisseur" physiologique du cuivre à de nombreuses protéines fonctionnant avec ce métal [9]. Le chélateur L est régénéré et peut ainsi extraire le cuivre de Cu-Aβ selon un processus catalytique ne nécessitant qu'une faible concentration de L (Figure 3). En deux étapes distinctes, le cuivre peut donc passer des complexes Cu-amyloïdes où il est piégé sous une forme pathologique, aux protéines physiologiques qui en ont besoin. Ce transfert est médié par le glutathion physiologique d'une part, et par le chélateur L qui est un médicament potentiel d'autre part.
Parmi les ligands de type TDMQ (par exemple, TDMQ20, Figure 1), plusieurs sont spécifiques du cuivre(II) et induisent efficacement in vitro les deux étapes nécessaires à la régulation de l'homéostasie du cuivre décrites ci-dessus, à savoir l'extraction du Cu(II) de Cu-Aβ et le relargage du Cu(I) de Cu–TDMQ en présence de glutathion [11]. L'extraction du cuivre de Cu-Aβ est également efficace en présence de 100 équivalents molaires de Zn(II), conditions qui miment l'environnement riche en zinc du cerveau [12].
Importance de la structure des complexes formés
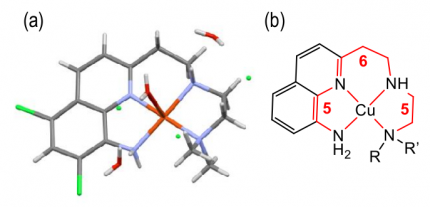
(a) Tracé ORTEP de la structure obtenue par diffraction des rayons X de monocristaux de CuII-TDMQ20
(b) Représenation schématique du complexe.
Comme pour les bis(8-aminoquinoléines), ces propriétés peuvent être expliquées par la structure parfaitement plan-carré du complexe stable Cu-TDMQ20 (Figure 4, la structure obtenue par diffraction des rayons X montre la présence d’une molécule d'eau faiblement liée en position apicale) ; en revanche, ce ligand est inadapté pour former des complexes tétraédriques, qui est la géométrie habituelle des complexes stables de Cu(I) ou de Zn(II). Ces caractéristiques sont essentielles pour extraire efficacement le cuivre de Cu-Aβ.
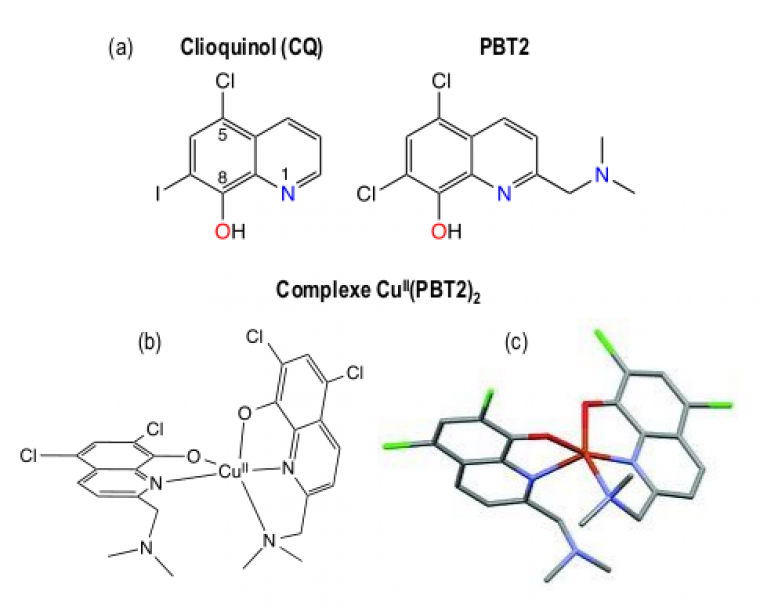
Ces résultats permettent d'expliquer l'échec lors des essais cliniques du clioquinol (CQ) et de PBT2 [13], deux molécules comportant une structure 8-hydroxyquinoléine (Figure 5), qui sont les prototypes historiques de la tentative de chélation du cuivre dans le traitement de la MA [14]. De plus, le clioquinol, autrefois utilisé comme antifongique, a été retiré du marché à cause de sa neurotoxicité due à l'affinité de ce ligand pour le zinc [15].
(a) Structure des 8-hydroxyquinoléines clioquinol (CQ) et PBT2 ; (b) Structure schématique du complexe CuII(PBT2)2 ; (c) tracé ORTEP de la structure par diffraction des rayons X de monocristaux de CuII(PBT2)2.
Comme toutes les 8-hydroxyquinoléines, CQ et PBT2 ne sont pas des ligands spécifiques du cuivre. CQ et PBT2 sont des ligands bi- ou tridentates (c’est-à-dire possédant 2 ou 3 sites de coordination du métal), alors qu'une coordination stable de l’ion cuivre (II) requiert 4 sites de coordination, préférentiellement des atomes d'azote, disposés aux angles d'un plan-carré dont le cuivre occupe le centre (comme ci-dessus pour Cu-TDMQ20, Figure 4). Ainsi, afin de compléter la sphère de coordination du métal, les complexes cuivriques de CQ ou PBT2 ont généralement une stœchiométrie ligand/métal = 2/1, comme l'indique la structure cristallographique du complexe Cu(PBT2)2 (Figure 5c) [16]. En présence de Cu-Aβ, ces ligands viennent compléter la sphère de coordination du cuivre constituée d'acides aminés, et forment des complexes ternaires Aβ-Cu-CQ ou Aβ-Cu-PBT2. Le mode de coordination des 8-hydroxyquinoléines ne convient donc pas pour extraire efficacement le cuivre piégé dans les amyloïdes. La compréhension à l'échelle moléculaire des raisons de l'échec thérapeutique de CQ et PBT2 est importante pour la mise au point de chélateurs du cuivre efficaces et non toxiques.
Résultats obtenus
Les bis(8-aminoquinoléines) et TDMQ inhibent in vitro le stress oxydant induit par Cu-Aβ
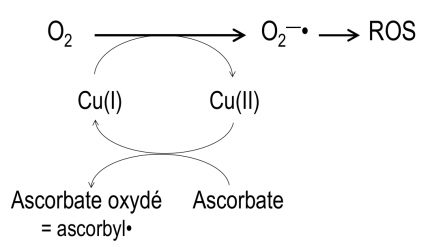
Ces chélateurs spécifiques de Cu(II) sont susceptibles d'inhiber efficacement la production de ROS induite par Cu-Aβ. In vitro, la réduction du dioxygène est évaluée indirectement par l'oxydation d'ascorbate, réducteur nécessaire à la régénération du cuivre(I) : la diminution de la quantité d'ascorbate (visualisée par la mesure de son absorbance à 265 nm) est donc proportionnelle à la production d'espèces réactives de l'oxygène (Reactive Oxygen Species, ROS, en anglais) (Figure 6).
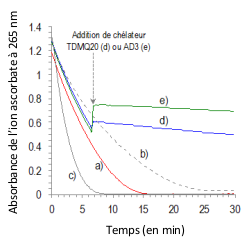
Il y a addition de L (1 équivalent molaire) à 6,6 min (flèche grise sur le graphique) : L = rien (courbe a), L = TDMQ20 (courbe d), L = AD3 (courbe e). L'oxydation d'ascorbate en présence de CuCl2/Aβ1-16, (courbe b), ou CuCl2 seul (courbe c) sont données pour comparaison. L'augmentation de l'absorbance lors de l'addition de TDMQ20 (courbe d) ou AD3 (courbe e) à 6,6 min, est due à l'absorbance propre de CuII-TDMQ20, ou de CuII-AD3 à 265 nm. NB : La quantité de ROS produits est proportionnelle à celle d’ions ascorbate oxydés.
En présence de CuCl2 (Figure 7, courbe a) ou de Cu-Ab (courbe b), l'oxydation de l'ascorbate est très rapide : de l'ordre de 50 à 60 % en 6 minutes. L'ajout d'un seul équivalent molaire de chélateur TDMQ20 (courbe d) ou AD3 (courbe e) permet d'inhiber totalement ce stress oxydant en cours, même en présence d'un fort excès de zinc. Dans les mêmes conditions, ni CQ ni PBT2 n'inhibent l'oxydation de l'ascorbate. En effet, dans les complexes ternaires Aβ-Cu-CQ ou Aβ-Cu-PBT2, comme dans le complexe Cu(PBT2)2, la sphère de coordination du métal, constituée d'atomes d'azote et d'oxygène, est fortement distordue et ne possède pas les contraintes stériques des complexes Cu-TDMQ : elle convient aussi bien au cuivre(I) tétraédrique qu'au cuivre(II) plan-carré. De ce fait, les complexes de cuivre des 8-hydroxyquinoléines et les complexes ternaires Aβ-Cu-8-hydroxyquinoléine sont doués d'activité oxydo-réductrice et, donc, incapables d'inhiber le stress oxydant induit par Cu-Aβ [16].
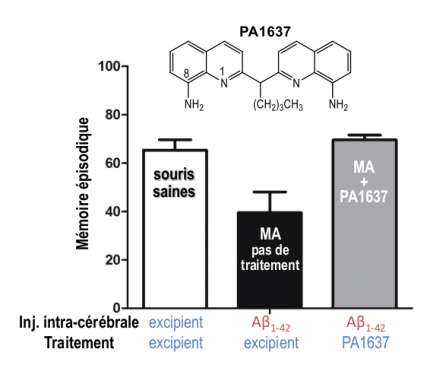
Les molécules PA1637 et TDMQ20 inhibent in vivo la perte de mémoire épisodique de souris Alzheimer
L'aptitude de ces chélateurs à inhiber la perte de mémoire récente (dite « mémoire épisodique ») a été testée sur un modèle de souris non-transgénique atteinte de la maladie d'Alzheimer [17]. Une injection intracérébrale d'oligomères d'Aβ1-42 permet de reproduire chez la souris la perte de mémoire épisodique présente à un stade précoce de la maladie. Cette perte de mémoire est mise en évidence deux semaines après l'injection. L’administration orale de la molécule PA1637 (voir Figure 1) est débutée à ce moment-là (8 doses de 25 mg/kg en deux semaines).
L'évaluation des souris, effectuée à la fin du traitement, indique que l'état des souris Alzheimer traitées par la molécule PA1637 n'est pas significativement différent de celui des souris saines (Figure 8, barres blanche et grise). Ce court traitement de PA1637 permet donc d’inhiber totalement le déficit cognitif induit par l’injection d’Aβ1-42, et visualisé par la différence entre les barres blanche (souris saines) et noire (souris Alzheimer). Lors de ce test, la molécule PA1637 est plus active que le clioquinol, exemple de 8-hydroxyquinoléine ayant fait l'objet d'essais cliniques contre la MA. De plus, la molécule PA1637 ne présente aucune toxicité par voie orale à 400 mg/kg, soit plus de 30 fois la dose curative.
Son index de sécurité (défini par le rapport dose toxique/dose active) est donc meilleur que celui du clioquinol [18]. La molécule TDMQ20, testée à 10 mg/kg (même protocole constitué de 8 doses orales réparties en deux semaines), possède la même capacité à normaliser la mémoire épisodique des souris non transgéniques. Son index de sécurité est supérieur à 80 et elle peut être administrée chez la souris pendant trois mois sans signe de toxicité détectable.
Par ailleurs, les chélateurs de type TDMQ sont sans influence in vitro sur l'activité catalytique de la Cu,Zn-superoxyde dismutase ou de la tyrosinase, deux enzymes à cuivre exprimées dans le cerveau et impliquées dans la régulation des processus d'oxydo-réduction et la biochimie des neurotransmetteurs in vivo.
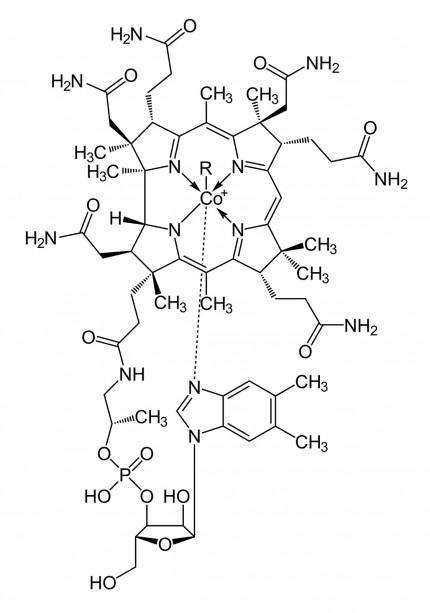
Dans des conditions biologiques, les TDMQ ne démétallent pas non plus la vitamine B12, un complexe de cobalt qui joue un rôle important dans le fonctionnement du système nerveux (Figure 9). Il est donc permis de penser qu'ils ne perturberont pas in vivo l'activité de ces enzymes ou coenzymes ; cette inertie des chélateurs du cuivre vis-à-vis des métalloenzymes est bien sûr un pré-requis à leur développement pharmacologique [19].
De la chimie de coordination à la conception de molécules actives
L'étude de la structure cristallographique d'une série de complexes métalliques de TDMQ a montré que la forte affinité de ces ligands pour le Cu(II), ainsi que leur sélectivité pour le cuivre par rapport au zinc, étaient déterminée par leur capacité à générer des complexes N4-plans-carrés du Cu(II), de stœchiométrie métal/ligand = 1/1. Corrélativement, des ligands TDMQ dont la chaîne latérale (trop courte ou trop longue) n'est pas favorable à une coordination plan-carré du cuivre, ne sont efficaces ni pour extraire le cuivre des complexes Cu-amyloïdes Cu-Ab, ni pour inhiber le stress oxydant généré par Cu-Aβ [11].
Les résultats obtenus avec les bis(8-aminoquinoléines) et les TDMQ montrent donc qu'il existe une forte corrélation entre la structure des ligands et :
- la géométrie des complexes cuivriques qu'il génèrent,
- la capacité des ligands à transférer le cuivre de Cu-Aβ au glutathion in vitro, tout en respectant l'activité des enzymes à cuivre,
- leur aptitude à inhiber in vitro le stress oxydant catalysé par Cu-Aβ,
- leur efficacité à inhiber la perte de mémoire épisodique chez la souris Alzheimer.
La physico-chimie de ces chélateurs (affinité et sélectivité pour les métaux, structure des complexes, etc...) permet, dans une certaine mesure, de prévoir leur capacité à contrecarrer les effets délétères de la perte de l'homéostasie du cuivre dans le cerveau des patients, sans perturber l'activité des enzymes à cuivre ni les multiples fonctions du zinc.
La prise en compte de la chimie de coordination du cuivre et du rôle des métaux dans les réactions d’oxydo-réduction en biologie est donc un élément essentiel de la conception de molécules ayant des chances raisonnables de succès pour traiter efficacement cette pathologie majeure.
Bibliographie commune aux deux volets
- World Alzheimer Report 2015. The global impact of dementia – An Analysis of prevalence, incidence, cost and trends. https://www.alz.co.uk/research/WorldAlzheimerReport2015.pdf ; Disponible, 20 juillet 2020.
- D. J. Selkoe, J. Hardy. The amyloid hypothesis of Alzheimer's disease at 25 years. EMBO Mol. Med. 2016, 8, 595-608.
- Tomiyama, T.; Matsuyama, S.; Iso, H.; Umeda, T.; Takuma, H.; Ohnishi, K.; Ishibashi, K.; Teraoka, R.; Sakama, N.; Yamashita, T.; Nishitsuji, K.; Ito, K.; Shimada, H.; Lambert, M. P.; Klein, W. L.; Mori, H. A mouse model of amyloid β oligomers: Their contribution to synaptic alteration, abnormal tau phosphorylation, glial activation and neuronal loss in vivo. J. Neurosc. 2010, 30, 4845-4856.
- Cummings, J. L.; Travis, M.; Zhong, K. Alzheimer’s disease drug-development pipeline: few candidates, frequent failures. Alzheimer’s Res. Ther. 2014, 6, 37-43.
- Bayer, T. A.; Schäfer, S.; Simons, A.; Kemmling, A.; Kamer, T.; Tepest, R.; Eckert, A.; Schüssel, K.; Eikenberg, O.; Sturchler-Pierrat, C.; Abramowski, D.; Staufenbiel, M.; Multhaup, G. Dietary Cu stabilizes brain superoxide dismutase 1 activity and reduces Aβ production in APP23 transgenic mice. Proc. Natl. Acad. Sci. USA 2003, 100, 14187-14192.
- Liu, Y.; Nguyen, M.; Robert, A.; Meunier, B. Metal ions in Alzheimer’s disease: A key role or not? Acc. Chem. Res. 2019, 52, 2026-2035.
Acc. Chem. Res. 2015, 48, 1332-1339. Nguyen, M.; Robert, A.; Sournia-Saquet, A.; Vendier, L.; Meunier, B. Characterization of new specific copper chelators as potential drugs for the treatment of Alzheimer’s disease. Chem. Eur. J. 2014, 20, 6771–6785. Nguyen, M.; Bijani, C.; Martins, N.; Meunier, B.; Robert, A. Transfer of copper from an amyloid to a natural copper-carrier peptide with a specific mediating ligand. Chem. Eur. J. 2015, 21, 17085-17090. Nguyen, M. ; Robert, A.; Sournia-Saquet, A.; Vendier, L.; Meunier, B. The necessity of having a tetradentate ligand to extract copper(II) ions from amyloids. ChemistryOpen 2015, 4, 27-31. Zhang, W.; Huang, D.; Huang, M.; Huang, J.; Wang, D.; Liu, X.; Nguyen, M.; Vendier, L.; Mazères, S.; Robert, A.; Liu, Y.; Meunier, B. Preparation of new tetradentate copper chelators as potential anti-Alzheimer agents. ChemMedChem 2018, 13, 684-704. Zhang, W.; Liu, Y.; Hureau, C.; Robert, A.; Meunier, B. N4-Tetradentate chelators efficiently regulate copper homeostasis and prevent ROS production induced by copper-amyloid-beta-1-16, even in the presence of an excess of zinc. Chem. Eur. J. 2018, 24, 7825-7829. https://www.prnewswire.com/news-releases/prana-biotechnology-announces-preliminary-results-of-phase-2-imagine-trial-of-pbt2-in-alzheimers-disease-253173581.html. Prana Biotech, Communiqué de presse du 31 mars 2014. Disponible, 21 juillet 2020. Cherny, R. A.; Atwood, C. S.; Xilinas, M. E.; Gray, D. N.; Jones, W. D.; McLean, C. A.; Barnham, K. J.; Volitakis, I.; Fraser, F. W.; Kim, Y.-S.; Huang, X.; Goldstein, L. E.; Moir, R. D.; Lim, J. T.; Beyreuther, K.; Zheng, H.; Tanzi, R. E.; Masters, C. L.; Bush, A. I. Treatment with a copper-zinc chelator markedly and rapidly inhibits beta-amyloid accumulation in Alzheimer's disease transgenic mice. Neuron 2001, 30, 665-676. Andersson, D. A.; Gentry, C.; Moss, S.; Bevan, S. Clioquinol and pyrithione activate TRPA1 by increasing intracellular Zn2+. Proc. Natl. Acad. Sci. USA 2009, 109, 8374-8379. Nguyen, M. ; Vendier, L. ; Stigliani, J.-L. ; Meunier, B. ; Robert, A. Structures of copper and zinc complexes of PBT2, a chelating agent evaluated as potential drug for neurodegenerative diseases. Eur. J. Inorg. Chem. 2017, 600-608. Ceccom, J.; Coslédan, F.; Halley, H.; Francès, B.; Lassalle, J.-M.; Meunier, B. Copper chelator induced efficient episodic memory recovery in a non-transgenic Alzheimer's mouse model. PloS One 2012, 7, 43105. - Huang, J.; Nguyen, M.; Liu, Y.; Robert, A.; Meunier, B. The TDMQ regulators of copper homeostasis do not disturb Cu,Zn-SOD and tyrosinase activity, nor the Cu(III) cofactor vitamin B12. Eur. J. Inorg. Chem. 2019, 1384-1388.