Se penchant sur l'interprétation du spectre de raies de l'hydrogène, le physicien danois Niels Bohr corrige en 1913 le modèle planétaire proposé par Rutherford quelques années auparavant. Il ébauche ainsi le premier modèle de l'atome dérivant des récentes théories quantiques.
Introduction
Se penchant sur l'interprétation du spectre de raies de l'hydrogène, le physicien danois Niels Bohr (Figure 1) corrige en 1913 le modèle planétaire proposé par Rutherford quelques années auparavant. Il ébauche ainsi le premier modèle de l’atome dérivant des récentes théories quantiques.
Analyse du spectre d'émission de l'hydrogène
Si le modèle planétaire de Rutherford [1] était valide, le spectre d'émission de l'hydrogène devrait être un continuum. C'est-à-dire qu'il devrait présenter l'ensemble des longueurs d'onde accessibles : un arc-en-ciel en somme.
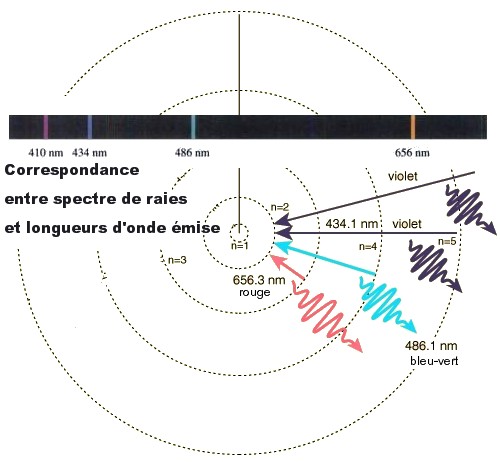
La réalité est effectivement tout autre car le spectre d'émission de l'atome d'hydrogène est un spectre de raies. L'électron de l'atome d'hydrogène n'a accès qu'à certains niveaux d'énergie ; en d'autres termes, son énergie est quantifiée. Ainsi les sauts électroniques d'un niveau d'énergie à un autre entraînent l'émission d'une longueur d'onde particulière (Figure 2). L'ensemble de ces longueurs d'onde constitue le spectre de raies de l'atome d'hydrogène.
Si tous les niveaux d'énergie étaient accessibles, l'ensemble des longueurs d'onde pourrait ainsi être décrit et le spectre serait continu.
Ces transitions électroniques dans le visible pour l'atome d'hydrogène sont connues comme étant la série de Balmer.
En 1913, Niels Bohr, qui connaissait ces résultats expérimentaux, élabora un modèle quantique de l’atome d’hydrogène. D'après ce modèle, l'électron de l'atome d'hydrogène ne gravite autour du noyau que selon des orbites circulaires particulières, nommées couches électroniques.
Bibliographie et ressources en ligne
- L'expérience de Rutherford par David Bousquet, Pierre Perrodin, Diane Bousquet et Michaël Delcey publié sur CultureSciences-Chimie.
- Steven S. Zumdhal ; Chimie Générale ; De Boeck 2è Ed. (1999)