Cette expérience a pour but de montrer de façon visuelle la très grande solubilité de l'ammoniac gazeux dans l'eau. Sa solubilité dans l'eau à 25 °C est d'environ 24 mol.L-1. On pourra également constater la nature acido-basique de l'ammoniac. Nous verrons enfin quelles sont les raisons de la forte solubilité de NH3 dans l'eau.
Introduction
Cette expérience a pour but de montrer de façon visuelle la très grande solubilité de l'ammoniac gazeux dans l'eau. Sa solubilité dans l'eau à 25°C est d'environ 24 mol.L-1. On pourra également constater la nature acido-basique de l'ammoniac. Nous verrons enfin quelles sont les raisons de la forte solubilité de NH3 dans l'eau.
|
Sécurité |
Attention, l'ammoniac est un gaz incolore à odeur piquante. Il est très corrosif et peut provoquer des irritations pour les voies respiratoires et de graves brûlures. C'est pourquoi, lorsqu'on le manipule, il est obligatoire de se mettre sous une hotte ventilée et de manipuler avec gants et lunettes. |
Protocole expérimental
Avant la réalisation de l'expérience à proprement parler, on introduit sous la hotte de l'ammoniac gazeux dans un ballon en plaçant celui-ci l'ouverture tournée vers le bas, car l'ammoniac gazeux a une densité inférieure à celle de l'air. L'ammoniac gazeux occupe ainsi la partie haute du ballon. On place une fois le ballon rempli, un bouchon percé par un tube flexible en caoutchouc et serré par une pince à son extrémité.
Le ballon est ensuite placé sur un anneau au dessus d'un autre ballon rempli d'eau et de quelques gouttes de phénolptaléïne, selon le montage suivant :
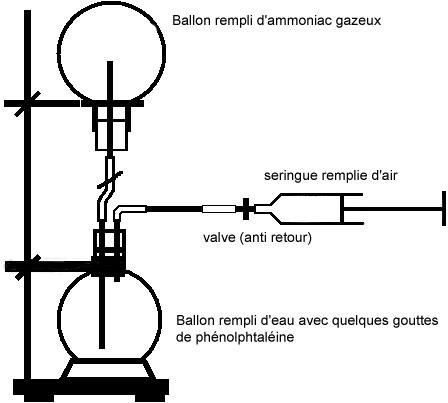 |
Une fois le montage réalisé, on enlève l'attache permettant d'éviter la communication entre les deux ballons. Puis on injecte de l'air dans le ballon inférieur, en appuyant sur le piston de la seringue remplie d'air. Une fois le piston arrivé en fin de course, on retire la seringue et on observe.
Observations et interprétations
Observations
On observe que l'eau monte dans le ballon supérieur de façon spectaculaire en rosissant, tel un jet d'eau.
Interprétations
La pression exercée par l'ajout d'air à l'aide de la seringue permet de transférer quelques gouttes d'eau dans le ballon supérieur. Les gouttes d'eau introduites dans le ballon supérieur permettent de solubiliser une grande quantité d'ammoniac. Cette dissolution provoque une légère dépression dans le ballon supérieur et par conséquent une aspiration de la solution. Ce phénomène s'amplifie jusqu'à dissolution de tout l'ammoniac gazeux contenu dans le ballon supérieur. La solution devient rose, car l'indicateur coloré a pris sa teinte basique, on peut donc en conclure que la solution d'ammoniaque obtenue est basique, elle a un pH largement supérieure à 9,2 (pKA de la phénolphtaléïne).
La forte solubilité de l'ammoniac gazeux dans l'eau s'explique surtout par l'établissement de liaisons hydrogènes favorables entre les molécules d'eau et celles d'ammoniac. De plus, l'ammoniac tout comme l'eau est une molécule polaire. « Qui se ressemble s'assemble ».
La même expérience est réalisable avec du chlorure d'hydrogéne gazeux et en changeant l'indicateur coloré. On peut prendre par exemple du bleu de bromothymol (BBT).
Références bibliographiques pour approfondir
- Chimie. Molécules, matière, métamorphoses. DeBoeck Université.
- Liaisons intermoléculaires : les forces en jeu dans la matière condensée. CNRS Editions - InterEditions. 1995.
- Florilège de chimie pratique. Collection enseignement des sciences - Hermann - Editeurs des sciences et des arts. 1999.







