Une molécule chirale possède deux énantiomères. Ces énantiomères sont des composés de même formule chimique, images l'un de l'autre dans un miroir, et qui ne se superposent pas.
Présentation
Leurs propriétés physico-chimiques sont identiques, mais au niveau biologique, les deux énantiomères d'une molécule, un médicament par exemple, peuvent avoir des effets physiologiques différents voire antagonistes : l'un peut être toxique tandis que l'autre peut avoir des propriétés thérapeutiques. D'où l'importance de pouvoir les séparer ou de les synthétiser séparément, et donc de briser la symétrie habituelle de la réaction chimique qui conduit aux deux énantiomères, pour accéder à l'énantiomère voulu. Plusieurs voies existent actuellement pour effectuer la synthèse sélective d'énantiomères, l'une d'entre elles étant la synthèse asymétrique absolue. Complexe à mettre en oeuvre et d'un faible rendement, elle restait jusqu'à présent peu satisfaisante. Une nouvelle approche vient d'être proposée par des chercheurs de l'Institut des sciences moléculaires (CNRS/Universités Bordeaux 1 et 4/ENSCBP Bordeaux) et une équipe de l’Université de Harvard. Ces travaux, pour lesquels un brevet a également été déposé, font l'objet d’un « Hot Paper » dans la revue Angewandte Chemie et ouvrent de très intéressantes perspectives tant académiques qu'industrielles.
La synthèse chirale ou asymétrique
Histoire et enjeux
Les mains, les chaussures, les coquilles d'escargot, certaines plantes…sont des objets chiraux : leur structure n'est pas superposable à leur image dans un miroir. Une molécule est chirale si elle possède deux formes énantiomères dont toutes les propriétés physico-chimiques sont identiques (masse, point de fusion, solubilité…), la seule différence étant qu'elles font tourner la lumière polarisée de manière opposée. En 1848, Pasteur a réussi à séparer les deux énantiomères d'un composé chimique en triant à la main les cristaux montrant cette dissymétrie. Une réaction chimique pour produire une molécule chirale conduit habituellement aux deux énantiomères qu'il est ensuite très difficile de séparer. Par contre, la nature sait parfaitement synthétiser seulement l'une des deux formes énantiomériques d'une molécule, comme dans le cas des sucres ou des acides aminés et l'origine exacte de cette homochiralité reste encore un mystère. Par conséquent, beaucoup de fonctions physiologiques (perception des odeurs, métabolisme etc.) reposent sur la reconnaissance spécifique d'un seul des deux énantiomères. Les propriétés pharmaceutiques de deux énantiomères peuvent être ainsi être très différentes, l'un pouvant être toxique, l'autre présentant des effets bénéfiques. On comprend donc que dans le passé beaucoup d'efforts aient été faits par des scientifiques pour briser la symétrie habituelle des réactions chimiques (des travaux récompensés par le prix Nobel de chimie de 2001) et pour développer des approches permettant la synthèse sélective d'énantiomères.
Les approches
Actuellement, trois approches complémentaires sont utilisées. La première fait appel à des réactifs naturels qui sont déjà énantiopurs (ils ne comportent qu'un seul énantiomère) et qui peuvent être modifiés tout en préservant leur chiralité. La deuxième voie consiste à utiliser des catalyseurs chiraux (soit naturels tels que les enzymes, soit artificiels) qui aident à diriger la synthèse chimique vers l'un des deux énantiomères. Enfin la troisième utilise des phénomènes physiques tels que la lumière polarisée ou des champs magnétiques pour favoriser la formation d'un énantiomère. Cette voie, appelée synthèse asymétrique absolue, est restée jusqu'à présent un sujet purement académique, en raison notamment de la complexité de la mise en oeuvre des expériences et des rendements énantiomériques souvent faibles.
Une nouvelle voie
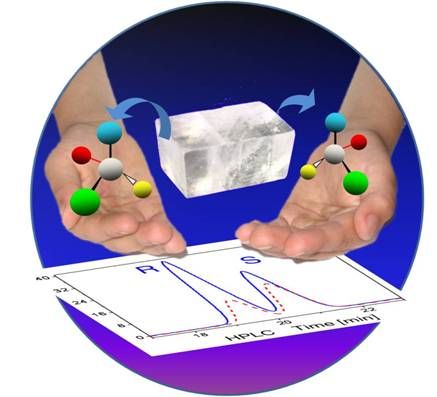
Le groupe Nanosystèmes analytiques de l'Institut des sciences moléculaires et leurs collègues américains viennent de proposer une approche originale de synthèse asymétrique absolue. Ils ont réalisé, pour la première fois, la synthèse d'un alcool chiral en exploitant uniquement l'orientation relative dans l'espace des réactifs pour générer un excès énantiomèrique, sans faire appel donc à une information chirale d'origine biologique ou chimique. Leur travail repose sur l'utilisation de monocristaux du précurseur de la molécule chirale (communément appelé "prochiral"). Ces molécules, parfaitement organisées et orientées à l'intérieur du cristal, sont exposées à une solution contenant un deuxième réactif. Suivant la face du cristal impliquée dans la réaction (les autres faces étant protégées par un polymère), la molécule prochirale ne réagit pas du même côté, conduisant ainsi préférentiellement à l'un des deux énantiomères. Bien que la sélectivité ne soit pas encore effective à 100%, cette méthode donne un des meilleurs excès énantiomériques comparé aux autres approches de synthèse asymétrique absolue.
Le monocristal au milieu contient le précurseur et suivant la face du cristal impliquée dans la réaction l’un (R) ou l’autre (S) des deux énantiomères est généré préférentiellement comme illustré par l’analyse chromatographique au-dessous.
Il est donc envisageable qu'après optimisation, cette procédure, pour laquelle un brevet a été déposé, puisse être utilisée à des fins industrielles car plus de 200 000 molécules organiques se prêtent théoriquement à l'utilisation de cette approche. Tous les secteurs industriels faisant appel à des produits chiraux sont potentiellement concernés par ces travaux : ceux qui concernent les produits pharmaceutiques mais également la production de parfums (la perception des odeurs se fait par des récepteurs énantiosélectifs), ou de phéromones utilisés parfois pour combattre ou piéger certains insectes, etc...
Les perspectives
De manière plus générale ces résultats ouvrent aussi la porte vers une nouvelle branche de la chimie où, au-delà de la génération sélective d’un énantiomère, une maîtrise de l'orientation spatiale de réactifs permettrait de contrôler la nature du produit d'une réaction chimique. Last but not least, ils apportent des éléments nouveaux à la discussion sur l’origine de l'homochiralité sur la terre.
Références
[1] Absolute asymmetric reduction based on the relative orientation of achiral reactants ; A. Kuhn, P. Fischer ; Angew.Chem.Int.Ed. 2009, 48, 6857.