Le processus de solvatation est un phénomène physico-chimique observé lors de la dissolution d'un composé chimique dans un solvant liquide. Les espèces dissoutes sont entourées par des molécules de solvant qui ont une affinité pour elles. Comprendre comment ces molécules de solvant interagissent avec l'espèce dissoute est essentiel pour prédire la réactivité chimique des molécules solvatées.
Présentation
Des chercheurs du laboratoire de Chimie Physique (CNRS/Université Paris-Sud 11, Orsay) viennent de montrer que, contrairement à toute attente, la vitesse de la solvatation dans un solvant, en l’occurrence le glycérol, n’est pas directement liée à la viscosité mais dépend fortement de la structure moléculaire du solvant.
Protocole d'étude
Une étude dynamique
En solution, les molécules du solvant jouent un grand rôle dans la réactivité chimique. Certaines réactions sont contrôlées par l’organisation des molécules de solvant autour des réactants. Il est donc important de comprendre comment ces molécules s’organisent. L’état solvaté d’un ion ou d’une molécule est un état d’équilibre, pour lequel les molécules de solvants s’orientent de manière à ce que la molécule ou l’ion soit stabilisé. L’étude de la dynamique de solvatation consiste à établir comment et en combien de temps une molécule ou un ion se solvate. Pour mener ce genre d’étude, il faudrait pouvoir suivre en direct le processus de la solvatation.
L'électron solvaté
Étant donné que l’on peut produire un électron en excès dans quasiment tous les solvants et à toutes les températures, il constitue une bonne sonde pour suivre cette dynamique dans des solvants variés et à diverses températures. En effet, l’électron en excès « change de couleur » tout au long du processus de la solvatation, c’est-à-dire que son spectre d’absorption se modifie. Une fois la solvatation achevée, son spectre d’absorption ne change plus, seule son intensité diminue. En effet, l’électron solvaté est une espèce très réactive qui disparaît par réactions avec d’autres espèces présentes dans le milieu. La solvatation de cet électron est très rapide, à l’échelle de la femtoseconde (10-15 seconde) ou de la picoseconde (10-12 seconde). La mesure du temps nécessaire pour que la stabilisation du spectre d’absorption de l’électron ait lieu nous informe sur le temps de solvatation.
Temps de relaxation
Le modèle standard souvent utilisé pour rationaliser le temps de solvatation est basé sur les différents temps de relaxation propres à chaque solvant qui sont en partie liés à la viscosité du solvant. Une série d’expériences avec 4 alcools de viscosités différentes, éthylène glycol (1,2-éthanediol), 1,2-propanediol, 1,3-propanediol et glycérol (1,2,3-propanetriol), a été effectuée au laboratoire de Chimie physique à Orsay. La technique de spectroscopie d’absorption femtoseconde a été utilisée pour suivre la variation de couleur de l'électron en fonction du temps dans ces solvants.
Résultats
Contrairement à toute attente, les chercheurs ont constaté que la solvatation de l’électron en excès s’achève plus rapidement dans le solvant le plus visqueux, le glycérol. (voir figure 1).
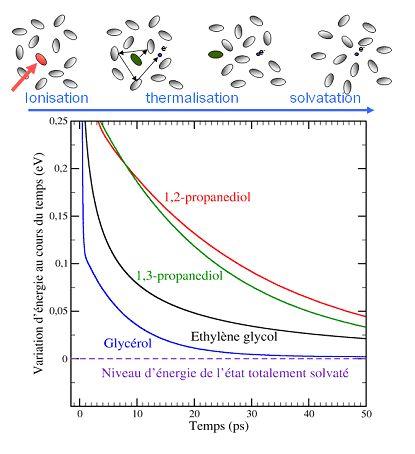
La viscosité du solvant n'est donc pas le facteur limitant pour ce processus, et un modèle alternatif est nécessaire pour interpréter ces résultats. Il apparaît que la vitesse de solvatation est fortement corrélée avec la densité locale de groupements -OH dans le solvant. Le modèle suggère que, le solvant étant en fluctuation permanente, la probabilité de formation des cavités hôtes pour l’électron est plus grande quand la densité de groupement -OH est élevée. En fait, la cavité hôte doit être formée par des dipôles des groupements -OH. Chaque molécule de glycérol possède trois groupes -OH, au lieu de deux pour les autres solvants étudiés. C’est ainsi que le glycérol, malgré sa grande viscosité, présente une plus grande densité de cavités préformées et solvate l’électron plus rapidement que les trois autres alcools.
Références
[1] LIAISONS INTERMOLECULAIRES. Les forces en jeu dans la matière condensée, A. Gerschel, EDP Sciences Editions, 1995. Cet ouvrage est consultable en ligne via GoogleBooks.
[2] Solvation dynamics of electron produced by two-photon ionization of liquid polyols. III. Glycerol. ; Bonin, J., Lampre, I., Pernot, P. & Mostafavi, M. ; J. Phys. Chem. A 2008, 112,1881.
[3] Formation and solvation dynamics of electrons in polyols. ; Lampre, I., Bonin, J., Pernot, P. & Mostafavi, M. ; J. Mol. Liq. 2008, 141, 124.
[4] Comparison of solvation dynamics of electrons in four polyols. ; Lampre, I., Pernot, P., Bonin, J. & Mostafavi, M. ; Radiat. Phys. Chem. 2008, 77, 1183.





