Dès 1853, Dubrunfaut propose d'utiliser la dialyse (sans la nommer) pour séparer industriellement les sels de potassium (chlorure et nitrate) du saccharose des mélasses dont ils gênent la cristallisation ; la membrane utilisée était en parchemin et cet auteur montre que le saccharose traverse cinq fois moins vite que le chlorure de potassium. C'est en 1861 que Graham utilise plus largement ce procédé et lui donne le nom de dialyse ...
Un peu d'histoire...
Dès 1853, Dubrunfaut propose d'utiliser la dialyse (sans la nommer) pour séparer industriellement les sels de potassium (chlorure et nitrate) du saccharose des mélasses dont ils gênent la cristallisation ; la membrane utilisée était en parchemin et cet auteur montre que le saccharose traverse cinq fois moins vite que le chlorure de potassium. C'est en 1861 que Graham utilise plus largement ce procédé et lui donne le nom de dialyse en réservant le terme de cristalloïde aux substances qui traversent la membrane et celui de colloïde pour celles qui ne la traversent pas.
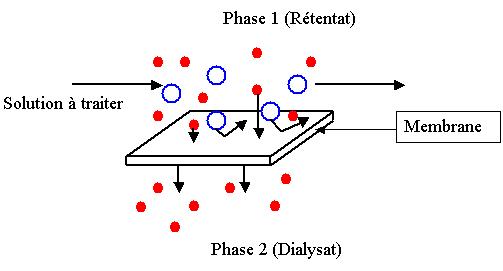
Dans l'appareil utilisé à l'origine, la solution à dialyser est séparée du liquide « accepteur » appelé dialysat par une membrane qui, à l'époque, était en parchemin (papier traité à l'acide sulfurique puis lavé). Les petites molécules et les ions traversent la membrane en fonction de leur taille. Par la suite, des noms différents furent proposés pour la solution à dialyser et le dialysat. En effet, la solution à dialyser est généralement appelée rétentat, pour bien indiquer qu'il y a des molécules qui ne traversent pas la membrane et sont retenues. Le côté opposé, classiquement dénommé dialysat, porte aussi le nom de diffusat, plus rarement celui de perfusat ou de perméat et, parfois, liquide de contre-dialyse dans le cas de certains automates d'analyse.
Si la dialyse fut utilisée à l'origine par les chimistes avec Thomas Graham qui utilise du parchemin végétal comme membrane semi-perméable pour mettre au point les prototypes de ce qui va devenir le rein artificiel (en 1861, il parvient à faire passer l'urée contenue dans de l'urine vers de l'eau au travers de cette membrane, et en profite pour inventer le terme de "dialyse") et les biochimistes pour purifier les solutions protéiques et les débarrasser des ions minéraux du tampon[1] ou des réactifs de relargage[2], elle doit incontestablement son essor aux travaux de Kolff qui, en 1943, rédige un article sur l'épuration extrarénale et le premier rein artificiel faisant appel à une membrane de cellulose.
Dialyse et autres techniques
La dialyse est donc un procédé de séparation par membrane des molécules ou des ions en solution au même titre que l'osmose inverse et l'électrodialyse. Ces techniques diffèrent par la force utilisée pour que les espèces chimiques ou les ions puissent traverser la membrane semi-perméable, c'est-à-dire la barrière relativement mince séparant deux milieux liquides.
Ces forces sont :
-
un gradient de pression dans l'osmose inverse, l'ultrafiltration, la nanofiltration et la microfiltration, ou encore un gradient de pression partielle lors de la diffusion des gaz à travers une membrane poreuse (perméation gazeuse) ;
-
un gradient de potentiel électrique dans l'électrodialyse ;
-
et enfin un gradient de concentration dans la dialyse et l'hémodialyse.
Les critères de sélection d'un procédé dépendent des caractéristiques des substances à séparer, de celles de la membrane (dimensions, forme, nature chimique, état physique, charge électrique) et des conditions hydrodynamiques de travail.
Le procédé d'osmose inverse utilise une membrane semi-perméable afin de séparer les solides dissous, la matière organique, les virus et bactéries de l'eau. Le procédé est dit "inverse" car il nécessite une pression suffisante pour 'forcer' l'eau pure à passer à travers la membrane. Ce procédé abouti à de très bons résultats, car il peut éliminer de 95 à 99 % des particules solides dissoutes et 99% des micro-organismes.
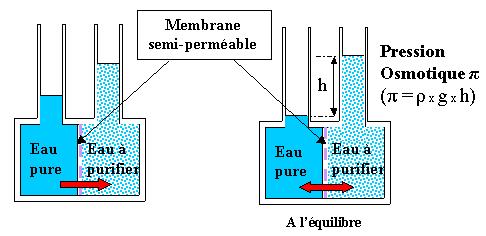
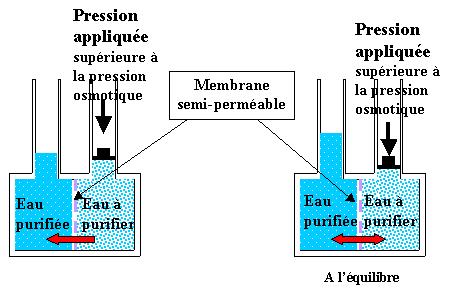
La nanofiltration est une technique membranaire relativement récente qui couvre un domaine de séparation intermédiaire entre l'ultrafiltration et l'osmose inverse dans la famille des procédés à membranes sous pression.
Les capacités de séparation de cette technique se situent :
-
pour les composés organiques, dans une gamme de poids moléculaire allant de 200 à 600 daltons[3],
-
pour les sels minéraux, dans une forte rétention globale des espèces ioniques à de faibles concentrations, et dans une séparation entre mono et multivalents pour des concentrations élevées.
Les nanofiltres sont mis en oeuvre selon le principe de la filtration tangentielle avec un transfert de matière à travers la membrane dû à un gradient de pression pouvant varier de 10 à 40 bars. La couche active de ces nanofiltres est constituée d'un matériau organique ou inorganique présentant une structure microporeuse avec des diamètres de pores de l'ordre du nanomètre.
Mis au point initialement pour la séparation en milieu liquide les nanofiltres sont maintenant considérés comme offrant des possibilités d'application intéressantes dans la séparation des gaz, ou les réacteurs catalytiques à membranes.
L'ultrafiltration est un procédé de séparation physique utilisant une membrane. Elle s'applique à la séparation de particules de 0,005 à 0,1 µm.La séparation de particules plus petites fait appel à la nanofiltration ou à l'osmose inverse. La migration des produits d'un coté à l'autre de la membrane est obtenue par une différence de pression. La filtration est généralement de type tangentielle, c'est à dire que le fluide circule parallèlement à la membrane, contrairement à la filtration classique qui est dite frontale. La filtration tangentielle permet de limiter l'accumulation de dépôts qui obturent la surface de filtration.
Les applications de l'osmose inverse concernent surtout le traitement des eaux et la concentration des solutions :
-
dessalement des eaux saumâtres pour produire de l'eau potable,
-
préparation d'eau ultrapure pour l'électronique et la pharmacie,
-
concentration de jus de fruits, antibiotiques, acides aminés.
Située entre l'osmose inverse et l'ultrafiltration, la nanofiltration concerne :
-
l'adoucissement des eaux de surface ou souterraines,
-
la déminéralisation du lactosérum et la préparation des acides aminés et peptides,
-
le traitement des effluents dans l'industrie du papier, du bois, de la teinture.
L'ultrafiltration permet de concentrer les solutions macromoléculaires en ne laissant passer que le solvant et les solutés de faible masse molaire :
-
clarification et désinfection des eaux potables,
-
concentration des protéines de lactosérum,
-
séparation d'émulsions huile-eau,
-
traitement des bains de peinture.
La principale utilisation de la microfiltration est la clarification des eaux, des liquides alimentaires et biologiques.
Techniques électromembranaires
Les techniques électromembranaires voient depuis quelques années leur champ d'applications potentielles s'élargir de façon importante. Ceci s'explique par l'apparition sur le marché de nouvelles générations de membranes, notamment anioniques et bipolaires, présentant une résistance chimique améliorée. Ces techniques sont aujourd'hui au nombre de trois :
-
L'électrodialyse dite conventionnelle
Le terme dialyse désigne la diffusion d'un soluté à travers une membrane qui lui est perméable ; l'électrodialyse désigne le transfert d'ions à travers une membrane qui leur est perméable sous l'effet d'un champ électrique.
-
L'électrodialyse à membranes bipolaires
Les membranes bipolaires sont constituées d'une face perméable aux anions et d'une face perméable aux cations. Sous l'effet d'un champ électrique, l'eau présente au coeur de la membrane est dissociée en ions H+ et OH- générés respectivement par les faces cationiques et anioniques. On peut ainsi dissocier un sel en l'acide et la base correspondante.
-
L'électrodialyse à membranes
L'électrolyse à membranes est la technique électromembranaire dans laquelle on couple les effets d'une électrodialyse (migration d'ions au travers d'une membrane semi-perméable) à ceux d'une électrolyse (réactions aux électrodes).
Le point commun de ces techniques est la mise en oeuvre de membranes échangeuses d'ions permettant de transférer des ions de façon sélective sous l'effet d'un champ électrique.
Ces techniques d'électrodialyse ont deux types d'applications principales : le dessalement des eaux saumâtres dont le taux de salinité est inférieur à 500 mg.L-1 (au dessus de ce taux, l'osmose inverse est plus intéressante) et le traitement des sous-produits de l'industrie laitière : les principaux produits concernés sont les lactosérums, résultant de la production de fromage et de caséine. Dans l'industrie chimique, de nombreuses applications innovantes sont à l'épreuve. L'électrodialyse est bien placée pour purifier des composés non ionisés par élimination d'électrolytes.
Les sels dissous dans l'eau sont ionisés, c'est-à-dire constitués par des atomes qui, au lieu d'être neutre, sont porteurs d'une charge positive ou négative. Par exemple, le sel de cuisine (NaCl), lorsqu'il est dissout, donne dans l'eau des ions positifs de sodium (Na+) et des ions négatifs de chlore (Cl-). L'électrodialyse est une technique de séparation membranaire qui impose un courant continu à deux électrodes plongées dans une solution de sel ou dans l'eau pour déplacer des ions, les cations ( ions positifs comme le sodium Na+ par exemple) vers la cathode (électrode négative) et les anions (chlorure Cl- par exemple, de charge négative) vers l'anode (électrode positive). Si on considère un ion quelconque, il se déplacera sous l'effet d'un champ électrique proportionnellement au gradient de potentiel électrique, à sa valence[4] et à sa mobilité[5]. De mobilité différente selon leur taille, leur concentration, leur charge, leur encombrement et selon la température de l'eau, les ions ne migrent pas de la même façon à travers les membranes. Les nitrates, chlorures et ions monovalents sont très bien éliminés alors que les sulfates passent difficilement.
Dans l'électrodialyse, des membranes filtrantes imperméables pour les cations ou pour les anions, sont interposés alternativement entre les électrodes. La membrane qui laisse passer les cations a la propriété d'arrêter les anions ; celle qui est imperméable aux anions oppose une barrière infranchissable aux cations. Le module peut être considéré comme une succession de résistances montées en série. Dans certains compartiments de la cuve, on peut donc collecter les ions retenus par chacune de ces deux membranes. Ainsi, des cellules où l'eau contient une concentration de sel alternent avec d'autres où l'eau a été dessalée.
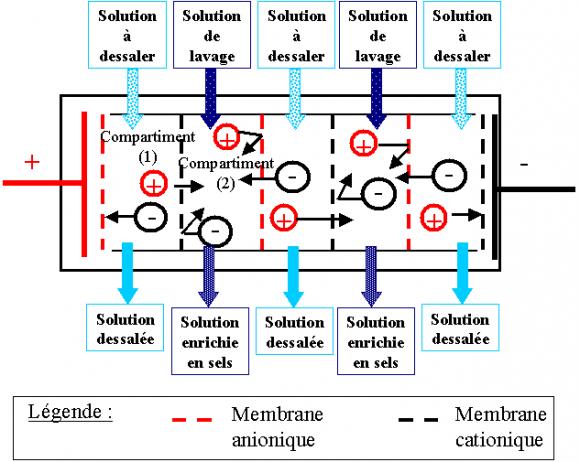
En fait, l'électrodialyse a été surtout envisagée jusqu'ici pour le dessalement d'eaux saumâtres pour la production d'eau potable (notamment en Libye), et pour l'épuration des eaux résiduaires de salinité supérieure à 0.4 g.L-1 Cette technique n'est pas adaptée pour le traitement des eaux de salinité supérieure à 3 g.L-1 ce qui l'exclut le plus souvent pour le dessalement de l'eau de mer. L'électrodialyse constitue une voie alternative au traitement biologique et aux résines échangeuses d'ions pour dénitrater l'eau potable. Elle est aussi utilisée pour défluorer l'eau potable.
Deux types de membranes sont utilisées en électrodialyse. Les premières éliminent tous les types de sels ; les secondes, dites « monovalentes », sont traversées préférentiellement par les ions monovalents. Dans le cas de la dénitratation, ces dernières éliminent le sodium tout en éliminant moins d'autres ions. Ces membranes en plastique sont mises en oeuvre dans un système de type filtre presse.
Un électrodialyseur fonctionne de la manière suivante (voir figure 4): deux compartiments (1) et (2) sont séparés par des membranes alternativement anioniques et cationiques. Comme leur nom l'indique, sous l'action d'un champs électrique, les premières ne se laissent franchir que par des anions, les secondes par des cations. Les cations migrent dans le sens du courant électrique. Ils peuvent sortir du compartiment en traversant la membrane cationique, mais il ne peuvent pas sortir du compartiment (2), car ils trouvent sur leur chemin une membrane anionique. Les anions migrent dans le sens inverse du courant électrique. ils peuvent eux aussi sortir du compartiment (1) en traversant la membrane anionique, mais ils ne peuvent pas sortir du compartiment (2) car la membrane cationique les en empêche. En conséquence, le compartiment (1) s'appauvrit en sel dissous: on l'appelle compartiment de dilution. le compartiment (2) s'enrichit en sels dissous: on l'appelle compartiment de concentration. La concentration des substances dissoutes non ionisées n'est pas modifiée.
Un électrodialyseur est constitué d'un grand nombre de compartiments alimentés en série du point de vue électrique, et en série ou en parallèle du point de vue hydraulique. Un compartiment sur deux est en dilution, un sur deux en concentration. Aux deux extrémités de l'appareil, se trouvent les électrodes, qui permettent le passage du courant électrique. Les membranes délimitant les compartiments sont alternativement anioniques et cationiques.
L'électrodialyse est employée soit en déminéralisation (dessalement), soit en concentration ionique de solutions ionisées. En galvanoplastie, elle sert au traitement d'effluents (eau de rinçage) afin d'enrichir, en les concentrant, les bains de dépôt et de les recycler.
Bibliographie
- Numéro spécial de Science et Vie sur l'eau, N°211, Juin 2000.
- Les applications innovantes des techniques membranaires dans l'industrie, Novelect - CFE - Guides de l'Innovation - Ref. 602, Collectif.
- Douchy, Thébault P., Bersillon J.L., Les membranes de l'eau potable. L'eau claire pour l'an 2000, T.S.M. L'EAU, 85ème année, N°5.
[1] Un tampon est une solution aqueuse ajoutée au milieu réactionnel pour limiter les fluctuation de la force ionique et du pH. Elle est composée d'ions minéraux divers selon l'usage du tampon
[2] Réactifs utilisés pour extraire les protéines de leur matrice d'origine.
[3] Le dalton, de symbole Da, est la douzième partie de la masse d'un atome de carbone 12C. D'où 1 g vaut NA daltons, soit 6,02.1023 daltons.
[4] La valence d'un atome fixe de façon précise le nombre d'atomes auquel cet atome peut se lier... Pour être plus clair, si un atome a une valence de 1, il ne pourra se lier qu'à un seul atome. Si sa valence est de 4, il pourra se lier au maximum avec 4 atomes, etc. On qualifiera chaque atome de monovalent, divalent, trivalent ou tétravalent.
[5] Un ion de charge e, placé dans un champ électrique E, en solution diluée, acquiert une vitesse limite v0 du fait des forces de freinage dues à la viscosité du milieu. Le rapport u = v0 / E est appelé mobilité ionique (m2.V-1.s-1). Les valeurs de mobilité s'échelonnent entre 2.10-8 et 10.10-8 m2.V-1.s-1 à l'exception des ions HO- (20.10-8 m2.V-1.s-1) et des ions oxonium H3O+ (36.10-8 m2.V-1.s-1).