Il existe plusieurs voies de synthèses pour obtenir des nanoparticules d'or. Les produits obtenus n'ont pas la même géométrie ni les mêmes propriétés, d'où l'intérêt de la pluralité de ces méthodes.
Le lecteur est invité à lire au préalable le 1er article du dossier qui présente les propriétés des nanoparticules d'or de façon générale.
Généralités sur les synthèses de nanoparticules en solution
Synthétiser des nanoparticules n’est pas trivial ! Il existe plusieurs techniques de synthèse très différentes. On différencie la méthode dite ascendante (« bottom-up ») et la méthode descendante (« top-down »). La méthode ascendante consiste à construire les nano-objets atome par atome, molécule par molécule ou agrégat par agrégat. L’assemblage des atomes, des molécules ou des agrégats s’effectue de façon précise et contrôlée, permettant ainsi l’élaboration de matériaux dont la structure est complètement maîtrisée. La méthode descendante consiste à miniaturiser des objets déjà existants de taille micro ou macrométrique pour se rapprocher des dimensions nanométriques. Ces deux méthodes permettent d’obtenir des nanoparticules, cependant, la méthode ascendante est la technique favorisée par les chimistes car elle permet un bien meilleur contrôle de l’architecture et des tailles de nanoparticules synthétisées.
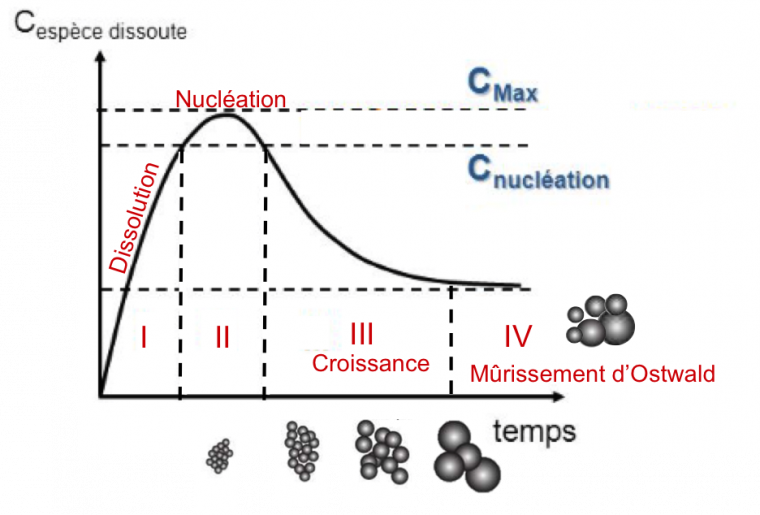
Les synthèses de nanoparticules en phase liquide mettent en jeu des techniques dites ascendantes, couramment utilisées aujourd’hui. Elles consistent, tout d’abord, à former des germes solides puis, par la suite, réussir à contrôler leur croissance. Le diagramme de La Mer (Figure 1) illustre le processus de nucléation et de croissance [3]. Dans une première partie (étape I), l’ion métallique sera réduit pour former un précurseur du solide qui est initialement dissout dans la solution. Cette concentration en espèces dissoutes va augmenter au cours du temps jusqu’à atteindre une concentration critique, concentration de nucléation, qui correspond à la concentration minimale à partir de laquelle les premiers agrégats solides vont pouvoir se former. L’étape II correspond à l’étape de nucléation. La sursaturation en espèces dissoutes entraîne la formation de germes aussi appelés nucléi, nanoparticules très petites de 1 à 2 nm. En dessous de cette concentration de nucléation, les nucléi ne peuvent pas se former. L’étape III est la croissance des germes. Au cours de cette étape, les espèces dissoutes vont faire grossir les germes sans en créer de nouveaux. Dans un dernier temps, il peut se produire une étape indésirable appelée mûrissement d’Ostwald, qui correspond à l’agrégation de particules entre elles. Cette dernière étape entraîne un grossissement inhomogène des nanoparticules et ces dernières auront alors toutes des tailles différentes. Afin d’obtenir des nanoparticules uniformes en taille, il est nécessaire de bien séparer les étapes de nucléation et de croissance. L’étape de nucléation doit être brève et l’étape de croissance doit être bien contrôlée afin que toutes les particules grossissent simultanément.
Synthèse de nanoparticules d’or sphériques
Les trois points-clés
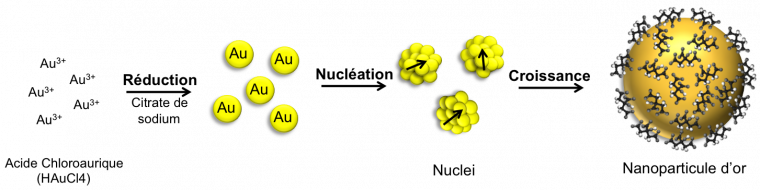
Les propriétés physiques des nanoparticules d’or dépendent très fortement de leur taille, de leur forme ainsi que de la nature des ligands qui les entourent et permettent leur stabilité colloïdale. Il est donc essentiel de contrôler tous ces paramètres lors de leur synthèse. Il existe de nombreuses synthèses en solution aqueuse ou organique. Chacune d’elles repose généralement sur trois points-clés :
- L’utilisation d’un précurseur d’or : en général un sel ou un complexe d’or, au degré d’oxydation Au(III);
- La réduction de l’or Au(III) pour obtenir de l’or métallique au degré d’oxydation zéro Au(0);
- L’utilisation d’un stabilisant qui va contrôler la taille des particules et aussi assurer leur stabilité.
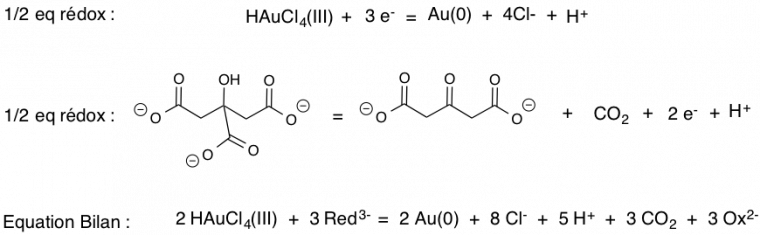
Les stabilisants utilisés peuvent être de différentes natures : ce sont de petits édifices chargés permettant alors une stabilisation électrostatique une fois adsorbés à la surface des particules, soit ce sont de grosses molécules telles que des polymères permettant des répulsions stériques entre les nanoparticules. En fonction des synthèses, le réducteur, le stabilisant et les conditions de réaction peuvent varier. Dans cet article, nous allons détailler la synthèse dite « de Turkevich » [4], car c’est une synthèse très simple à mettre en œuvre et très reproductible. Il est possible de faire cette expérience au sein d’un lycée par exemple. Cette méthode est basée sur la réduction par le citrate de sodium (2e demi-équation électronique de la Figure 3) d’un sel d’Au(III) : HAuCl4, l’acide tétrachloroaurique. Au cours de cette synthèse, le citrate de sodium sert à la fois de réducteur et de stabilisant. En tant que stabilisant, il enrobe les particules d’or, ce qui permet de bloquer la croissance des nanoparticules après la phase de germination et ainsi de contrôler la taille des particules et d’empêcher la formation d’agrégats.
Protocole
Chauffer à reflux une solution aqueuse de 20 mL de HAuCl4 à 0,25 mmol·L-1 tout en agitant vivement. Lors de l’ébullition, ajouter en une seule fois 1 mL de solution de citrate de sodium à 1,7×10−2 mol·L-1 et laisser sous agitation environ 20 min en maintenant le chauffage. La solution devient grise, puis violette et enfin elle prend une couleur rouge-rubis. Laisser ensuite la solution refroidir à température ambiante. Les couleurs grise et violette correspondent à la formation de particules intermédiaires d’une grande variété de tailles et de formes. L’équation de la réaction mise en jeu lors de la synthèse est représenté sur la Figure 3.
Red3- et Ox2- désignent respectivement le réducteur et l'oxydant du couple oxydo-réducteur du citrate de sodium.
Attention : avant de commencer la synthèse de nanoparticules d’or, il faut nettoyer précautionneusement l’ensemble de la verrerie. Une méthode efficace est de tout laver à l’eau régale (mélange de solutions concentrées d'acide nitrique HNO3 à 70% et d'acide chlorhydrique HCl à 37%) et cela doit se faire sous hotte avec des gants. Il faut ensuite rincer abondamment la verrerie avec de l’eau distillée très pure.
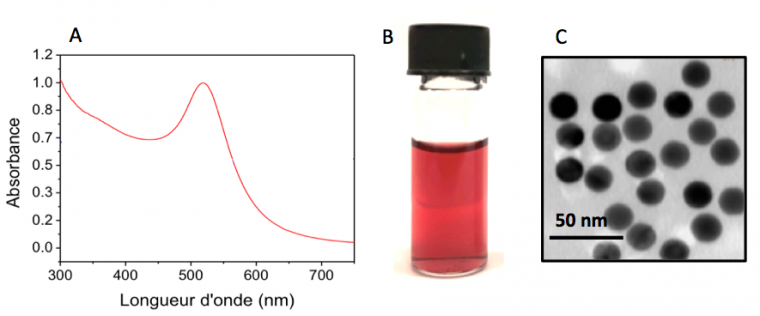
Avec cette synthèse, les particules d’or synthétisées sont d’environ 15 nm de diamètre comme observé sur la Figure 4. La concentration finale en particules est de 2,0×10−9 mol·L−1, le nombre moyen de nanoparticules dans un bécher de 20 mL est d’environ 2 400 milliards et le nombre moyen d’atomes d’or dans une particule est de 110 000. Au cours de cette synthèse de Turkevich, la quantité de citrate de sodium utilisée est très importante pour contrôler la taille des particules. En effet, si on recommence la même synthèse en ne mettant que 0,25 mL de solution de citrate de sodium (au lieu de 1 mL) à 1,7×10−2 mol·L−1, il est possible d’obtenir des particules plus grandes, avec un diamètre de l’ordre de 50-60 nm. Cela peut être observé en microscopie électronique à transmission mais aussi avec un simple spectre d’absorption car le pic de résonance plasmonique sera cette fois-ci autour de 545 nm. Plus la taille des particules diminue, plus leur surface spécifique1 augmente. Par conséquent, puisque l'ion citrate joue le rôle de stabilisant, une diminution de sa quantité entraîne la formation de particules de taille plus élevée.
Synthèse de nanobâtonnets d’or
Propriétés des nanobâtonnets d'or
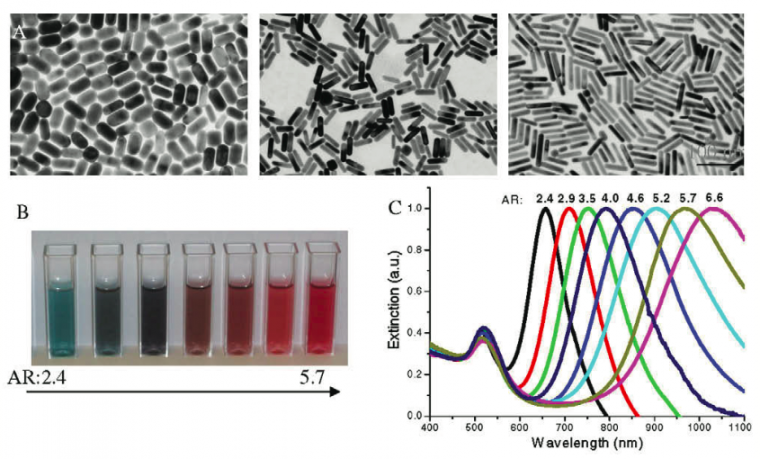
Les seconds nanomatériaux présentés dans cet article sont des nanobâtonnets d’or dont certaines structures sont représentées en Figure 5. Ces nanobâtonnets sont de plus en plus étudiés dans le domaine de la recherche biomédicale car la synthèse est relativement facile et ils peuvent être fonctionnalisés pour l’imagerie ou la délivrance de médicaments. Par ailleurs, ces nanoparticules peuvent aussi être utilisées pour détruire les cellules cancéreuses par photothermie comme présenté dans la troisième partie de cet article.
Contrairement aux nanosphères d’or, les nanobâtonnets, qui sont des particules anisotropes, présentent deux résonances plasmoniques. En effet, il y a deux résonances observables : l’absorbance plasmonique transversale (vers 520 nm) et l’absorbance plasmonique longitudinale. Cette dernière est modulable en fonction du ratio longueur/largeur des nanobâtonnets.
D'après Stephan Link, MB Mohamed, and MA El-Sayed. Simulation of the optical absorption spectra of gold nanorods as a function of their aspect ratio and the effect of the medium dielectric constant. The Journal of Physical Chemistry B, 103(16):3073–3077, 1999.
En effet, en modifiant le ratio longueur/largeur de ces particules, il est possible de contrôler le pic plasmon longitudinal (entre 700 et 1400 nm). La longueur d’onde d’émission (λem) du pic plasmon longitudinal est reliée au ratio (AR) par la formule ci-dessous, où εm est la constante diélectrique du milieu. Dans la synthèse qui va être présentée par la suite, on peut estimer que εm est proche de la valeur 4 (contribution des différents ligands entourant les bâtonnets).
$$\lambda_{em} = (33,34 \text{AR} - 46,31)\epsilon_{m} + 472,31$$
Principe de la synthèse de nanobâtonnets d'or
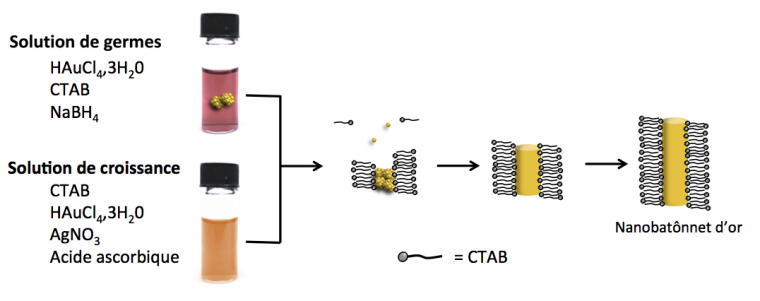
Dans la solution de formation de germes, les précurseurs d’or, des sels d’or au degré d’oxydation +III, par exemple HAuCl4,3H2O, sont réduits en Au(0) rapidement par un réducteur très fort cette fois-ci, le tétrahydruroborate de sodium (NaBH4), afin de former de petits germes d’or de 1-2 nm. Ces germes sont stabilisés en milieu aqueux par un surfactant : le bromure d’hexadécyltriméthylammonium (CTAB) possédant une tête hydrophile et une queue hydrophobe. Le CTAB forme une bicouche sur la surface des particules d’or [6]. La solution de croissance contient le même précurseur d’or qui va être réduit cette fois-ci par un réducteur plus doux : l’acide ascorbique, réduisant Au3+ en Au+. Une très faible quantité de germes est ensuite injectée dans la solution de croissance. Les germes vont catalyser la réduction de Au+ en Au(0) qui va se déposer sur les germes de façon contrôlée.
CTAB désigne le bromure d'hexadécyltriméthylammonium.
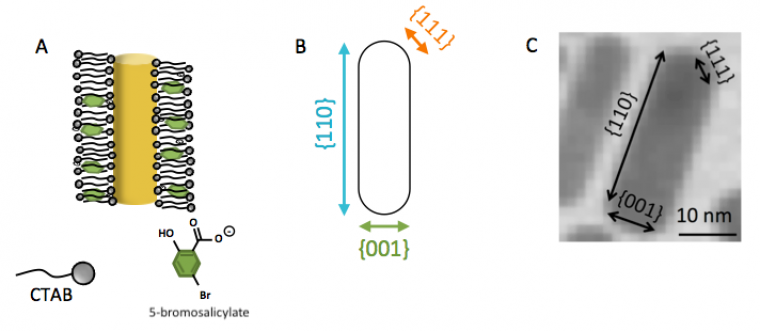
Ce contrôle s’effectue soit uniquement grâce à du nitrate d’argent (AgNO3) soit avec du nitrate d’argent et d’autres surfactants comme l’oléate de sodium ou bien avec des additifs aromatiques (comme l’acide 5- bromosalicylique, représenté Figure 7). Le mécanisme n’est pas encore très bien compris mais semblerait être le suivant : le CTAB, Ag+ et les différents surfactants se lieraient sur les surfaces de hautes énergies des particules d’or : {110} du nanocristal (voir Figure 7), ce qui ralentirait la croissance sur ces faces [7]. Les atomes d’or fraîchement réduits se déposeraient alors plutôt sur les faces {001}. Les additifs aromatiques permettraient, eux, de stabiliser la bicouche de CTAB formée autour des nanobâtonnets.
Protocole
Solution de germes : Dans un ballon ou un pilulier chauffé à 27°C à l’aide d’un bain-marie, mettre 7,5 mL d’une solution aqueuse de bromure d’hexadécyltriméthylammonium (CTAB) à 0,1 mol·L−1. Ajouter 100 μL de solution aqueuse de chlorure d’or(III) (HAuCl4.3H2O) à 25 mmol·L−1. On observe un changement de couleur du jaune à l’orange-marron brillant qui est dû à la substitution du ligand Cl− par Br− autour des ions Au3+. Sous agitation, additionner en une seule fois 600 μL d’une solution aqueuse de NaBH4 à 10 mmol·L−1 très fraichement préparée (moins de 2 min avant car NaBH4 s’hydrolyse très vite dans l’eau). Il se produit immédiatement un changement de couleur de l’orange vers le marron, dû à la précipitation de particules d’or sphériques de quelques nanomètres de diamètre, stabilisées par la bicouche de tensioactif CTAB. Laisser cette solution au bain-marie sous agitation pendant 30 min avant de l’utiliser. Attention cette suspension ne se conserve pas très bien (grossissement des germes) et doit être utilisée dans les 5 heures suivant la synthèse.
Solution de croissance : Dans un pilulier placé dans un bain-marie à 30-35°C, préparer une solution aqueuse de 10 mL de 36 g·L−1 de CTAB et 4,4 g·L−1 d’acide 5-bromosalicylique. Ajouter 9,6 mL d’eau déionisée puis 480 μL d’une solution de nitrate d’argent à 4 mmol·L−1 et attendre 15 min. Ajouter ensuite 400 μL de chlorure d’or (HAuCl4) à 25 mmol·L−1. Agiter fortement puis laisser au repos pendant une quinzaine de minutes au bain-marie à 25-30°C. Ajouter ensuite 80 μL d’une solution d’acide ascorbique à 50 mM. On constate une disparition progressive de la couleur jaune, due à la réduction des ions Au3+ en Au+ par l’acide ascorbique. Prélever 30 μL de la solution de germes, les ajouter en une seule fois dans la solution de croissance et agiter immédiatement pendant environ 20 secondes. Laisser sans agitation au bain-marie. Au bout de quelques minutes, les germes grossissent et la solution devient colorée. Laisser réagir environ 30 à 60 minutes (jusqu’à ce que la coloration ne varie plus). La suspension reste stable pendant plusieurs jours.
Cette synthèse permet d’obtenir des nanobâtonnets ayant un premier pic d’absorption vers 520 nm qui correspond à la résonance transversale et un second pic d’absorption (beaucoup plus intense) vers 800 nm qui correspond à la résonance longitudinale. Ces bâtonnets sont de longueur moyenne 13 ± 4 nm sur 50 ± 10 nm. Grâce à la première équation ci-dessous il est possible de calculer cette concentration des bâtonnets. [Bâtonnet] est la concentration en nanobâtonnets, D correspond à leur absorption à 400 nm, NA est le nombre d’Avogadro et σ(μm2) est la section efficace des bâtonnets exprimée en (μm2) (pour ces tailles σ = 5, 77×10−4 μm2). Cette concentration est à recalculer après chaque synthèse après avoir effectué un spectre d’absorption de la solution de nanobâtonnets diluée. Voici un exemple :
$$[\text{Bâtonnets}] = 10^{11}\dfrac{D\cdot\text{ln}10}{N_{A}\cdot\sigma(\mu m^{2})} = 4,1×10^{-10} \text{ mol/L } (\pm0,5×10^{-10})$$
Sachant que nous connaissons les tailles de nos particules, grâce aux deux formules suivantes nous pouvons connaître le nombre d’atomes d’Au(0) se trouvant dans un nanobâtonnet d’or : ρ est la masse volumique, V le volume et M la masse molaire.
$$n = \dfrac{\rho\cdot V}{M} = 1,05×10^{-18} \text{ mol d'Au(0) dans 1 Bâtonnet}$$
$$\text{Nombre d'atomes Au(0) par Bâtonnet} = n.N_{A} = 630 000 \text{ atomes Au(0) par Bâtonnet} $$
Autres formes de nanoparticules d’or
Il existe de très nombreuses autres synthèses de particules d’or pouvant prendre des formes très variées. En Figure 8 se trouve une image provenant d’une revue scientifique [8] référençant la majorité des formes de nanoparticules d’or synthétisées à ce jour.
D'après Erik C Dreaden, Alaaldin M Alkilany, Xiaohua Huang, Catherine J Murphy, and Mostafa A El-Sayed. The golden age: gold nanoparticles for biomedicine. Chemical Society Reviews, 41(7):2740–2779, 2012.
Bibliographie et Références
- L’or nanométrique, un agent thérapeutique, Actualité Chimique n°425, Janvier 2018.
- Bienvenue dans le monde de l’or Nanométrique ! Actualité Chimique n°425, Janvier 2018.
- Nanoparticules d’or, Technique de L’ingénieur, NM900V1, 10 Janvier 2011.
- Synthèse et détermination de la taille de nanoparticules d’or, BUP 952, Vol. 107, Mars 2013.
- Nanoparticules d'or pour la santé
- Rosamund Daw. Nanotechnologies, déjà dans l’Antiquité... Courrier Sciences, 2013.
- Victor K LaMer and Robert H Dinegar. Theory, production and mechanism of formation of monodispersed hydrosols. Journal of the American Chemical Society, 72(11):4847– 4854, 1950.
- J Kimling, M Maier, B Okenve, Vassilios Kotaidis, H Ballot, and Anton Plech. Turkevich method for gold nanoparticle synthesis revisited. The Journal of Physical Chemistry B, 110(32):15700–15707, 2006.
- Stephan Link, MB Mohamed, and MA El-Sayed. Simulation of the optical absorption spectra of gold nanorods as a function of their aspect ratio and the effect of the medium dielectric constant. The Journal of Physical Chemistry B, 103(16):3073–3077, 1999.
- Xingchen Ye, Chen Zheng, Jun Chen, Yuzhi Gao, and Christopher B Murray. Using binary surfactant mixtures to simultaneously improve the dimensional tunability and monodispersity in the seeded growth of gold nanorods. Nano letters, 13(2):765–771, 2013.
- Xingchen Ye, Linghua Jin, Humeyra Caglayan, Jun Chen, Guozhong Xing, Chen Zheng, Vicky Doan-Nguyen, Yijin Kang, Nader Engheta, Cherie R Kagan, et al. Improved size- tunable synthesis of monodisperse gold nanorods through the use of aromatic additives. ACS nano, 6(3):2804–2817, 2012.
- Erik C Dreaden, Alaaldin M Alkilany, Xiaohua Huang, Catherine J Murphy, and Mostafa A El-Sayed. The golden age: gold nanoparticles for biomedicine. Chemical Society Reviews, 41(7):2740–2779, 2012.
- Mohammad Eghtedari, Alexander Oraevsky, John A Copland, Nicholas A Kotov, Andre Conjusteau, and Massoud Motamedi. High sensitivity of in vivo detection of gold nanorods using a laser optoacoustic imaging system. Nano letters, 7(7):1914–1918, 2007.