Les principaux éléments qui constituent les molécules naturelles sont généralement présents sous forme de plusieurs isotopes stables. La différence entre les deux types d'isotopes provient du nombre de neutrons, plus élevé pour le premier, qui induit une masse atomique supérieure. L'écart de masse entre les isotopes d'un élément chimique peut être suffisant pour modifier les propriétés physiques et chimiques des molécules fabriquées à partir de différents isotopes.
Introduction
L'écart de masse entre les isotopes d'un élément chimique peut être suffisant pour modifier les propriétés physiques et chimiques des molécules fabriquées à partir de différents isotopes. C'est pourquoi l'abondance naturelle des isotopes n'est pas uniforme sur terre, que ce soit au niveau de la biosphère, des organismes vivants, des individus et des organes les constituant. Une étude approfondie des phénomènes de sélection entre isotopes aux diverses étapes d'un processus biologique, par exemple, conduit à :
-
constater une discrimination isotopique, que l'on définit comme le fractionnement isotopique,
-
définir les mécanismes chimiques et biochimiques prépondérants qui conduisent à ce fractionnement.
Ainsi au cours d'une réaction chimique, comme une catalyse enzymatique, la distribution isotopique du produit formé peut être très différente de celle du substrat de départ. En cumulant les données issues des diverses études, des modèles de fractionnements isotopiques ont été établis pour beaucoup de processus chimiques et biochimiques. A contrario, l'analyse isotopique d'un métabolite, molécule résultant du processus, d'une plante permet de révéler, dans la plupart des cas, son origine botanique, voire son origine géo-climatique. L'analyse isotopique devient alors un véritable outil d'authentification des origines.
Définitions
Isotopes
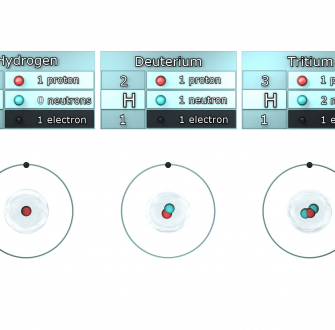
Toutes les substances sont constituées d'éléments chimiques qui sont caractérisés par le nombre de protons contenus dans leur noyau : c'est le numéro atomique de l'élément, noté Z. Pour compenser les charges électriques positives des protons, des particules chargées négativement gravitent autour du noyau : ce sont les électrons. Donc Z qualifie à la fois : le nombre de protons et le nombre d'électrons d'un atome. Le noyau comporte également un autre type de particules, électriquement neutres : les neutrons. La masse de l'atome, quasiment assurée par celle du noyau, sera donc caractérisée par son nombre de masse, noté A, qui correspond à la somme de Z protons et (A-Z) neutrons. Les atomes de même numéro atomique Z qui ne différent que par leur nombre de masse et donc leur nombre de neutrons sont appelés isotopes.
Les produits naturels impliquent principalement les isotopes majoritaires des éléments qui les constituent avec de faibles proportions d'isotopes lourds minoritaires. Seuls le cas des isotopes des éléments présents dans les molécules organiques naturelles sera traité dans cet article (hydrogène, carbone, oxygène et azote). Certains de ces isotopes sont stables et d'autres radioactifs. L'étude de la distribution isotopique ne porte, en général, que sur les isotopes stables car l'abondance naturelle des isotopes radioactifs est très inférieure. La répartition moyenne entre isotopes stables, pour les principaux éléments rencontrés dans les substances naturelles, est donnée dans le tableau 1.
| Élément | Isotopes stables | Z | A | Abondance naturelle moyenne (%) |
|---|---|---|---|---|
| Hydrogène |
1H* 2H** |
1 1 |
1 2 |
99,9844 0,0156 |
| Carbone |
12C 13C |
6 6 |
12 13 |
98,891 1,108 |
| Oxygène |
16O 17O 18O |
8 8 8 |
16 17 18 |
99,759 0,037 0,204 |
| Azote |
14N 15N |
7 7 |
14 15 |
99,635 0,365 |
* : appelé communément hydrogène, désigné par H
** : appelé communément deutérium, désigné par D
Tableau 1: Répartition moyenne des isotopes au sein des principaux éléments constituant les substances naturelles
Isotopomères
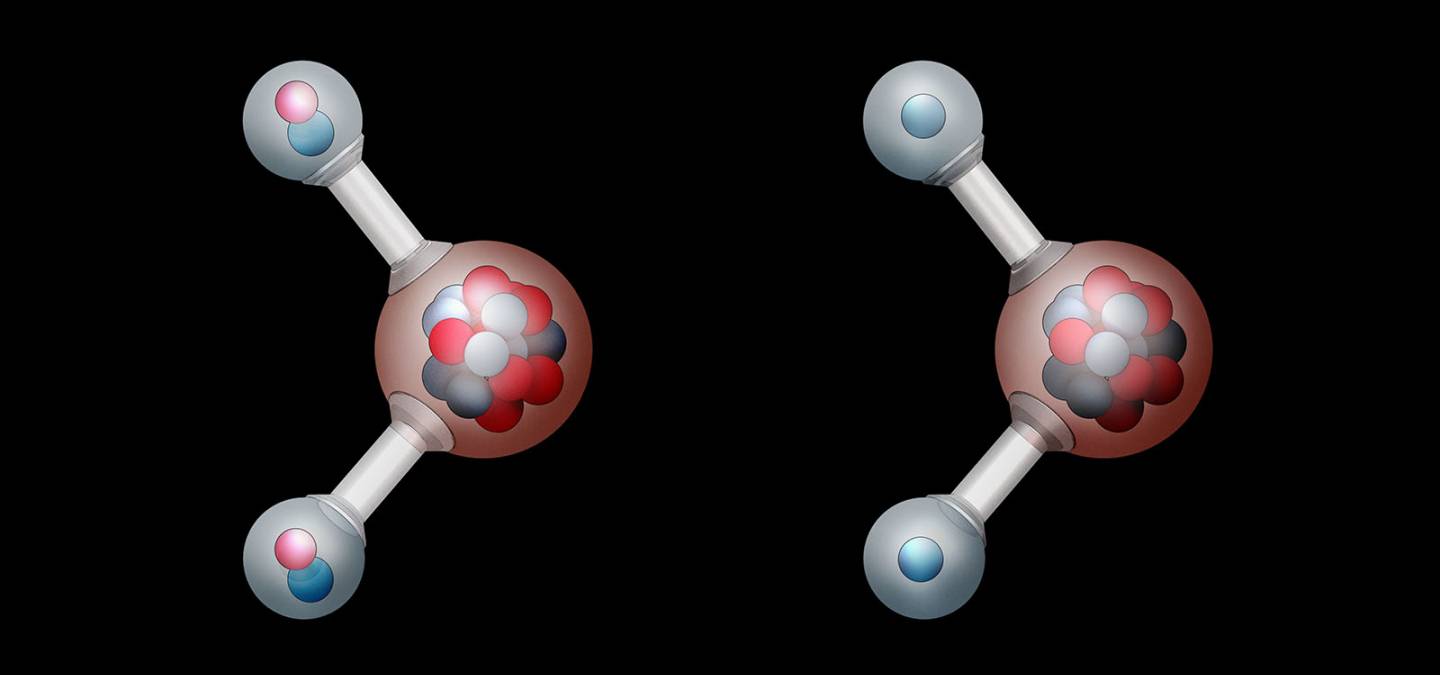
Une molécule organique naturelle peut exister sous différentes compositions isotopiques, appelées isotopomères. Du fait de l'abondance très faible des isotopes lourds, la détection d'une molécule contenant deux ou plus d'isotopes lourds du même élément est actuellement impossible. En effet, la probabilité d'observer une molécule contenant deux et a fortiori plus d'atomes lourds est extrêmement faible (pour l'hydrogène, le carbone, l'oxygène ou l'azote). Par conséquent, on restreint, dans cet article, la définition de l'isotopomère à une molécule ne possédant qu'un atome lourd. Par exemple la figure 1 représente les isotopomères de la molécule éthanol comportant un isotope lourd et stable.
Rapport et abondance isotopique
Les paramètres servant à décrire et à mesurer les phénomènes de répartition isotopique sont définis comme suit :
-
Le rapport isotopique R est égal au quotient du nombre d'isotopes lourds sur le nombre d'isotopes légers d'un élément donné : R=Lourd/Léger. Ainsi le rapport isotopique du carbone-13 est défini comme : R = 13C/12C, celui de l'hydrogène est R = D/H (ou R = 2H/1H).
-
L'abondance isotopique A, à ne pas confondre avec le nombre de masse, indique la proportion relative de l'isotope lourd considéré. C'est en quelque sorte une « fraction molaire isotopique » : A= Lourd/(Lourd+Léger). Par exemple l'abondance isotopique en carbone-13 est A = 13C/(13C+12C).
Ces deux paramètres (R et A) sont variables d'un composé à l'autre. Cependant, leur valeur peut être difficile à manier, car on observe de faibles variations sur de faibles quantités. On préfère alors exprimer cette même réalité physique à l'aide d'un troisième paramètre, quant à lui relatif, appelé déviation isotopique δ, définie comme :
δ = 1000x(Rech - Rref)/Rref (valeur en ‰)
où Rech et Rref sont respectivement les rapports isotopiques de l'échantillon à mesurer et de l'échantillon de référence.
Cette grandeur permet, en utilisant des références internationales, d'apprécier de faibles différences de teneurs isotopiques, mais aussi de réaliser une intercalibration entre appareils de mesure et entre laboratoires. Le tableau 2 rassemble les références internationales utilisées en analyse isotopique pour les principaux éléments.
| Élément | Molécule | Désignation | Origine | A* (ppm) | R** (ppm) |
|---|---|---|---|---|---|
| Carbone | CaCO3 |
PDB (Pee Dee Belemnite) |
Calcaire de la Caroline du Sud (USA) | 11123,3 |
11237,2 (±2,9) |
| Hydrogène | H2O |
V.SMOW (Vienna Standard Mean Ocean Water) |
Mélange d'eaux océaniques | 155,74 |
155,76 (±0,05) |
| Azote | N2 | Gaz azote | Azote atmosphérique | 3663 |
3676,5 (±8,1) |
| Oxygène | H2O |
V.SMOW (Vienna Standard Mean Ocean Water) |
Mélange d'eaux océaniques | 2001,2 |
2005,2 (±0,43) |
* : abondance isotopique en ppm
** : rapport isotopique en ppm
Tableau 2. Références internationales utilisées pour l'analyse isotopique
Le fractionnement isotopique
Origine
L'écart de masse entre les isotopes confère aux atomes et aux molécules des propriétés physiques et chimiques sensiblement différentes. On peut distinguer les effets isotopiques cinétiques et thermodynamiques. Les effets isotopiques cinétiques sont liés à une différence de vitesse au cours de réactions chimiques ou de phénomènes de transport. L'isotope lourd a généralement tendance à réagir plus lentement que l'isotope léger. Les effets isotopiques thermodynamiques sont en relation avec les constantes d'équilibre au cours d'équilibres chimiques ou d'équilibres de phase. Ils traduisent les différences de constante d'équilibre des isotopomères contenant des isotopes lourds de ceux contenant des isotopes légers.
Conséquences
On peut définir l'effet isotopique EI pour décrire le changement de composition isotopique, observée au cours d'une transformation d'un substrat S (composé initial) en un produit P (composé final). On exprime EI = Rs/Rp, (où Rs et Rp sont respectivement les rapports isotopiques du substrat et du produit) quand :
-
l'effet cinétique caractérise une transformation où le produit P représente un faible pourcentage par rapport au substrat S,
-
l'effet thermodynamique caractérise un équilibre entre S et P.
Pour un effet cinétique dominant, EI aura tendance à être supérieur à 1, car l'isotope lourd « restera » principalement sur le substrat (il réagit moins vite). Lorsque le processus global de transformation de l'état initial à l'état final nécessite plusieurs étapes successives, caractérisées par un fractionnement isotopique propre, le fractionnement global sera essentiellement produit par l'étape limitante.
Dans le cas d'un effet thermodynamique, si EI est inférieur à 1, le produit final sera plus riche en isotope lourd que le produit initial. Ce phénomène est, par exemple, observé pour l'équilibre entre CO2 et HCO3-, où le 13C (isotope lourd du carbone) se concentre dans HCO3- car celui-ci est plus complexe que CO2 (EI = 0,991). À l'opposé, si EI est supérieur à 1, c'est le substrat qui s'enrichit en isotope lourd, comme on a pu le mesurer pour la dissolution de CO2 dans l'eau (EI = 1,011).
Par conséquent, la détermination des rapports isotopiques des différents métabolites du monde végétal permet d'explorer les mécanismes qui produisent les effets isotopiques. Par ailleurs, des filiations ont pu être établies entre le type végétal, l'origine géo-climatique et le processus industriel qui ont conduit à la production des métabolites purs, concentrés ou en mélange.
Discrimination isotopique par élément
Le carbone
Il y a deux principales voies métaboliques d'assimilation du gaz carbonique atmosphérique par les végétaux. Par ce processus la plante fabrique, entre autres, du glucose, molécule à six atomes de carbone. Cette synthèse peut se dérouler selon plusieurs mécanismes caractérisés par le nombre d'atomes de carbone de l'intermédiaire métabolique. Ainsi, on est amené à différencier la voie passant par l'intermédiaire 3-phosphoglycérate à 3 atomes de carbone, notée C3, de celle faisant intervenir un intermédiaire malate à 4 atomes de carbone et qui sera notée C4. On parle alors de plante en C3 (la plupart) ou de plante en C4 (comme la canne à sucre ou le maïs). Pour être complet, il faut aussi évoquer un 3ème métabolisme : CAM (Crassulacean Acid Metabolism) qui est un mécanisme intermédiaire entre le C3 et le C4 et où la plante retient l'une ou l'autre des voies C3 et C4 en fonction des conditions d'environnement, dont l'hygrométrie. On peut citer par exemple l'ananas et le vanillier.
L'assimilation du CO2 se fait par l'ouverture des stomates au niveau des feuilles. Dans des conditions climatiques particulières la plante s'adapte en trouvant un équilibre entre laisser les stomates ouverts pour faire entrer le CO2 (qui est la matière première pour la synthèse du glucose) et les fermer pour éviter l'évaporation de l'eau, en cas de stress hydrique. Les voies métaboliques en C3 et C4 ne provoquent pas le même fractionnement isotopique du carbone au cours de l'assimilation du CO2 atmosphérique. Dans un modèle simple, on ne tient compte que de deux étapes principales de discrimination :
-
la diffusion du CO2 vers l'intérieur des feuilles,
-
la carboxylation.
A l'écart d'activité industrielle, le gaz carbonique atmosphérique montre une déviation isotopique moyenne constante en 13C sur toute la surface du globe, δ13C = -8 ‰. Or, le ratio entre le phénomène de diffusion (qui a un effet d'appauvrissement de l'ordre de 4,5 ‰) et la carboxylation (qui appauvrit de 27 ‰ environ) conduit à une réduction de la teneur en 13C des plantes de type C3 d'environ -20 ‰, par rapport au CO2 atmosphérique.
Pour les plantes en C4, la discrimination vis à vis du 13C est plus faible, elle n'est que de l'ordre de -3 à -4 ‰. Ceci est dû au fait que dans les plantes en C4 le CO2 est d'abord hydraté dans la solution du cytoplasme des cellules. Un équilibre s'établit alors entre le CO2 et HCO3- et comme nous l'avons mentionné, HCO3- est alors enrichi en 13C (de l'ordre de 9 ‰). De plus la carboxylation, pour ces plantes, n'a pas un effet isotopique aussi fort que dans les plantes en C3.
En résumé, les plantes à métabolisme photosynthétique de type C3 (comme la vigne ou la betterave à sucre) possèdent une déviation δ13C de l'ordre de -28 ‰ en moyenne. Pour les plantes en C4 (comme la maïs ou la canne à sucre), cette valeur est de -14 ‰ environ. Il est à noter que la combustion de matières fossiles (gaz naturel, charbon, pétrole) produit du CO2 qui présente une déviation isotopique de l'ordre de -30 ‰, valeur caractéristique du CO2 industriel. La figure 2 montre les variations en δ13C de diverses substances.
L'hydrogène
A la différence du carbone, la plante ne dispose pas d'eau qui présente une teneur moyenne en deutérium (2H, isotope lourd de l'élément hydrogène) constante sur terre. Au contraire l'eau de pluie montre une variation importante et reproductible de la teneur en 2H en fonction de paramètres géographiques : le rapport isotopique D/H de l'eau est de l'ordre de 156 ppm aux environs de l'équateur et décroît considérablement vers les pôles, avec une valeur caractéristique au Groënland de 129 ppm. Le cycle de l'eau permet d'expliquer la grande disparité des rapports isotopiques en deutérium de l'eau. Le deutérium a une légère préférence pour l'état liquide et l'effet isotopique associé à l'équilibre thermodynamique liquide-vapeur de l'eau est EI = 1.079 (la vapeur est le produit et le liquide est le substrat). Les nuages sont donc constitués de vapeur d'eau qui est allégée en isotope lourd par rapport à l'eau de l'océan. Elle continue à s'appauvrir lorsque les nuages se déplacent vers l'intérieur des continents car la fraction d'eau perdue au cours des pluies, formées par condensation, sont enrichies en 2H. De plus l'effet isotopique augmente quand la température diminue. L'eau évaporée à température plus basse subissant un plus fort appauvrissement en isotope lourd, les pluies deviennent plus légères vers les régions polaires. Enfin cet effet associé à une diminution de température se traduit par une légère diminution de la teneur en 2H lorsque l'altitude augmente.
A l'échelle du globe le rapport 2H/1H diminue quand la latitude augmente et quand on s'éloigne de la mer. De plus, d'une saison à l'autre des variations isotopiques de l'eau sont visibles. L'eau qui est absorbée par la plante est en partie éliminée par évapotranspiration (évaporation de l'eau par transpiration de la plante). Les effets isotopiques sont complexes, leur amplitude diffère selon le type métabolique de la plante (C3, C4 et CAM). Ainsi, comme le montre la figure 3, le rapport 2H/1H varie en fonction de l'origine botanique.
SLAP : Standard Light Antarctic Precipitation (eau de référence du Pôle Sud). GISP : Greenland Ice Sheet Precipitation (eau de référence du Pôle Nord)
Note : l'éthanol est considéré comme naturel lorsqu'il est produit par la fermentation de sucres.
L'oxygène
Pour des raisons pratiques l'isotope lourd 18O a été largement plus étudié que l'autre isotope lourd de l'oxygène 17O. Nous nous limiterons donc au rapport 18O/16O. Il a été montré une forte corrélation entre le rapport 2H/1H et 18O/16O de l'eau de pluie et issue de plantes. Il existe donc une relation entre la déviation δ18C et les données géographiques (altitude et latitude) et climatiques (température et pluviométrie).
Grâce à des progrès instrumentaux récents, la mesure de la teneur en 18O de la matière organique est devenue une analyse de routine. De plus en plus de données seront alors cumulées, permettant une meilleure compréhension du fractionnement isotopique de l'oxygène dans les plantes.
Conclusion
La répartition d'un isotope lourd par rapport à son isotope léger n'est pas statistique dans les produits naturels. En particulier, au cours de la photosynthèse, le végétal « consomme » le gaz carbonique et l'eau de telle façon que les métabolites ainsi synthétisés (tels que les sucres, les acides organiques, etc.) présentent une disparité dans la distribution des isotopes lourds au sein de ces molécules. Par conséquent être capable de mesurer avec une précision suffisante les rapports isotopiques d'une molécule doit permettre de remonter à l'origine du végétal qui l'a produite (botanique voire géographique). L'isotope apparaît alors comme un véritable traceur des origines.
Actuellement il y a 2 approches pour la mesure des rapports isotopiques : la spectrométrie de masse dédiée à l'analyse isotopique (connue sous le nom de SMRI : Spectrométrie de Masse des Rapports Isotopiques) et la Résonance Magnétique Nucléaire (RMN), qui a l'avantage de pouvoir déterminer des rapports isotopiques spécifiques pour les différents sites chimiques de la molécule. Ces techniques seront décrites dans des articles différents.
La mesure des rapports isotopiques a connu un fort développement durant ces dernières années pour l'authentification des produits naturels. Les applications les plus marquantes feront également l'objet d'autres articles.
-
Cycles de photosynthèse :
-
C3 : A.M. Calvin and J.A. Bassham, The photosynthesis of carbon compounds, Benjamin, New-York, 1962.
-
C4 : M.D. Hatch and C.R. Slack, C.R. An. Rev. Plant Physiol., 21, p 141 1962.
-
CAM : T. Whelan, W.M. Sackett and C.R. Benedict, Plant Physiol., 51, p 1051, 1973.
-
Général : E. Jolivet, Physiol. Vég., 14, p 563, 1976.
-
-
Fractionnement isotopique :
-
R.E. Criss, Principles of stable isotope distribution, Oxford University Press, Londres, 1999.
-
E. Brugnoli and G.D. Farquhar, Advances in Photosynthesis, R.C. Leegood, T.D. Sharkey and S. von Caemmerer (eds),Kluwer Academic publishers, vol 9, p399, 2000.
-
-
Traceur d'origine :
-
G.J. Martin, Biofutur, p 33, Mars 1992.
-
M.L. Martin, Bulletin de l'union des physiciens, 725, p 793, 1990 .
-
G. Calderone, C. Guillou et N. Naulet, L'Actualité Chimique, 8-9, p 22, 2003.
-
-
Définitions :
-
C. Lamoureux, L'Actualité Chimique, 8-9, p 5, 2003.
-