La chimie verte, apparue au début des années 1990 a pour but de « concevoir des produits et des procédés chimiques permettant de réduire ou d'éliminer l'utilisation et la synthèse de substances dangereuses ». Cette définition a été développée en douze principes qui donnent les lignes directrices pour la conception de nouveaux procédés ou l'amélioration de ceux existants. Le deuxième principe introduit la notion d'économie d'atome : les synthèses doivent être conçues dans le but de maximiser l'incorporation des matériaux utilisés au cours du procédé dans le produit final.
La chimie verte, apparue au début des années 1990 a pour but de « concevoir des produits et des procédés chimiques permettant de réduire ou d'éliminer l'utilisation et la synthèse de substances dangereuses ». Cette définition a été développée en douze principes qui donnent les lignes directrices pour la conception de nouveaux procédés ou l'amélioration de ceux existants. Le deuxième principe introduit la notion d'économie d'atome : les synthèses doivent être conçues dans le but de maximiser l'incorporation des matériaux utilisés au cours du procédé dans le produit final.
La mise en œuvre de ce principe permet de minimiser la quantité de sous-produits de réaction et donc de réduire la pollution à la source plutôt que de produire des déchets qu'il faudra traiter ou éliminer. Or l'efficacité d'un procédé est traditionnellement mesurée par le rendement chimique, sans tenir compte de la quantité de sous-produits formés. La chimie verte propose une évolution de ce concept qui prend en compte la réduction des déchets à la source. À cette fin, de nouveaux indicateurs de l'efficacité des procédés ont été introduits : l'utilisation atomique et le facteur E.
Définition
Utilisation atomique ou économie atomique
L'utilisation atomique, introduite par Trost [1], également appelée l'économie atomique, est définie comme le rapport de la masse molaire du produit recherché sur la somme des masses molaires de tous les produits qui apparaissent dans l'équation stœchiométrique. Si les sous-produits de la réaction ne sont pas tous identifiés, alors la conservation de la matière permet de remplacer le dénominateur par la somme des masses molaires de tous les réactifs.

Considérons par exemple la réaction de déhydrohalogénation du 2-bromo-2-méthylpropane par l'éthanolate de sodium qui conduit au méthylpropène :
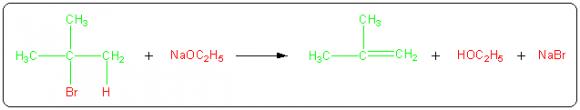
Le produit recherché est ici le méthylpropène (en vert). On classe les atomes des réactifs en deux catégories : ceux qui sont incorporés dans le produit désiré (en vert) et ceux qui se retrouvent dans des sous-produits indésirables (en rouge). L'utilisation atomique est dans ce cas :
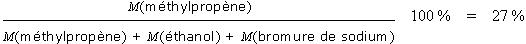
Cela signifie que même si le rendement de la réaction est de 100%, seuls 27% en masse des atomes de réactifs sont incorporés dans le produit. Les 73% qui restent constituent des déchets qu'il faudra séparer puis traiter pour les recycler ou les détruire, avec un impact environnemental et financier important. Un procédé sera donc d'autant plus efficace, que son utilisation atomique sera proche de 100%.
Facteur E
Le facteur E, introduit par Sheldon [2], est défini comme le rapport massique déchet/produit désiré :
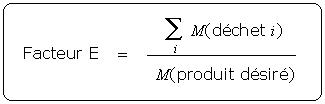
Le facteur E (E) est relié à l'utilisation atomique (UA) par la relation :
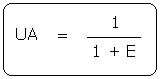
Le facteur E de la réaction précédente est de 2,7. Il y a 2,7 fois plus de déchet, en masse, que de produit désiré. Un procédé sera donc d'autant plus efficace, que son facteur E sera proche de 0.
Le tableau suivant donne l'ordre de grandeur des facteurs E dans les grands domaines de l'industrie chimique [2].
| Secteur | Tonnage annuel | Facteur E |
|---|---|---|
| Chimie lourde | 104-106 | 1 → 5 |
| Chimie fine | 102-104 | 5 → > 50 |
| Industrie pharmaceutique | 102-103 | 25 → > 100 |
On constate que le facteur E augmente avec la complexité des produits synthétisés, si bien que la chimie fine et l'industrie pharmaceutique génèrent en fin de compte des quantités de déchets comparables à celle générée par la chimie lourde pour des tonnages de produits inférieurs de plusieurs ordres de grandeur. Ces données montrent que l'optimisation des procédés en vue de réduire le facteur E est profitable dans tous les domaines de l'industrie chimique.
Application : réaction stœchiométrique / réaction catalytique
Oxydation des alcools
Les réactions stœchiométriques sont généralement beaucoup moins efficaces que les réactions catalytiques. Considérons par exemple les réactions suivantes d'oxydation de l'alcool par l'oxyde de chrome (réaction stœchiométrique) ou le dioxygène (réaction catalytique) :
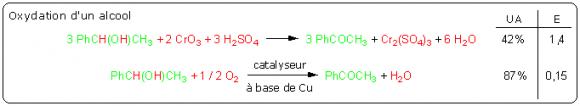
L'utilisation d'un catalyseur permet d'optimiser l'efficacité du procédé. Dans ce cas particulier, il faut noter que les sels de chrome, sous-produits très toxiques de la réaction stœchiométrique, n'apparaissent plus dans la réaction catalysée. Pour quantifier cet avantage supplémentaire, il est possible d'introduire un facteur environnemental Q qui tient compte de la toxicité des sous-produits, de la facilité de séparation, de leur caractère recyclable, etc. C'est alors le produit E.Q qui est le plus pertinent pour quantifier l'impact environnemental du procédé. Pour les réactions précédentes, on attribuera un facteur Q = 1 à l'eau et Q très supérieur à 1 pour les sels de chrome.
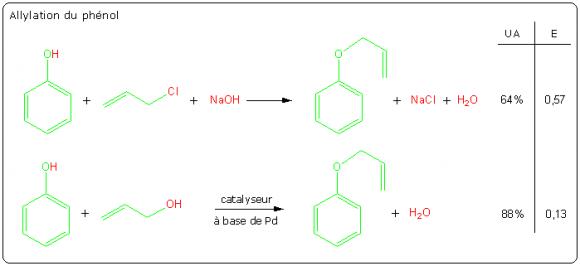
Allylation du phénol
L'allylation du phénol par la synthèse de Williamson est un autre exemple de réaction stœchiométrique qui peut être remplacée par un processus catalytique plus efficace. Un mode opératoire permettant la comparaison des deux réactions a fait l'objet d'une publication [3].
Synthèse de l'ibuprofène
L'ibuprofène est un anti-douleur qui constitue le principe actif de nombreux produits commerciaux. Le procédé industriel traditionnel, développé par la société Boots dans les années 1960, se compose de six réactions stœchiométriques et son utilisation atomique est de 40%. La production annuelle de 13000 tonnes d'ibuprofène génère plus de 20000 tonnes de déchets à détruire. Dans les années 1990, la société BHC à mis au point un procédé vert basé sur trois réactions catalysées qui porte l'utilisation atomique à 77% et dont le seul produit secondaire est l'acide acétique. Comme ce dernier est valorisé, on peut le considérer comme un produit recherché. Cela porte l'utilisation atomique à plus de 99%. La comparaison de ces deux procédés fait l'objet d'un autre article: « Un exemple de chimie verte : la synthèse industrielle de l'ibuprofène ».
Conclusion
La notion traditionnelle de rendement ne suffit plus pour évaluer l'efficacité des procédés chimiques. Essayer de mettre en œuvre une chimie verte impose d'introduire des concepts nouveaux : l'utilisation atomique et le facteur E. Ils permettent une meilleure évaluation de l'efficacité des procédés et servent de cadre conceptuel pour optimiser les procédés existants et développer de nouvelles stratégies de synthèse :
- en remplaçant les réactions stœchiométriques par des réactions catalytiques plus efficaces (si elles existent),
- en privilégiant les réactions intrinsèquement les plus efficaces. Par exemple les réarrangements, au cours desquels les atomes du réactif se réarrangent pour former le produit et dont l'utilisation atomique est de 100%.
Références
[1] B. M. Trost, « The atom economy, a search for synthetic efficiency » Science, 254 (1991) 1471.
[2] R. A. Sheldon, « Atom utilisation, E factors and the catalytic solution » C. R. Acad. Sci. Paris, Série IIc (2000) 541.
[3] C. C. Santini, E. Kuntz, A. Amgoume, « Utilisation atomique, facteur E. Application à la réaction d'allylation du phénol. Solution catalytique. » BUP, 858 (2003) 15.