De nombreuses substances chimiques prennent en solution une couleur qui dépend des conditions de pH. Cette propriété est mise à profit pour déterminer les caractéristiques des solutions en y introduisant l’indicateur sous forme de solution ou bien en utilisant une bandelette de papier imbibée d’indicateur : le papier-pH. Le choix du bon indicateur permet également de repérer l’équivalence au cours des titrages. Cet article est accompagné d'une séquence expérimentale filmée.
Histoire
Dès le dix-septième siècle, Robert Boyle1 utilise des décoctions de plantes comme indicateurs colorés. Dans son ouvrage « expériences sur les couleurs » il explique en 1663 comment mettre en évidence le caractère acide des solutions à l’aide de sirop de violette. Il suggère de déposer quelques gouttes de sirop sur un papier blanc puis de déposer l’acide sur le papier : la tache de sirop passe du violet au rouge. Il donne ainsi le premier protocole expérimental de test d’acidité à l’aide d’un indicateur coloré et invente du même coup le papier-pH ! À la fin du dix-huitième siècle on commence à utiliser les indicateurs colorés naturels dans les procédés industriels à des fins de contrôles. On constate alors que les solutions acides n’ont pas toutes le même effet sur les couleurs des indicateurs ; cela conduit à la mise au point des premières échelles de comparaison des forces des acides. Il faudra attendre encore un siècle pour développer les premières synthèses d’indicateurs : la phénolphtaléine en 1877 et le méthylorange en 1878. Le nombre des indicateurs ne cesse de croître et la variété de leur comportement vis-à-vis des différentes solutions acides et basiques est mal comprise jusqu’en 1894, quand Wilhelm Ostwald2 propose la première théorie des indicateurs.
Ostwald émet l’hypothèse suivante : l’indicateur est un acide ou une base faible dont les formes dissociées et protonées sont de couleurs différentes. Cette hypothèse s’avère exacte et la définition moderne la reprend en donnant plus de précisions : un indicateur coloré est un acide ou une base faible organique dont la structure interne change lors de l’échange de proton ce qui entraîne une variation de couleur. Pour un indicateur de type acide appartenant au couple HIn/In- l’équilibre mis en jeu est :
HIn + H2O = In- + H3O+
Sa constante d’équilibre est le Ka du couple, noté ici Ka,I : Ka,I = [H3O+][In-] / [HIn] C0, où C0 est la concentration standard 1 mol.L-1 que nous omettrons dans la suite. Le réarrangement de cette relation sous la forme [HIn] / [In-] = [H3O+] / Ka,I montre que le rapport des concentrations entre les deux formes de l’indicateur est proportionnel à la concentration en ions hydronium. Si le pH du milieu est fixé, alors ce rapport et donc la couleur de la solution le sont également.
On constate que pour la plupart des substances utilisées, une des deux formes impose sa couleur lorsqu’elle est en quantité dix fois supérieure à l’autre : cela permet de distinguer clairement deux domaines de pH de part et d’autre de pKa,I (cf figure 1). La zone de pH centré sur pKa,I dans laquelle on observe le changement de teinte est appelée la zone de virage. La couleur à pH = pKa,I est la « teinte sensible ». Il faut toutefois remarquer que ce critère au dixième n'est pas universel : il dépend de la nature de l'indicateur coloré, mais également de la sensibilité aux couleurs de l'observateur. Ainsi, un observateur dont l'oeil est plus sensible aux variations de couleurs attribuera une zone de virage plus large à un indicateur donné.
Principaux indicateurs
Les principaux indicateurs colorés acido-basiques utilisés au laboratoire ainsi que leurs caractéristiques sont donnés dans le tableau ci-dessous.
| Indicateur | pKa,I | Zone de virage | Couleur en fonction du pH | Formule de la forme acide |
|---|---|---|---|---|
|
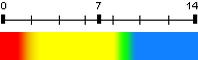
Bleu de thymol (deux virages) |
1,7 et 8,9 | 1,2 - 2,8
8,0 – 9,6 |
 |
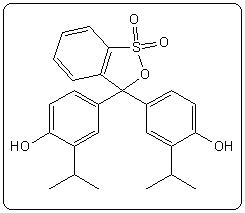 |
| Jaune de méthyle | 3,3 | 2,9 – 4,0 | 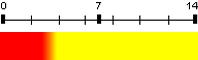 |
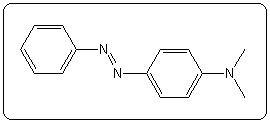 |
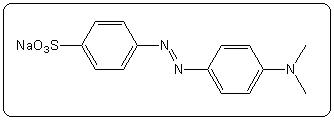
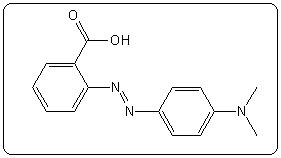
| Méthylorange (hélianthine) | 3,7 | 2,4 – 4,4 | 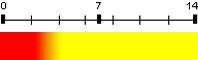 |
 |
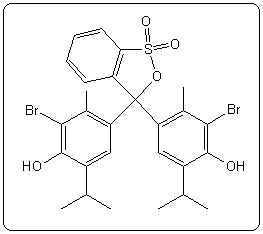
| Bleu de bromophénol (BBP) | 4,1 | 3,0 - 4,6 | 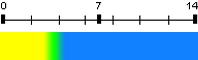 |
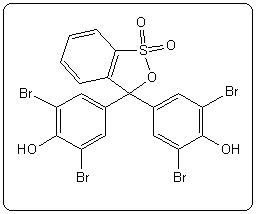 |
| Rouge de méthyle | 5,1 | 4,2 – 6,2 |  |
 |
|
Bleu de bromothymol (BBT) 2ème virage |
7,1 | 6,0 – 7,6 |  |
 |
| Rouge de phénol | 7,8 | 6,8 – 8,4 | 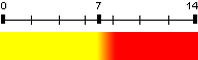 |
 |
| Phénolphtaléine | 9,6 | 8,2 – 9,9 | 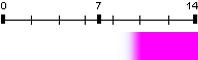 |
 |
| Jaune d'alizarine R | 10,2 – 12,1 | 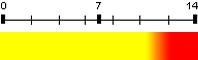 |
 |
On constate que ces indicateurs peuvent être classés en familles : le jaune de méthyle permet d’obtenir le méthylorange, le rouge de méthyle et le jaune d’alizarine par substitution tandis que le rouge de phénol et la phénolphtaléine sont les composés de départ des autres indicateurs.
Un indicateur coloré peut être employé sous deux formes pour tester le pH d’une solution.
-
Sous forme de solution : il est introduit directement dans la solution ou dans un échantillon de la solution à tester. On utilise en général une solution d’indicateur assez diluée pour que l’équilibre acido-basique mis en jeu ne perturbe pas trop la solution (voir le paragraphe « précautions à prendre lors des titrages »). Il s’agit en général de solutions à 0,1% en masse dans l’eau ou l’éthanol.
-
Papier-pH : l’indicateur est absorbé sur une bandelette de papier sur laquelle on dépose une goutte de la solution à tester. L’intérêt du papier-pH est de couvrir tout le domaine de pH dans l’eau. Pour arriver à ce résultat, il suffit d’absorber plusieurs indicateurs colorés en même temps.
Un titrage permet de déterminer la concentration d’un analyte en le faisant réagir quantitativement avec un réactif titrant introduit en quantité contrôlée. L’équivalence chimique est atteinte lorsque le titrant est introduit en quantité stoechiométriquement égale à celle d’analyte, c’est une grandeur théorique. Pour la repérer, l’expérimentateur doit choisir une grandeur physique qui varie brutalement en ce point ou à défaut le plus près possible. Ce point expérimental est appelé le point de fin de titrage. Dans le cas du titrage colorimétrique, on repère le changement de couleur d’un indicateur coloré.
Pour permettre un repérage efficace, la zone de virage de l’indicateur coloré doit être la plus étroite possible et centrée dans la zone où la variation de pH est la plus importante, idéalement de pKa,I = pHéq (figure 2a.) Si le saut de pH est important, un indicateur dont le pKa,I est éloigné de pHéq peut également convenir (figure 2b.) Mais si l’écart entre son pKa,I et pHéq est trop important (figure 2c), ou si sa zone de virage est trop large (figure 2d), alors l’indicateur coloré est inapproprié.
Précautions à prendre lors des titrages
L’indicateur est une espèce acido-basique, son introduction va donc perturber le système étudié. Dans le cas du titrage d’un acide par une base par exemple, l’indicateur est sous forme acide avant l’équivalence et il réagit avec la base titrante lors du virage. Il faut donc prendre soin de l’introduire en faible quantité pour ne pas déplacer l’équivalence. Dans les cas usuels au laboratoire, on titre un volume de l’ordre de 10 mL de solutions 10-3 à 10-1 molaires, soit une quantité de 10-5 à 10-3 mol d’analyte. On y introduit quelques gouttes d’une solution diluée d’indicateur (0,1 % en masse.) On peut vérifier que la perturbation du système est faible : la masse molaire des indicateurs courant est de l’ordre de 300 g.mol-1, la concentration de la solution à 1g.L-1 est de l'ordre de 3.10-3 mol.L-1, la quantité introduite par l’ajout de 2 gouttes d’un vingtième de mL est donc de l’ordre de 3.10-7 mol ce qui est négligeable par rapport aux quantités d’analyte généralement engagées.
Un indicateur universel est un mélange d'indicateurs dont les points de virage sont étalés de manière à ce que la couleur de la solution varie graduellement sur une large gamme de pH. On peut alors évaluer le pH d'une solution en y versant quelques gouttes de cet indicateur puis en comparant la couleur prise avec une échelle de teinte réalisée à partir de solutions tampon (voir la vidéo ci-après, nommée échelle de teinte et papier-pH).
Le mélange bleu de thymol - rouge de méthyle - bleu de bromothymol - phénolphtaléine est un indicateur universel courant. Il permet d'évaluer le pH d'une solution s'il est compris entre 4 et 10 [2] (cf figure 3.) Il existe d'autres mélanges permettant d'obtenir un indicateur universel (voir par exemple [3])
Le papier-pH est une bandelette de papier sur lequel est absorbé un indicateur universel (cf figure 4).
La vidéo accompagnant cet article est disponible ci-dessous:
Story-board, voix off et conception : Hagop Demirdjian.
Production : Diffusion des savoirs de l'École Normale Supérieure, septembre 2007
Bibliographie et ressources en ligne
[1] Szabadvary, F. « Indicators: A historical perspective », J. Chem. Educ. 1964, 41, 285.
[2] B. Fosset, C. Lefrou, A. Masson, C. Mingotaud, « Chimie physique expérimentale », 2000, Hermann.
[3] D. Cachau-Herreillat, « Des expériences de la famille acide-base », 2ème éd. 2005, De Boeck.