Ce troisième article du dossier L'AFM-IR : présentation et exemples d'application montre l'utilisation de cette technique dans l'étude de nanoparticules. Le lecteur est invité à consulter au préalable le premier article du dossier, intitulé Couplage de la microscopie à force atomique (AFM) et de la spectroscopie infrarouge (IR) : AFM-IR.
Principe
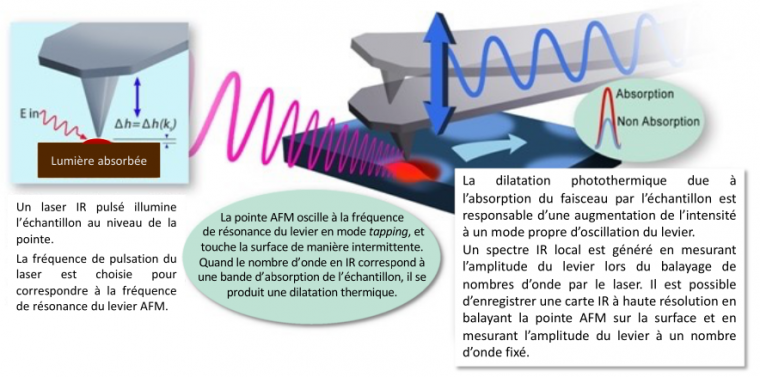
Le mode contact de l'AFM-IR a prouvé son efficacité lors de nombreuses applications. Cependant, ce mode de fonctionnement n'est pas adapté pour des échantillons mous dans lesquels la pointe peut rester piégée, ou qui n'adhèrent pas à la surface et sont entraînés par la pointe pendant la formation de l’image AFM. C'est le cas des nanoparticules (NPs), utilisées pour de nombreuses applications biologiques. En mode tapping, la pointe n'est pas en contact permanent avec la surface de l'échantillon mais seulement par intermittence, ce qui permet d’imager les nanoparticules sans le détruire ou le déplacer.
Dans ce mode, le levier de l'AFM vibre à sa fréquence de résonance fondamentale et la pointe de l'AFM est abaissée jusqu'à l'échantillon de telle sorte que l'amplitude soit limitée par le contact avec la surface de l'échantillon. La pointe parcourt ensuite la surface de l'échantillon pour enregistrer sa topographie, tout en maintenant une amplitude d'oscillation constante. Si le laser IR irradiant l’échantillon était pulsé à la fréquence du mode tapping utilisé pour réaliser la topographie, dans la mesure où la perturbation liée à l’expansion thermique est extrêmement faible, elle ne serait pas détectée.
Afin de pouvoir réaliser des mesures locales d’absorption, une approche hétérodyne est alors employée. L'hétérodyne est une méthode de détection d'un signal qui est fondée sur la multiplication de plusieurs fréquences. La fréquence du laser est réglée de telle sorte qu'elle soit égale à la différence entre les fréquences des modes fondamental et secondaire du levier AFM. La non linéarité de l'interaction en mode tapping permet de combiner l'oscillation du levier avec la dilatation photothermique de l'échantillon à une fréquence qui est la somme des deux, c'est-à-dire la fréquence du deuxième mode de vibration du levier.
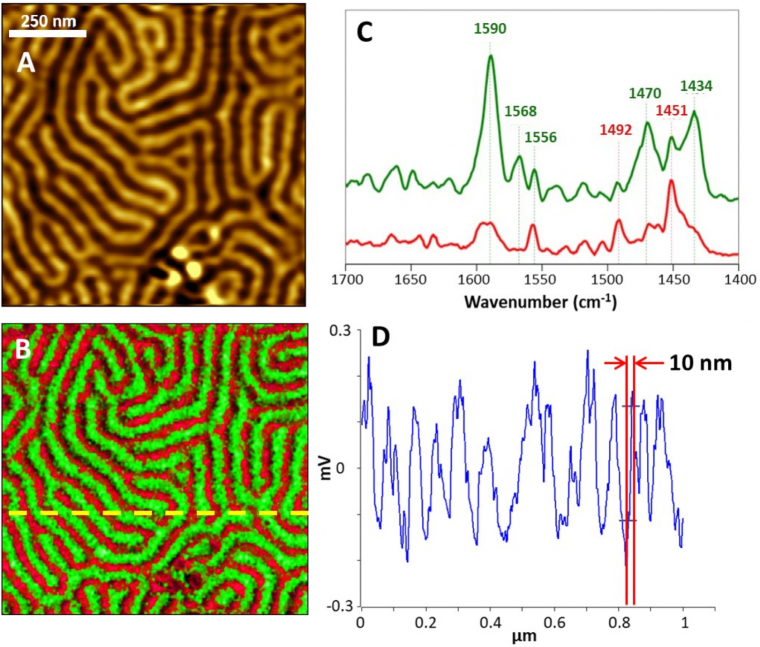
On peut également faire l’inverse, réaliser l’imagerie de topographie avec le second mode tapping et détecter l'absorption IR en utilisant le mode tapping fondamental. Dans les deux cas, le signal est dominé par le signal local lors du contact entre la pointe et l'échantillon et seule la taille de la pointe AFM limite la résolution spatiale. Des mesures effectuées avec cette technique ont présenté une résolution spatiale de 10 nm (Figure 2).
L'échantillon de PS-P2VP a été imagé avec une taille de faisceau de 1×1
(A) Topographie, qui montre la présence de deux composants dans l'échantillon, (B) Images AFM-IR en mode tapping obtenues pour deux bandes d'absorption spécifiques du PS (1492cm-1, rouge) et du P2VP (1588cm-1, vert), (C) Spectres obtenus en mode tapping AFM-IR pour les deux composés, (D) Coupe transversale réalisée sur une des cartes, mettant en évidence une résolution inférieure à 10 nm. Pour l'estimation de la résolution ici, les auteurs ont choisi la plus petite caractéristique de l'image chimique et ont mesuré la distance pour laquelle le signal passe de 90 à 10%.
D'après Mathurin, J., Pancani, E., Deniset-Besseau, A., Kjoller, K., Prater, C.B., Gref, R., and Dazzi, A., How to unravel the chemical structure and component localization of individual drug-loaded polymeric nanoparticles by using tapping AFM-IR, Analyst 2018, 143(24), 5940–5949.
Application à l'étude de nanoparticules
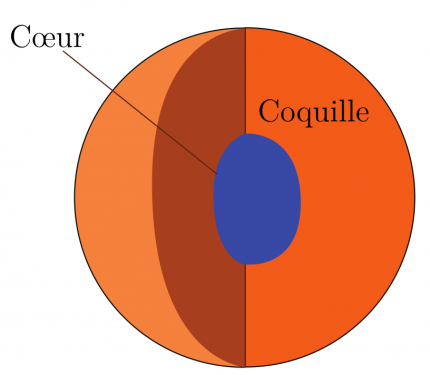
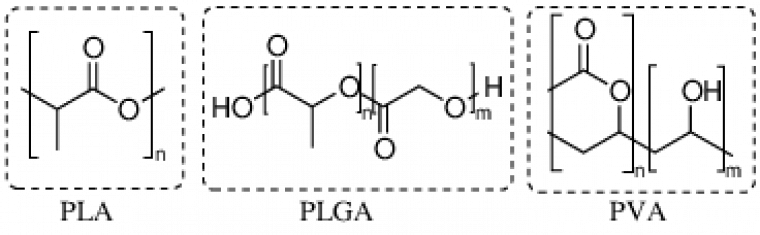
Ce mode de fonctionnement a déjà été utilisé pour l'étude de nanoparticules de polymères de moins de 200 nm de diamètre, qui ont un grand intérêt pour des applications biomédicales. Ces nanoparticules possèdent une structure de type cœur-coquille (Figure 3) avec un cœur composé de PLA (acide polylactique) ou PLGA (acide poly(lactique-co-glycolique)) et une coquille en PVA (poly(acétate de vinyle)) (structures Figure 4).
L'utilisation du mode tapping permet d'imager les nanoparticules sphériques sans les déformer ou les déplacer et de localiser chacun des constituants.
Les nanoparticules de PLA ont été imagées par AFM-IR en mode contact et en mode tapping. Lorsque le mode contact est utilisé, les particules sont repoussées ou écrasées par la pointe, même en diminuant la force appliquée (Figure 4 A).
Pour les figures A et B, la couleur rouge correspond à des absorptions élevées pour la bande de vibration d'élongation de la liaison C=O des fonctions ester du PLA à 1760 cm-1 alors que pour (C), le bleu correspond à des absorptions élevées pour la bande de vibration de déformation de la liaison C-H du PVA à 1415cm-1. (D): Le cœur et la coquille sont représentés schématiquement en rouge et bleu, respectivement.
D'après Mathurin, J., Pancani, E., Deniset-Besseau, A., Kjoller, K., Prater, C.B., Gref, R., and Dazzi, A., How to unravel the chemical structure and component localization of individual drug-loaded polymeric nanoparticles by using tapping AFM-IR, Analyst 2018, 143(24), 5940–5949.
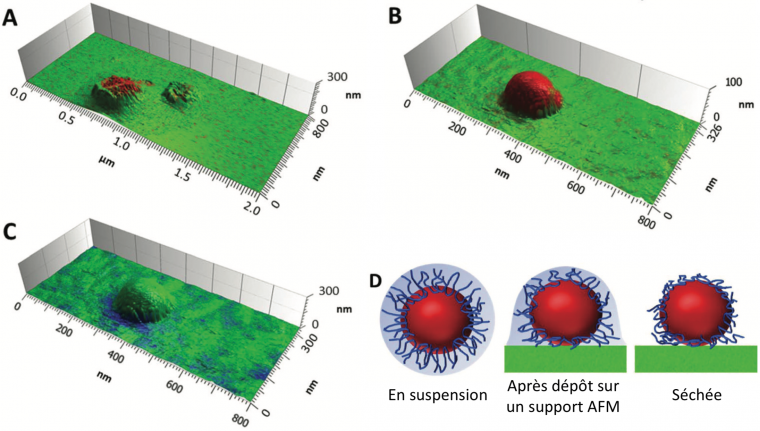
En revanche, en mode tapping, une image fidèle de la forme sphérique des nanoparticules sans aucune déformation est observée (Figures 5, B et C). L'image B présente en rouge l'absorption correspondant aux bandes de vibration d'élongation des liaisons C=O des fonctions ester du PLA à 1760 cm–1, qui constitue le cœur de la nanoparticule. Dans l'image C, le bleu correspond aux bandes de déformation des liaisons C-H du PVA, qui constitue la coquille des nanoparticules. On constate que cette couche ne fait que 15 à 10 nm d'épaisseur et n'est présente que sur les bords de la nanoparticule. Cela peut s'expliquer par le processus de séchage présenté sur la Figure 5 D : les chaînes de PVA sont progressivement déshydratées au cours du séchage et ainsi, s'aplatissent à la surface de la nanoparticule. Les chaînes de PVA qui s'accumulent dans l'espace entre la nanoparticule et le support AFM sont ainsi plus facilement détectables alors que les chaînes de PVA au sommet des nanoparticules forment une couche trop mince pour être détectée.
Bibliographie
- Murugesapillai, D., McCauley, M.J., Maher, L.J., and Williams, M.C., Single-molecule studies of high-mobility group B architectural DNA bending proteins, Biophysical Reviews 2017, 9 (1), 17–40.
- Henry, L., Bacle, P., and Rossi-Gendron, C., La Microscopie à Force Atomique pour l’observation de molécules avec une résolution atomique 2016
- Binnig, G., Quate, C.F., and Gerber, C., Atomic Force Microscope, Physical Review Letters 1986, 56 (9), 930–933.
- Policar, C., Waern, J., Plamont, M., Clède, S., Mayet, C., Prazeres, R., Ortega, J.M., Vessières, A., and Dazzi, A., Subcellular Imaging in the Mid-IR of a Metal-Carbonyl Moiety Using Photothermal Induced Resonance, Angewandte Chemie International Edition 2011, 50, 860–864.
- Dazzi, A. and Prater, C.B., AFM-IR : Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging, Chemical Reviews 2017, 117 (7), 5146– 5173.
- Dazzi, A., Kjoller, K., and Reading, M., High Frequency Deflection Measurement of IR Absorption 2008.
- Dazzi, A., Konstantin, V., Policar, C., Reading, M., Kjoller, K., and Prater, C.B., High Frequency Deflection Measurement of IR Absorption 2012.
- Dazzi, A. and Policar, C., Chapter 9 - AFM-IR : photothermal infrared nanospectroscopy : Application to cellular imaging, in C. Pradier and Y. Chabal, editors, Biointerface Characterization by Advanced IR Spectroscopy, pages 245 – 278, Elsevier, Amsterdam 2011, doi :https://doi.org/10.1016/B978-0-444-53558-0.00009-6.
- Dazzi, A., Prater, C.B., Hu, Q., Chase, D.B., Rabolt, J.F., and Marcott, C., AFM- IR : Combining Atomic Force Microscopy and Infrared Spectroscopy for Nanoscale Chemical Characterization, Applied Spectroscopy 2012, 66 (12), 1365–1384.
- Dazzi, A., PhotoThermal Induced Resonance. Application to Infrared Spectromicroscopy, in Thermal Nanosystems and Nanomaterials, pages 469–503, Springer Berlin Heidelberg 2009, doi :10.1007/978-3-642-04258-4_16.
- Dazzi, A., Glotin, F., and Carminati, R., Theory of infrared nanospectroscopy by photothermal induced resonance, Journal of Applied Physics 2010, 107 (12), 124519.
- Prater, C.B., Kjoller, K., Shetty, R., and Dazzi, A., Spectroscopy : AFM improves resolution of IR spectroscopy, Laser Focus World 2011, 47, 52–54.
- Mayet, C., Deniset-Besseau, A., Prazeres, R., Ortega, J.M., and Dazzi, A., Analysis of bacterial polyhydroxybutyrate production by multimodal nanoimaging, Biotechnology advances 2013, 31 (3), 369–374.
- Dazzi, A., Prazeres, R., Glotin, F., and Ortega, J., Subwavelength infrared spectro- microscopy using an AFM as a local absorption sensor, Infrared Physics & Technology 2006, 49 (1), 113 – 121.
- Mayet, C., Dazzi, A., Prazeres, R., Allot, F., Glotin, F., and Ortega, J.M., Sub-100 nm IR spectromicroscopy of living cells, Optics Letters 2008, 33 (14), 1611.
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J.M., and Jaillard, D., In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy, Analyst 2010, 135, 2540–2545.
- Dazzi, A., Prazeres, R., Glotin, F., and Ortega, J.M., Local infrared microspectroscopy with subwavelength spatial resolution with an atomic force microscope tip used as a photothermal sensor, Optics Letters 2005, 30 (18), 2388.
- Hillard, E., Vessières, A., Thouin, L., Jaouen, G., and Amatore, C., Ferrocene- Mediated Proton-Coupled Electron Transfer in a Series of Ferrocifen-Type Breast-Cancer Drug Candidates, Angewandte Chemie International Edition 2006, 45 (2), 285–290.
- Keppler, B.K., Metal Complexes in Cancer Chemotherapy, Wiley-VCH, Weinheim 1993.
- Jackson, A., Davis, J., Pither, R.J., Rodger, A., and Hannon, M.J., Estrogen-Derived Steroidal Metal Complexes : Agents for Cellular Delivery of Metal Centers to Estrogen Receptor-Positive Cells, Inorganic Chemistry 2001, 40 (16), 3964–3973.
- Top, S., Kaloun, E.B., Vessières, A., Leclercq, G., Laïos, I., Ourevitch, M., Deuschel, C., McGlinchey, M.J., and Jaouen, G., Tamoxifen Derivatives for Delivery of the Antitumoral (DACH)Pt Group : Selective Synthesis by McMurry Coupling, and Biochemical Behaviour, ChemBioChem 2003, 4 (8), 754–761.
- Cassino, C., Gabano, E., Ravera, M., Cravotto, G., Palmisano, G., Vessières, A., Jaouen, G., Mundwiler, S., Alberto, R., and Osella, D., Platinum(II) and technetium(I) complexes anchored to ethynylestradiol : a way to drug targeting and delivery, Inorganica Chimica Acta 2004, 357 (7), 2157 – 2166.
- Jaouen, G., Top, S., Vessières, A., Leclercq, G., and McGlinchey, M.J., The First Organometallic Selective Estrogen Receptor Modulators (SERMs) and Their Relevance to Breast Cancer, Current Medicinal Chemistry 2004, 11 (18), 2505–2517.
- Jaouen, G., Vessières, A., and Top, S., Ferrocifen type anti cancer drugs, Chemical Society Reviews 2015, 44 (24), 8802–8817.
- Wang, Y., Pigeon, P., Top, S., McGlinchey, M.J., and Jaouen, G., Organometallic Antitumor Compounds : Ferrocifens as Precursors to Quinone Methides, Angewandte Chemie International Edition 2015, 54 (35), 10230–10233.
- Fery-Forgues, S. and Delavaux-Nicot, B., Ferrocene and ferrocenyl derivatives in luminescent systems, Journal of Photochemistry and Photobiology A : Chemistry 2000, 132 (3), 137 – 159.
- Hostachy, S., Policar, C., and Delsuc, N., Re(I) carbonyl complexes : Multimodal platforms for inorganic chemical biology, Coordination Chemistry Reviews 2017, 351, 172–188.
- Clède, S. and Policar, C., Metal-carbonyl units for vibrational and luminescence imaging : towards multimodality, Chemistry - A European Journal 2015, 21 (3), 942–58.
- Hildebrandt, P., A Spectral Window to the Cell, Angewandte Chemie International Edition 2010, 49(27), 4540–4541.
- Clède, S., Lambert, F., Sandt, C., Kascakova, S., Unger, M., Harte, E., Plamont, M.A., Saint-Fort, R., Deniset-Besseau, A., Gueroui, Z., Hirschmugl, C., Lecomte, S., Dazzi, A., Vessieres, A., and Policar, C., Detection of an estrogen derivative in two breast cancer cell lines using a single core multimodal probe for imaging (SCoMPI) imaged by a panel of luminescent and vibrational techniques, Analyst 2013, 138 (19), 5627–38.
- Clède, S., Lambert, F., Sandt, C., Gueroui, Z., Delsuc, N., Dumas, P., Vessières, A., and Policar, C., Synchrotron radiation FTIR detection of a metal-carbonyl tamoxifen analog. Correlation with luminescence microscopy to study its subcellular distribution, Biotechnology Advances 2013, 31 (3), 393–395.
- Wang, Y., Heinemann, F., Top, S., Dazzi, A., Policar, C., Henry, L., Lambert, F., Jaouen, G., Salmain, M., and Vessières, A., Ferrocifens labelled with an infrared rhenium tricarbonyl tag : synthesis, antiproliferative activity, quantification and nano IR mapping in cancer cells, Dalton Transactions 2018, 47, 9824–9833.
- Zhong, Q., Inniss, D., Kjoller, K., and Elings, V., Fractured polymer/silica fiber surface studied by tapping mode atomic force microscopy, Surface Science Letters 1993, 290b(1-2), L688–L692.
- Surfaces, B.N., Tapping AFM-IR Provides High-Resolution Chemical Imaging 2019.
- Mathurin, J., Pancani, E., Deniset-Besseau, A., Kjoller, K., Prater, C.B., Gref, R., and Dazzi, A., How to unravel the chemical structure and component localization of individual drug-loaded polymeric nanoparticles by using tapping AFM-IR, Analyst 2018, 143 (24), 5940–5949.