Ce premier article du dossier L'AFM-IR : présentation et exemples d'application explique le principe de cette technique, développée il y a une quinzaine d'années.
Introduction
La spectroscopie infrarouge (IR) est une technique d’analyse couramment utilisée. Elle permet de sonder les vibrations moléculaires d’une large variété d’échantillons, permettant ainsi d’identifier des fonctions chimiques particulières. La spectroscopie IR est souvent couplée à la microscopie optique, on l’appelle alors microspectroscopie infrarouge. Elle permet de réaliser des mesures localisées dans l’espace, mais l’inconvénient majeur de la micro-spectroscopie infrarouge est sa résolution limitée (entre 3 et 10 μm), due à la diffraction de la lumière .
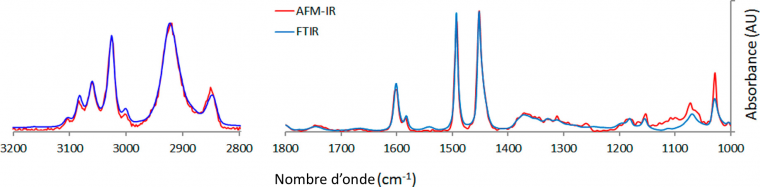
Il y a une quinzaine d'années, une nouvelle technique, appelée AFM-IR, a été développée et brevetée par Alexandre Dazzi, professeur à l’Institut de Chimie-Physique de l’université Paris-Saclay. Elle permet de coupler la résolution spatiale de la microscopie à force atomique (AFM) et la capacité d'analyse chimique de la spectroscopie infrarouge (IR). Cette technique permet de localiser des composés grâce à leur signature IR avec une résolution qui est celle de l'AFM, de l'ordre de la dizaine de nanomètres. Cette technique offre ainsi la possibilité de réaliser de l'imagerie chimique en traçant des cartes d'absorption dans l'IR à une longueur d'onde donnée. Elle permet aussi d'enregistrer des spectres infrarouge locaux en des points fixes. Sur la figure 1, des spectres de polystyrène obtenus par AFM-IR sont comparés à des spectres obtenus classiquement en spectroscopie IR à transformée de Fourier (FT-IR).
Reprinted with permission from Dazzi, A. and Prater, C.B., AFM-IR : Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging, Chemical Reviews 2017, 117 (7), 5146– 5173. Copyright 2017 American Chemical Society.
Effet photothermique
L'équipe d'Alexandre Dazzi a particulièrement utilisé cette technique pour cartographier des systèmes biologiques à l'échelle de la cellule unique en réalisant des cartes de composés endogènes1 (ADN, protéines, lipides, virus) dans des échantillons biologiques (cellules, bactéries). Avec l'équipe de Clotilde Policar, professeure au laboratoire des BioMolécules à l’École normale supérieure, ils ont aussi montré en 2011 la possibilité de cartographier des molécules exogènes (c'est-à-dire venant de l’extérieur) internalisées après incubation (voir le 2ème article du dossier).
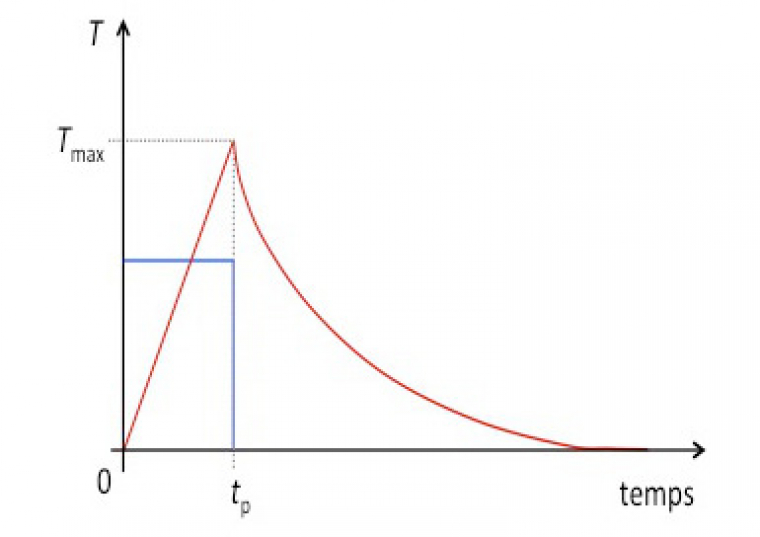
Cette technique met à profit l'effet photothermique. Un échantillon d'intérêt est illuminé, grâce à un laser IR pulsé, à une longueur d'onde correspondant à une bande d'absorption de l'objet à imager. Lorsque l'onde IR est absorbée par une molécule, celle-ci passe dans un état vibrationnel excité. La seule dissipation d’énergie est alors thermique : c'est l'effet photothermique, qui se traduit par une augmentation locale de la température. Ce phénomène provoque une dilatation instantanée locale et une déformation de l’échantillon, que l'on détecte en AFM-IR par la pointe AFM. La dilatation thermique augmente jusqu'à la fin de l'impulsion laser : la pointe AFM subit un choc et le levier se met alors à osciller selon ses modes propres. Puis la température de l'échantillon décroît de manière exponentielle jusqu'à atteindre la température ambiante, à une vitesse qui dépend des propriétés thermiques de l'échantillon (Figure 2). Le levier revient au repos avant une nouvelle impulsion du laser qui opère à une fréquence de 1 kHz à 1 MHz selon le laser.
L'augmentation de température est linéaire durant l'impulsion puis décroît de manière exponentielle.
D'après Dazzi, A. and Prater, C.B., AFM-IR : Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging, Chemical Reviews 2017, 117(7), 5146– 5173. Adaptée par Lucas Henry.
L'analyse des oscillations du levier permet de déduire l'absorption locale de l'échantillon. L'amplitude de ces oscillations est directement liée à la quantité de radiations infrarouge absorbées par l'échantillon. Ainsi, les spectres d'absorption obtenus par cette technique sont similaires à ceux obtenus en transmission (FT-IR), car la technique AFM-IR mesure la même chose - à savoir la quantité de lumière absorbée - comme indiqué Figure 1.
La vidéo ci-dessous illustre le processus mis en jeu (consulter celle-ci entre les instants 0:32 et 1:24).
Dispositifs
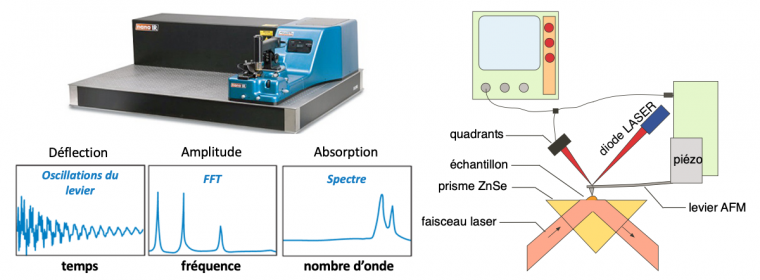
Trois appareils, commercialisés par la société Bruker, existent actuellement. Dans le premier, appelé nanoIR1, l'échantillon est monté sur un prisme en séléniure de zinc (ZnSe), transparent au rayonnement infrarouge, afin qu'il puisse être excité par une onde évanescente1 à un angle de 45° par rapport à la surface. Comme pour la technique ATR (réflexion totale atténuée), l'échantillon est illuminé en réflexion totale interne (Figure 4). L'échantillon peut aussi être préparé sur une lamelle de fluorure de calcium (CaF2), transparente elle aussi dans l'IR, que l'on met au contact du prisme : cela est plus simple pour préparer certains échantillons, comme ceux de cellules en culture.
L'instrument utilise une source laser infrarouge pulsée fondée sur un oscillateur paramétrique optique (OPO). Si la longueur d'onde du laser correspond à une bande d'absorption en infrarouge, la lumière absorbée induit un effet photothermique.
Différentes sources peuvent être utilisées : le rayonnement synchrotron, un laser constitué d'un oscillateur paramétrique optique (OPO), ou un laser à cascade quantique (QCL) qui est un laser à semi-conducteur. La source OPO (4000-1000 cm–1) permet l'observation d'échantillons de l'ordre de 50 à 100 nm de large, avec une résolution spectrale de l'ordre de 4 à 8 cm–1. Une pulsation de 5 à 20 ns est produite avec une fréquence de 1 kHz maximum. La durée de la pulsation et le temps de relaxation associé à la diffusion thermique sont inférieurs au temps de réponse du levier (10-50 µs). La fréquence de 1 kHz correspond à une excitation du levier toutes les 1 ms. Étant donné que le levier retourne à sa position initiale au bout de 0,5 ms, chaque pulsation agit de manière indépendante sur le levier, comme expliqué plus haut.
La source QCL peut émettre de l'infrarouge moyen à l'infrarouge lointain (1960-890 cm–1) avec une résolution spectrale inférieure à 0,5 cm–1. Bien que sa plage de nombres d'onde accessibles soit plus limitée, le laser QCL est très intéressant pour l'AFM-IR car il possède une fréquence de tir ajustable de 0,1 Hz à 2 MHz. Ainsi, il est possible de synchroniser la fréquence de tir du laser avec les fréquences de résonance du levier : c'est ce qu’on appelle le mode résonant. Avec ces conditions, le levier oscille de manière continue à la fréquence choisie, ce qui produit une excitation bien plus efficace et par conséquent permet d'obtenir une meilleure sensibilité (d’au moins un ordre de grandeur).
Les inconvénients du nanoIR1 sont que ce dispositif n'est optimal que pour des échantillons de moins de 1 µm d'épaisseur s'ils sont montés sur le prisme de ZnSe (mais sans limite d'épaisseur sur lamelles de CaF2) et qu'une bonne adhésion de l'échantillon au prisme ou aux lamelles de CaF2 est nécessaire car l'utilisation se fait en mode contact : la pointe appuie légèrement sur la surface et l’appareil mesure la déviation pour donner la hauteur de l’échantillon. La pointe risque donc d'entraîner un échantillon qui a une mauvaise adhérence.
Récemment, deux nouveaux dispositifs, appelés nanoIR2 et nanoIR3, permettant une illumination directe par le laser par le dessus, ont été développés (Figure 5). Un de ses avantages est qu'il possède, en plus du mode contact résonant, le mode tapping, c’est-à-dire que le levier vibre à sa fréquence propre de résonance et son amplitude d’oscillation diminue au contact de l’échantillon. Ce mode est idéal pour des échantillons épais ou pour des nanoparticules qui peuvent se déplacer sous la pointe en mode contact (voir le 3ème article du dossier).
Bibliographie
- Murugesapillai, D., McCauley, M.J., Maher, L.J., and Williams, M.C., Single-molecule studies of high-mobility group B architectural DNA bending proteins, Biophysical Reviews 2017, 9 (1), 17–40.
- Henry, L., Bacle, P., and Rossi-Gendron, C., La Microscopie à Force Atomique pour l’observation de molécules avec une résolution atomique 2016
- Binnig, G., Quate, C.F., and Gerber, C., Atomic Force Microscope, Physical Review Letters 1986, 56 (9), 930–933.
- Policar, C., Waern, J., Plamont, M., Clède, S., Mayet, C., Prazeres, R., Ortega, J.M., Vessières, A., and Dazzi, A., Subcellular Imaging in the Mid-IR of a Metal-Carbonyl Moiety Using Photothermal Induced Resonance, Angewandte Chemie International Edition 2011, 50, 860–864.
- Dazzi, A. and Prater, C.B., AFM-IR : Technology and Applications in Nanoscale Infrared Spectroscopy and Chemical Imaging, Chemical Reviews 2017, 117 (7), 5146– 5173.
- Dazzi, A., Kjoller, K., and Reading, M., High Frequency Deflection Measurement of IR Absorption 2008.
- Dazzi, A., Konstantin, V., Policar, C., Reading, M., Kjoller, K., and Prater, C.B., High Frequency Deflection Measurement of IR Absorption 2012.
- Dazzi, A. and Policar, C., Chapter 9 - AFM-IR : photothermal infrared nanospectroscopy : Application to cellular imaging, in C. Pradier and Y. Chabal, editors, Biointerface Characterization by Advanced IR Spectroscopy, pages 245 – 278, Elsevier, Amsterdam 2011, doi :https://doi.org/10.1016/B978-0-444-53558-0.00009-6.
- Dazzi, A., Prater, C.B., Hu, Q., Chase, D.B., Rabolt, J.F., and Marcott, C., AFM- IR : Combining Atomic Force Microscopy and Infrared Spectroscopy for Nanoscale Chemical Characterization, Applied Spectroscopy 2012, 66 (12), 1365–1384.
- Dazzi, A., PhotoThermal Induced Resonance. Application to Infrared Spectromicroscopy, in Thermal Nanosystems and Nanomaterials, pages 469–503, Springer Berlin Heidelberg 2009, doi :10.1007/978-3-642-04258-4_16.
- Dazzi, A., Glotin, F., and Carminati, R., Theory of infrared nanospectroscopy by photothermal induced resonance, Journal of Applied Physics 2010, 107 (12), 124519.
- Prater, C.B., Kjoller, K., Shetty, R., and Dazzi, A., Spectroscopy : AFM improves resolution of IR spectroscopy, Laser Focus World 2011, 47, 52–54.
- Mayet, C., Deniset-Besseau, A., Prazeres, R., Ortega, J.M., and Dazzi, A., Analysis of bacterial polyhydroxybutyrate production by multimodal nanoimaging, Biotechnology advances 2013, 31 (3), 369–374.
- Dazzi, A., Prazeres, R., Glotin, F., and Ortega, J., Subwavelength infrared spectro- microscopy using an AFM as a local absorption sensor, Infrared Physics & Technology 2006, 49 (1), 113 – 121.
- Mayet, C., Dazzi, A., Prazeres, R., Allot, F., Glotin, F., and Ortega, J.M., Sub-100 nm IR spectromicroscopy of living cells, Optics Letters 2008, 33 (14), 1611.
- Mayet, C., Dazzi, A., Prazeres, R., Ortega, J.M., and Jaillard, D., In situ identification and imaging of bacterial polymer nanogranules by infrared nanospectroscopy, Analyst 2010, 135, 2540–2545.
- Dazzi, A., Prazeres, R., Glotin, F., and Ortega, J.M., Local infrared microspectroscopy with subwavelength spatial resolution with an atomic force microscope tip used as a photothermal sensor, Optics Letters 2005, 30 (18), 2388.
- Hillard, E., Vessières, A., Thouin, L., Jaouen, G., and Amatore, C., Ferrocene- Mediated Proton-Coupled Electron Transfer in a Series of Ferrocifen-Type Breast-Cancer Drug Candidates, Angewandte Chemie International Edition 2006, 45 (2), 285–290.
- Keppler, B.K., Metal Complexes in Cancer Chemotherapy, Wiley-VCH, Weinheim 1993.
- Jackson, A., Davis, J., Pither, R.J., Rodger, A., and Hannon, M.J., Estrogen-Derived Steroidal Metal Complexes : Agents for Cellular Delivery of Metal Centers to Estrogen Receptor-Positive Cells, Inorganic Chemistry 2001, 40 (16), 3964–3973.
- Top, S., Kaloun, E.B., Vessières, A., Leclercq, G., Laïos, I., Ourevitch, M., Deuschel, C., McGlinchey, M.J., and Jaouen, G., Tamoxifen Derivatives for Delivery of the Antitumoral (DACH)Pt Group : Selective Synthesis by McMurry Coupling, and Biochemical Behaviour, ChemBioChem 2003, 4 (8), 754–761.
- Cassino, C., Gabano, E., Ravera, M., Cravotto, G., Palmisano, G., Vessières, A., Jaouen, G., Mundwiler, S., Alberto, R., and Osella, D., Platinum(II) and technetium(I) complexes anchored to ethynylestradiol : a way to drug targeting and delivery, Inorganica Chimica Acta 2004, 357 (7), 2157 – 2166.
- Jaouen, G., Top, S., Vessières, A., Leclercq, G., and McGlinchey, M.J., The First Organometallic Selective Estrogen Receptor Modulators (SERMs) and Their Relevance to Breast Cancer, Current Medicinal Chemistry 2004, 11 (18), 2505–2517.
- Jaouen, G., Vessières, A., and Top, S., Ferrocifen type anti cancer drugs, Chemical Society Reviews 2015, 44 (24), 8802–8817.
- Wang, Y., Pigeon, P., Top, S., McGlinchey, M.J., and Jaouen, G., Organometallic Antitumor Compounds : Ferrocifens as Precursors to Quinone Methides, Angewandte Chemie International Edition 2015, 54 (35), 10230–10233.
- Fery-Forgues, S. and Delavaux-Nicot, B., Ferrocene and ferrocenyl derivatives in luminescent systems, Journal of Photochemistry and Photobiology A : Chemistry 2000, 132 (3), 137 – 159.
- Hostachy, S., Policar, C., and Delsuc, N., Re(I) carbonyl complexes : Multimodal platforms for inorganic chemical biology, Coordination Chemistry Reviews 2017, 351, 172–188.
- Clède, S. and Policar, C., Metal-carbonyl units for vibrational and luminescence imaging : towards multimodality, Chemistry - A European Journal 2015, 21 (3), 942–58.
- Hildebrandt, P., A Spectral Window to the Cell, Angewandte Chemie International Edition 2010, 49(27), 4540–4541.
- Clède, S., Lambert, F., Sandt, C., Kascakova, S., Unger, M., Harte, E., Plamont, M.A., Saint-Fort, R., Deniset-Besseau, A., Gueroui, Z., Hirschmugl, C., Lecomte, S., Dazzi, A., Vessieres, A., and Policar, C., Detection of an estrogen derivative in two breast cancer cell lines using a single core multimodal probe for imaging (SCoMPI) imaged by a panel of luminescent and vibrational techniques, Analyst 2013, 138 (19), 5627–38.
- Clède, S., Lambert, F., Sandt, C., Gueroui, Z., Delsuc, N., Dumas, P., Vessières, A., and Policar, C., Synchrotron radiation FTIR detection of a metal-carbonyl tamoxifen analog. Correlation with luminescence microscopy to study its subcellular distribution, Biotechnology Advances 2013, 31 (3), 393–395.
- Wang, Y., Heinemann, F., Top, S., Dazzi, A., Policar, C., Henry, L., Lambert, F., Jaouen, G., Salmain, M., and Vessières, A., Ferrocifens labelled with an infrared rhenium tricarbonyl tag : synthesis, antiproliferative activity, quantification and nano IR mapping in cancer cells, Dalton Transactions 2018, 47, 9824–9833.
- Zhong, Q., Inniss, D., Kjoller, K., and Elings, V., Fractured polymer/silica fiber surface studied by tapping mode atomic force microscopy, Surface Science Letters 1993, 290b(1-2), L688–L692.
- Surfaces, B.N., Tapping AFM-IR Provides High-Resolution Chemical Imaging 2019.
- Mathurin, J., Pancani, E., Deniset-Besseau, A., Kjoller, K., Prater, C.B., Gref, R., and Dazzi, A., How to unravel the chemical structure and component localization of individual drug-loaded polymeric nanoparticles by using tapping AFM-IR, Analyst 2018, 143 (24), 5940–5949.