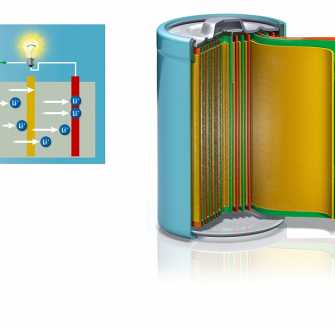
Cet article en deux volets présente l'historique des batteries depuis leur création à nos jours.
Le premier volet (ci-dessous) s'attache à donner les définitions et grandeurs caractéristiques d'une batterie, ainsi que l'historique des technologies utilisées pour les batteries du XIXème siècle jusqu'aux années 1970, avec la technologie lithium métal.
Le deuxième volet s'attache à décrire les batteries lithium-ion et les futurs systèmes (ceux utilisant le lithium et ceux proposant une alternative à cet élément, comme l'élément sodium).
Introduction
Le stockage de l’énergie est devenu un enjeu mondial et un défi majeur. En effet, depuis les années 1980, la consommation mondiale annuelle de pétrole est devenue supérieure aux quantités des nouveaux gisements découverts [1]. Il est donc nécessaire de se tourner vers d’autres sources d’énergies, comme les énergies renouvelables, et de développer des technologies pour le stockage de ces énergies afin de mieux gérer ces ressources. Les efforts pour réduire la consommation de pétrole se sont portés sur les transports, notamment via le développement de véhicules électriques et de batteries. Si les batteries Lithium-ion (Li-ion) sont maintenant répandues pour les applications portables comme les ordinateurs et les téléphones mobiles, il y a néanmoins des limitations technologiques pour les applications de grande échelle aux véhicules électriques et au stockage de surplus de production d’énergie [1]. De plus, les coûts de certains éléments comme le cobalt (un des constituants utilisé comme matrice support dans les batteries) et le lithium sont élevés et le recyclage des batteries Li-ion pose de nombreux problèmes techniques mais aussi écologiques à cause de la toxicité des métaux qu’elles contiennent. Les procédés actuels ne sont pas économiquement intéressants pour les industriels du secteur de l’énergie et seulement 50 % des batteries Li-ion sont aujourd’hui recyclées comme stipulé par la directive européenne 2006/66/CE.
Définition et grandeurs caractéristiques
Un accumulateur est un système physico-chimique réversible pouvant convertir l’énergie chimique en énergie électrique grâce à des réactions d’oxydoréduction. L’énergie électrique est stockée sous forme d’énergie chimique lorsque le système est en mode accumulateur (le système est en mode charge) puis restituée sous forme d’énergie électrique lorsqu’il se trouve en mode générateur (le système est alors en décharge)[2]. Une batterie est définie en général par l’association de plusieurs accumulateurs.
Une batterie (souvent indifférenciée avec le terme accumulateur par abus de langage) est composée d’une cathode où se déroule la réduction des métaux et d’une anode pour l’oxydation des métaux, ces électrodes sont imprégnées par un électrolyte conducteur pour permettre la circulation des ions. Le séparateur sert à éviter au maximum les courts-circuits dans la batterie.
Suivant le mode dans lequel se trouve la batterie (accumulateur ou générateur), les noms des électrodes s’inversent (Figure 1). Par souci d’homogénéité, dans cet article, la batterie sera toujours considérée en mode générateur (décharge) et la cathode sera toujours l’électrode positive où se déroule la réduction, quelles que soient les conventions utilisées dans les différentes publications citées.
Une batterie est caractérisée par sa force électromotrice (fem), notée ΔE, qui s’exprime en Volts et dépend de la nature des couples d’oxydo-réduction des matériaux présents et de l’avancement de la réaction. Il s’agit de la différence des potentiels de travail des deux électrodes. L’autre grandeur caractéristique est la capacité (Q) exprimée en Coulomb ou plus souvent pour les batteries en Ampère-heure (Ah). Cette grandeur dépend de la nature des couples rédox et des quantités de matière des différentes espèces impliquées dans les réactions redox [4].
On caractérise et compare usuellement les batteries en utilisant leur énergie spécifique exprimée en Wh/kg (ou Wh/L). Cette énergie spécifique est le produit de la fem et de la capacité, elle représente la quantité d’énergie pouvant être délivrée par la batterie par unité de masse (ou de volume). On peut également exprimer leur capacité spécifique en mAh/g, cela représente la charge électrique que la batterie peut fournir d’un état complètement chargé jusqu’à sa décharge complète, par unité de masse. La durée de vie d’une batterie est estimée par sa cyclabilité, c’est-à-dire le nombre moyen de cycle charge/décharge qu’elle peut effectuer.
Historique
Les premiers systèmes électrochimiques sont les piles ou systèmes primaires non rechargeables tel que la pile Volta, créée en 1801. Il existe aujourd’hui une grande diversité de piles. Dans la suite de cet article, nous allons nous focaliser sur les systèmes rechargeables uniquement (Figure 2).
Le premier accumulateur, ou batterie par abus de langage, est l’accumulateur au plomb, mis au point par Gaston Planté, chimiste français, en 1859 (Figure 3).
Cette batterie a pour principal avantage son coût peu élevé ; néanmoins sa faible énergie spécifique (20 à 35 Wh/kg) et sa faible cyclabilité (200 à 300 cycles) (Tableau 1) ne permettent pas beaucoup d’autres applications qu’un usage dans les véhicules thermiques traditionnels [2,4].
Dans les années 1900, les batteries de Nickel-Cadmium (Ni-Cd) sont développées, et plusieurs dérivés apparaissent comme les batteries Nickel-Zinc (Ni-Zn), Nickel-Fer (Ni-Fe) et Nickel-Hydrogène (Ni-H2), entre autres. Cette génération de batteries commercialisées à partir des années 1940 présente une bien meilleure cyclabilité et une énergie spécifique supérieure en comparaison des batteries au Plomb [2]. (Tableau 1) Ces batteries présentent la même cathode d’insertion en nickel et le même électrolyte aqueux (KOH), seule l’anode varie avec les différents types de batteries.
En 1988, la batterie Nickel-Métal Hydrure (Ni-MH), toujours dérivée de la batterie Ni-Cd, pose les bases des batteries Li-ion actuelles en étant constituée de deux électrodes d’insertions. En effet, jusqu’à l’invention de cette batterie il y avait toujours « consommation » d’une des électrodes au cours du fonctionnement de la batterie (par exemple consommation de l’anode en cadmium dans une batterie Ni-Cd, lors de la décharge). La cathode reste la même par rapport aux modèles Ni-Cd, en revanche l’anode est maintenant composée d’un alliage M ayant la capacité d’absorber et de désorber l’hydrogène. Cet alliage est généralement un intermétallique de type LaNi5 ou de type TiNi (Figure 4).
Dans une batterie Ni-MH, les réactions aux électrodes sont, lors de la décharge :
- A l’anode : xOH− + MHx = xH2O + M + xe−
- A la cathode : NiO(OH) + H2O + e− = Ni(OH)2 + OH−
L’équation de la réaction globale de fonctionnement de la batterie est donc, lors de la décharge :
xNiO(OH) + MHx = M + xNi(OH)2, qui ne consomme pas de métal (ni M, ni Ni).
Cette technologie est encore commercialisée notamment sous la forme d’accumulateur « bâtons ».
Malgré le coût élevé des matériaux constitutifs de l’anode et une énergie spécifique relativement faible (80 Wh/kg), ce type de batteries servit pour la première voiture hybride (Toyota Prius), commercialisée en 1997 [4,5].
| Type | Energie spécifique en Wh/kg | Capacité spécifique en mAh/g | Fem en V | Cyclabilité |
|---|---|---|---|---|
| Batterie au Plomb | 20-35 | 9,5 | 2 | 200-300 |
|
Ni-Cd et dérivés (Ni-Fe; Ni-Zn) |
50-80 | 41,7 | 1,3 | >1000 |
| Nickel-Métal Hydrure | 80 | 62,5 | 1,3 | 600 |
| Li-métal | 200 | 100 | 3,5 | 400-500 |
| Li-polymère | 120 | 33,3 | 3,7 | 300-600 |
| Li-ion | 150-250 | 60-300 | 3,6 | 500-2000 |
Tableau 1. Différents types de batteries et leurs grandeurs caractéristiques.
Avec le développement des batteries à électrode d’intercalation, l’idée d’utiliser du lithium, le plus petit des métaux, fait son apparition et permet d’augmenter la fem des batteries. Cela donne naissance dans les années 1970 aux premières batteries lithium métal. Ces batteries possèdent une anode de lithium métallique, une cathode avec un composé d’insertion tel que MoS2 et un électrolyte organique contenant un sel de lithium. Le remplacement de l’électrolyte aqueux KOH par une solution organique a été nécessaire car le lithium est un élément qui s’hydrolyse facilement en présence d’eau. Lors de la décharge, les réactions se produisant aux électrodes sont :
- À l’anode : Li(s) = Li+ + e− (oxydation du lithium)
- À la cathode : xLi+ + MoS2(s) + xe− = MoS2Lix(s) (réduction des ions Li+ en atomes Li avec insertion dans le composé d’insertion MoS2)
L’énergie spécifique de ces batteries est plus que doublée par rapport aux modèles précédents (Tableau 1). Néanmoins la production et la vente sont arrêtées à la fin des années 1980 pour des problèmes de sécurité rencontrés lors de leur utilisation. En effet, lors de la charge de la batterie, la réduction d’ions Li+ en Li a lieu au niveau de l’électrode de lithium ; cette réduction pouvait occasionner la formation de dendrites à partir de l’anode en lithium au cours de la charge de la batterie (sorte de filaments de lithium, voir Figure 5). Ces dendrites finissaient par toucher la cathode, ce qui provoquait un court-circuit et parfois même l’explosion de la batterie comme cela s’est produit au Japon au sein de téléphones [6].
Suite à cela, la technologie au lithium ne fût pas abandonnée, bien au contraire ; deux solutions principales pour la sécurité furent développées : la technologie lithium-polymère (Li-Po) et la technologie Li-ion. Les batteries Li-Po sont pratiquement identiques aux batteries lithium métal : en effet, les électrodes ne changent pas et l’anode en métal est conservée. L’électrolyte liquide est quant à lui remplacé par un électrolyte polymère qui limite fortement la formation de dendrites mais qui a le désavantage de limiter la mobilité des ions lithium d’une électrode à l’autre et donc l’énergie spécifique de la batterie (Tableau 1) [7]. La technologie Li-ion, la plus prometteuse en termes d’énergie spécifique et de cyclabilité, sera quant à elle détaillée dans le deuxième volet de cet article. La plupart des modèles sur le marché actuellement et en cours de développement peuvent être rattachés à la technologie Li-ion, cependant de nombreux problèmes et limitations empêchent encore des applications à plus large échelle telles que les applications réseaux ou les véhicules.

Références (communes aux deux volets)
[1] J.M. Tarascon, Enjeux et défis du stockage électrochimique de l’énergie, (2014)
[2] M. Joulié, Mécanismes de dissolution de matériaux actifs d’électrodes de type LiNi1/3Mn1/3Co1/3O2 d’accumulateurs Li-ion en vue de leur recyclage, Ecole Nationale Supérieure de Chimie Montpellier, 2015.
[3] Site Culture Sciences de l'Ingénieur (DGESCO-ENS Paris-Saclay)
[4] J.M. Tarascon, Histoire et évolution des technologies d’accumulateurs, (2011).
[5] Nickel-based Batteries Information – Battery University, (n.d.). (accessed August 24, 2016).
[6] Lithium-based Batteries Information – Battery University, (n.d.). (accessed August 24, 2016).
[7] Li-polymer Battery: Substance or Hype? – Battery University, (n.d.). (accessed August 24, 2016).
[8] N. Nitta, F. Wu, J.T. Lee, G. Yushin, Li-ion battery materials: present and future, Mater. Today. 18 (2015) 252–264. doi:10.1016/j.mattod.2014.10.040.
[9] Types of Lithium-ion Batteries – Battery University, (n.d.). (accessed August 24, 2016).
[10] K. Mizushima, P.C. Jones, P.J. Wiseman, J.B. Goodenough, LixCoO2.
[11] A. Rougier, Optimization of the Composition of the Li[sub 1−z]Ni[sub 1+z]O[sub 2] Electrode Materials: Structural, Magnetic, and Electrochemical Studies, J. Electrochem. Soc. 143 (1996) 1168. doi:10.1149/1.1836614.
[12] A.R. Armstrong, P.G. Bruce, Synthesis of layered LiMnO2 as an electrode for rechargeable lithium batteries, Nature. 381 (1996) 499–500. doi:10.1038/381499a0.
[13] C.H. Chen, J. Liu, M.E. Stoll, G. Henriksen, D.R. Vissers, K. Amine, Aluminum-doped lithium nickel cobalt oxide electrodes for high-power lithium-ion batteries, J. Power Sources. 128 (2004) 278–285. doi:10.1016/j.jpowsour.2003.10.009.
[14] K.M. Shaju, P.G. Bruce, Macroporous Li(Ni1/3Co1/3Mn1/3)O2: A High-Power and High-Energy Cathode for Rechargeable Lithium Batteries, Adv. Mater. 18 (2006) 2330–2334. doi:10.1002/adma.200600958.
[15] A. Yamada, S.C. Chung, K. Hinokuma, Optimized LiFePO[sub 4] for Lithium Battery Cathodes, J. Electrochem. Soc. 148 (2001) A224. doi:10.1149/1.1348257.
[16] Experimental Rechargeable Batteries – Battery University, (n.d.). (accessed August 24, 2016).
[17] M.-S. Park, J.-G. Kim, Y.-J. Kim, N.-S. Choi, J.-S. Kim, Recent Advances in Rechargeable Magnesium Battery Technology: A Review of the Field’s Current Status and Prospects, Isr. J. Chem. 55 (2015) 570–585. doi:10.1002/ijch.201400174.
[18] Y. Wang, R. Chen, T. Chen, H. Lv, G. Zhu, L. Ma, C. Wang, Z. Jin, J. Liu, Emerging non-lithium ion batteries, Energy Storage Mater. 4 (2016) 103–129. doi:10.1016/j.ensm.2016.04.001.
[19] X. Xiang, K. Zhang, J. Chen, Recent Advances and Prospects of Cathode Materials for Sodium-Ion Batteries, Adv. Mater. 27 (2015) 5343–5364. doi:10.1002/adma.201501527.
[20] P. Saha, M.K. Datta, O.I. Velikokhatnyi, A. Manivannan, D. Alman, P.N. Kumta, Rechargeable magnesium battery: Current status and key challenges for the future, Prog. Mater. Sci. 66 (2014) 1–86. doi:10.1016/j.pmatsci.2014.04.001.
[21] Batterie sodium-ion: une révolution en marche | CNRS Le journal (n.d.). (accessed August 25, 2016).