Les énergies renouvelables, solaire et éolienne, sont destinées à constituer des éléments majeurs de notre mix énergétique, à la place des énergies fossiles et nucléaire. Leur inconvénient principal réside dans leur intermittence, qui peut être résolu en partie par le développement de technologies de stockage d’énergie, électrochimique et chimique. La photosynthèse naturelle, un processus qui permet à certains organismes vivants dits photosynthétiques d’utiliser l’énergie du soleil pour convertir l’eau et le dioxyde de carbone en oxygène, hydrogène et en molécules carbonées riches en énergie (la biomasse), constitue une source d’inspiration fascinante. Certains dispositifs de stockage d’énergie de demain mettront en œuvre une photosynthèse artificielle dont les principes sont décrits dans cet article.
Introduction
Un jour viendra où l’humanité ne dépendra plus de l’énergie nucléaire et des énergies fossiles pour faire tourner les moteurs des sociétés humaines mais, massivement, des énergies dites renouvelables, en tout premier lieu les énergies solaire et éolienne. La chimie joue et jouera un rôle majeur dans l’élaboration des nouvelles technologies énergétiques de ce monde nouveau [1]. Parmi elles, celles qui permettent l’exploitation du soleil sont les plus prometteuses, car ce dernier est à même de fournir l’énergie nécessaire à l’humanité d’une façon propre, durable, pendant des milliards d’années (une puissance solaire de 100000 TW frappe la planète, 7000 fois la puissance consommée par ses habitants).
L’un des problèmes des énergies renouvelables est leur intermittence et la nécessité, qui en découle, de mettre au point des technologies pratiques et économiques de stockage d’énergie. Pendant une partie importante de l’année (en particulier l’été) la production d’électricité solaire est plus importante que la quantité utilisée réellement. En l'absence de technologies de stockage, l’excès d’électricité est perdu. Pendant l’autre partie de l’année (l’hiver ou la nuit ou les jours nuageux), c’est l’inverse qui se produit : le manque d’électricité solaire doit être compensé par l’énergie stockée si elle existe (c’est le scénario le plus vertueux), sinon par de l’énergie provenant de centrales thermiques (fonctionnant aux carburants fossiles) si les capacités de stockage d’énergie sont insuffisantes. Par ailleurs, cette intermittence rend problématique l’incorporation de l’énergie solaire dans le réseau électrique général. Celui-ci ne fonctionne que si les entrées et les sorties sont constamment équilibrées. C’est donc à grande échelle qu’il faut développer de nouvelles technologies de stockage électrochimique (les batteries) et de stockage chimique (la décomposition de l’eau en hydrogène et en oxygène et la conversion du dioxyde de carbone en molécules carbonées) de ces énergies renouvelables intermittentes.
Plus particulièrement, inspirés par la photosynthèse naturelle, à l’œuvre dans les micro-algues et les plantes et qui convertit l'énergie des photons du soleil en énergie chimique (via toute la biomasse qui nous entoure et l’oxygène de l’air), les chimistes ont l’ambition d’inventer des dispositifs électrochimiques qui réalisent une forme de photosynthèse, appelée « photosynthèse artificielle » [2-4]. Demain, ces dispositifs utiliseront l’énergie solaire pour transformer l’eau en hydrogène ou le dioxyde de carbone en molécules carbonées riches en énergie, stockant en quelque sorte le soleil dans des bonbonnes d’hydrogène ou d’hydrocarbures. Le stockage chimique, à travers la mise au point de dispositifs de photosynthèse artificielle, constitue l’essentiel des pages qui suivent.
La photosynthèse naturelle et les biocarburants
Qu’est-ce-que la photosynthèse ?
Le soleil est la source de toute vie sur la terre. C’est l’énergie qui alimente la nature, les animaux et les hommes. Il en est de même pour le dioxyde de carbone (CO2) présent dans l’atmosphère terrestre. Le monde vivant est carboné, grâce au CO2, à l’eau et au soleil combinés. C’est cette chimie, encore mystérieuse, qui rassemble la nature et l’homme dans un cycle biologique vertueux, photosynthèse pour la première et respiration pour le second. Depuis longtemps, biologistes et chimistes sont fascinés par ce processus naturel complexe qui permet aux organismes, dits photosynthétiques, comme les plantes, les algues ou les cyanobactéries, de fixer le CO2 de l’atmosphère, en dépit de sa faible concentration, de capter l’énergie solaire et de la stocker sous forme d’énergie chimique à travers la transformation du CO2 fixé. Cette énergie chimique est contenue dans les liaisons chimiques des produits carbonés, comme le glucose et d’autres milliers de molécules (la biomasse en quelque sorte), formés à partir de CO2 et d’eau. Ce sont ces molécules carbonées, riches en énergie, qui fournissent en retour aux cellules l’énergie nécessaire pour leurs métabolismes, les biosynthèses et leur réplication. Dans certaines conditions métaboliques, chez certaines cyanobactéries par exemple, ce stockage chimique peut prendre la forme d’hydrogène H2, formé à partir de l’eau uniquement.
Les mécanismes de la photosynthèse
Essayons d’expliquer le plus simplement possible les mécanismes de la photosynthèse (Figure 1).
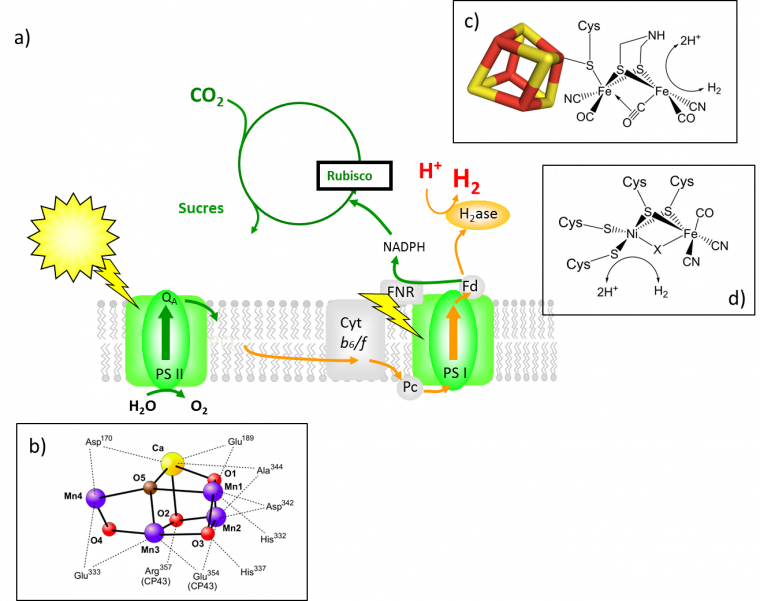
a) Schéma de la photosynthèse naturelle : les photons solaires sont captés par les photosystèmes, PSII et PSI, et créent une séparation de charges. Les trous servent à oxyder l’eau en O2 tandis que les électrons excités réduisent les protons en H2 ou le CO2 en sucres par exemple. b) Site actif du cluster Mn4CaO5 du photosystème II (PSII). c) Structure du site actif d’une hydrogénase (H2ase) de la classe des [FeFe]-H2ase ; il faut noter le ligand pontant dithiomethylamine ; le polyèdre représente un cluster fer-soufre (atomes de fer en marron et atomes de soufre en jaune). d) Structure du site actif d’une [NiFe]-H2ase.
Les organismes photosynthétiques possèdent, au sein de leurs membranes, un système multiprotéique complexe, appelé photosystème II (PSII), qui contient de nombreuses molécules dites photosensibilisatrices : chlorophylles, carotènes, phéophytines, etc... Ces molécules colorées possèdent la propriété de capter les photons solaires, l’énergie d’un photon ainsi absorbée conduisant à exciter un électron. PSII se trouve ainsi porteur d’une charge négative (électron) et d’une charge positive (trou), séparés physiquement : une paire « électron-trou » à haute énergie (celle du photon solaire). Le tour de force de PSII, c’est cette capacité à séparer très vite ces charges qui n’ont qu’une envie, celle de se recombiner, recombinaison qui anéantirait la photosynthèse en transformant simplement et inutilement l’énergie solaire en chaleur. Ce processus de séparation de charges se produit plusieurs fois. PSII a donc la capacité d’accumuler quatre trous sur un cluster de manganèse et de calcium (cadre b ; Figure 1), où ils se combinent pour transformer deux molécules d’eau en oxygène moléculaire, O2, qui s’échappe dans l’atmosphère et qui est celui que nous respirons. A l’autre bout, les électrons parcourent un long trajet (on parle de chaine de transfert d’électrons) au cours duquel ils perdent de l’énergie. C’est pour cette raison qu’il existe un second photosystème (PSI) qui permet d’utiliser un second photon solaire pour « ré-énergiser » les électrons circulant. Ceux-ci ont alors suffisamment d’énergie pour atteindre et transformer leurs cibles : soit d’autres molécules d’eau pour les convertir en H2, soit des molécules de CO2 pour les convertir en molécules carbonées (1 kg de CO2 conduit à 0,6 kg de biomasse en moyenne). C’est donc l’énergie contenue dans les premiers états de séparation de charges, elle-même issue des photons solaires, qui permet ces transformations complexes. Par ailleurs, comme toutes les réactions mises en jeu sont multi-électroniques et multi-protoniques, elles ne peuvent se produire avec des vitesses significatives que grâce à des catalyseurs. Les sites catalytiques enzymatiques utilisés par les organismes vivants sont eux-mêmes fascinants, qu’il s’agisse du cluster manganèse-calcium du PSII catalysant l’oxydation à 4 électrons de l’eau en oxygène (2 H2O = O2 + 4 H+ + 4 e-) ou des sites binucléaires des hydrogénases qui catalysent la réduction des protons en hydrogène (2 H+ + 2 e- = H2 ; cadres c et d ; Figure 1).
Vers les biocarburants ?
Le rendement théorique d’un tel processus photosynthétique ne dépasse pas 10 % et le rendement réel peut être beaucoup plus faible, de l’ordre de 1 % pour les plantes et de 4-5 % pour les micro-algues les plus efficaces. Même si ces rendements sont particulièrement faibles, ils sont évidemment compensés par la quantité massive d’énergie solaire qui inonde la planète. De sorte que, sur une puissance solaire de 100000 TW, la biomasse produite stocke une puissance de 100 TW, soit plus de 6 fois la puissance consommée par l’humanité (16 TW). Néanmoins, ce sont ces considérations de rendement qui continuent à laisser planer des doutes sur l’avenir des biocarburants. Il y a en effet de plus en plus d’opinions négatives sur cette stratégie des biocarburants. On peut citer l’article de H. Michel, prix Nobel de Chimie, intitulé « The Non-Sense of the Biofuels » [5]. La raison en est clairement le faible rendement de la photosynthèse naturelle et l’étendue des surfaces nécessaires à la culture des plantes et des algues pour des productions massives de carburants. Pour le transport de véhicules, un petit calcul, basé sur les rendements connus des différentes technologies, montre que l’énergie produite par unité de surface est 500 fois (!!) plus faible dans le scénario « soleil-biocarburant-moteur à combustion » que dans le scénario « soleil-photovoltaïque-batterie-moteur électrique ». De toute façon, toutes les études prospectives montrent qu’en 2050 une part encore très importante du transport sera assurée par les carburants fossiles, la part de l’électricité, de l’hydrogène et des biocarburants restant minoritaire.
La photosynthèse artificielle
Pourquoi ?
Dans le contexte de la transition énergétique et de la recherche de méthodes de stockage de l’énergie solaire, on comprend que ce processus naturel de la photosynthèse, malgré ses rendements limités, constitue une source d’inspiration unique pour les chimistes. Représentant un énorme défi sur le plan fondamental, à cause de la complexité des réactions mises en œuvre, à la fois photochimiques, électrochimiques et catalytiques, « la photosynthèse artificielle » ouvre des perspectives uniques en matière de stockage d’énergie. Même si ces recherches sont bien avancées, elles ne déboucheront pas sur des dispositifs de production à grande échelle avant de nombreuses années.
Principe
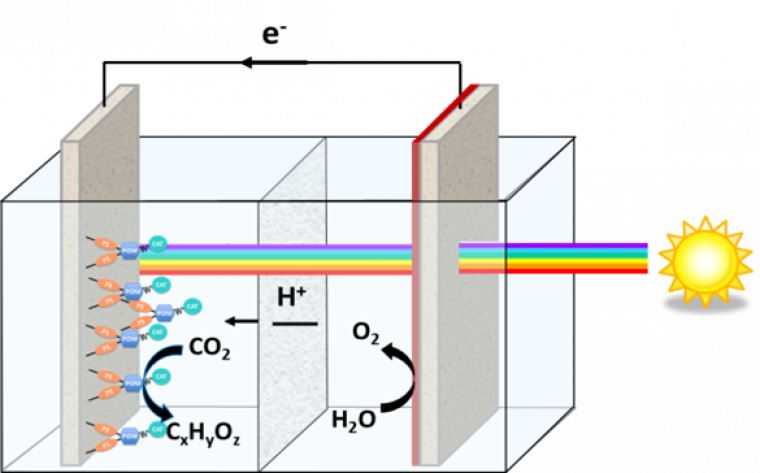
De manière générale, un système photosynthétique artificiel, ici représenté par une cellule photoélectrochimique (Figure 2), doit être capable :
- d’absorber des photons, idéalement dans le spectre visible (représentant 40 % de l’énergie solaire incidente), à l’aide de photosensibilisateurs synthétiques, du type des photosensibilisateurs utilisés par la nature, ou de matériaux semi-conducteurs solides, qui voient leurs électrons prendre l’énergie des photons absorbés ;
- de convertir ensuite l’énergie de ce photon en potentiel électrochimique par un processus de séparation de charges photo-induit ;
- d’utiliser ce potentiel électrochimique, stocké dans la paire « électron-trou », pour, d’une part, oxyder l’eau et, d’autre part, réduire les protons ou le CO 2;
- de catalyser efficacement et sélectivement ces réactions qui sont, on l’a dit, des processus, par nature, cinétiquement contraints.
A droite se trouve la photoanode qui, avec l’aide d’un semiconducteur, convertit l’eau en oxygène et à gauche se trouve la cathode qui réduit le CO2 en carburants. Sur cette dernière on peut par exemple greffer des photosensibilisateurs (en orange), des médiateurs électroniques (en bleu) et des catalyseurs (en vert) moléculaires.
Optimisations
L’un des problèmes à résoudre, parmi d’autres, est l’utilisation, pour le développement de ces photosensibilisateurs, semiconducteurs et catalyseurs, de métaux non nobles (comme le fer, le cobalt, le nickel, le manganèse ou le cuivre), à la place des métaux nobles (platine, or, ruthénium, rhodium, iridium), peu abondants et très chers, généralement utilisés dans les dispositifs technologiques actuels (pile à hydrogène, etc…).
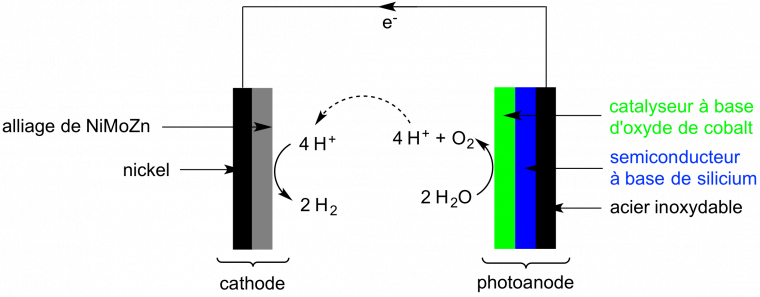
Il existe à ce jour une grande variété de tels systèmes photosynthétiques artificiels décrits dans la littérature, sans qu’il soit possible d’identifier avec certitude celui qui aboutira à une application technologique viable [6]. Celui qui a le mieux popularisé cette stratégie, en développant le concept de « feuille artificielle », est le professeur Daniel Nocera, à l’université de Harvard aux Etats-Unis. Pour la première fois, il a mis au point une cellule photoélectrochimique (Figure 3), à base de métaux non nobles, qui transforme, par simple éclairement solaire, de l’eau en oxygène et en hydrogène, avec un rendement de 4,7 %, comparable aux meilleures micro-algues [7].
A la photoanode, la collecte de l’énergie solaire se fait à l’aide d’un semiconducteur à base de silicium et l’oxydation de l’eau est assistée par un catalyseur à base d’oxyde de cobalt. Les électrons « excités » produits par oxydation de l'eau sont récupérés à la cathode où un alliage de nickel, de molybdène et de zinc catalyse la réduction de l’eau en hydrogène.
Les difficultés sont encore plus grandes en ce qui concerne la transformation du CO2, un sujet sur lequel notre laboratoire consacre tous ses efforts [8]. En effet, la molécule de CO2 est particulièrement stable, ce qui impose des énergies (surtensions) considérables. D’autre part, son activation peut conduire à une multitude de produits, ce qui pose la question critique de la sélectivité des catalyseurs et des systèmes à utiliser. Enfin la présence d’eau, réactif nécessaire, conduit également (par réduction) à la formation d’hydrogène, qu’il faut éviter. Nous développons par exemple actuellement des électrodes à base de cuivre, nanostructurées grâce à la mise au point de méthodes innovantes, qui ont l’avantage de transformer le CO2 presqu’exclusivement en acide formique, un produit utilisé dans l’industrie chimique [9]. On peut penser que les recherches actuelles conduiront assez rapidement à des dispositifs qui transforment le CO2 en molécules aussi simples que le monoxyde de carbone (CO), l’acide formique (HCOOH), ou le méthanol (CH3OH). Le rêve c’est bien sûr d’aller plus loin, avec la production de méthane et d’hydrocarbures plus complexes, et, un jour beaucoup plus lointain, de sucres et de polymères.
Une autre approche
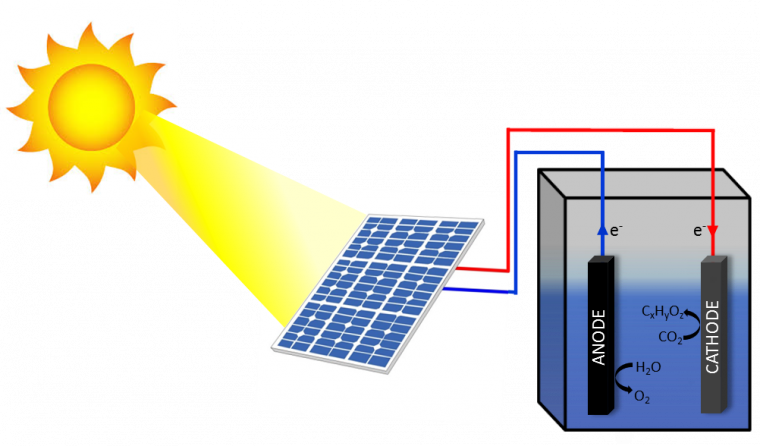
Il y a une autre façon d’envisager, encore plus simplement, la photosynthèse artificielle. Il s’agit dans une première étape d’utiliser, classiquement, des panneaux photovoltaïques pour transformer l’énergie solaire en électricité puis injecter, dans un second temps, cette électricité dans un électrolyseur (Figure 4).
Ce schéma, avec deux dispositifs séparés, est plus simple en pratique pour les raisons suivantes. D’une part, il n’est plus nécessaire de mettre au point des photoélectrodes, assez complexes à optimiser. Les réactions se produisent, dans l’électrolyseur, sur des électrodes classiques : une anode, pour l’oxydation de l’eau, et une cathode, pour la transformation de l’eau en hydrogène ou du CO2 en molécules carbonées. D’autre part, tous ces dispositifs, panneaux photovoltaïques et électrolyseurs, existent et font aujourd’hui l’objet de toutes les attentions depuis longtemps. Il n’est donc pas question de les réinventer. Il convient surtout de profiter des améliorations apportées continuellement aux performances (rendement, stabilité, durabilité, recyclabilité…) de ces technologies, de les développer à une plus grande échelle et également d’en diminuer le coût, notamment à travers la mise au point de catalyseurs à base de métaux non nobles. Avec un système photovoltaïque présentant un rendement de 25 % et un électrolyseur fonctionnant avec un rendement de 80 % (ce qui est envisageable), un rendement global de 20 % peut être espéré, bien supérieur à ceux de la photosynthèse naturelle. Aujourd’hui, on peut atteindre déjà des rendements de l’ordre de 7 % (rapport entre énergie chimique formée et énergie solaire utilisée) pour la conversion du CO2 en CO, en utilisant cependant des catalyseurs à base d’oxyde d’iridium pour l’anode et de platine pour la cathode [10].
On peut donc imaginer, avec de tels dispositifs, un monde nouveau dans lequel chacun, à l’échelle d’une maison, d’un quartier ou d’un village, pourra, de façon autonome, produire le carburant nécessaire à son fonctionnement de tous les jours. Prenons l’exemple d’une maison française consommant 6700 kWh/an ou 18 kWh/jour d’électricité (qui constitue la valeur moyenne de la consommation électrique en France), possédant sur son toit des panneaux photovoltaïques pour l’alimentation en électricité. Le stockage des excès d’énergie (obtenus les jours de grand soleil) se fait dans la cave, grâce à un électrolyseur qui convertit l’eau en oxygène et en hydrogène, conservés dans des bonbonnes. Cette énergie chimique est utilisée la nuit ou les jours de pluie, grâce à une pile à combustible ou pile à hydrogène, dans la cave également, qui la convertit en électricité pour les besoins de la maison. Les calculs montrent qu’avec seulement 55 m2 de panneaux, en électrolysant seulement 2,5 litres d’eau par jour, qui produit 0,5 kg d’hydrogène par jour, on satisfait les besoins en électricité de cette maison [11]. Evidemment pour des maisons ou des villages moins consommateurs, qu’on trouve dans des régions pauvres du monde, on peut penser que ces technologies, lorsqu’elles seront moins coûteuses et donc accessibles, permettront enfin à ces populations d’améliorer leurs conditions de vie, grâce à l’énergie solaire dont elles ne manquent pas.
Il faut mentionner que cette stratégie peut conduire aussi à des installations de taille significative qui utilisent l’hydrogène dans une fonction « tampon » couplée au réseau général d’électricité. Cela permet d’introduire de l’énergie électrique solaire intermittente directement dans le réseau en facilitant la gestion et la stabilisation de ce réseau, à travers l’atténuation des variations de production électrique par les panneaux photovoltaïques et en limitant les surtensions. Un exemple concret est le démonstrateur MYRTE (Mission hYdrogène Renouvelable pour l'inTégration au réseau Electrique) en Corse (Figure 5), qui est constitué d’une centrale photovoltaïque d’une puissance installée de 500 kWc (kilowatt crête) sur 3700 m2 reliée à un électrolyseur (40 Nm3/h), pour stocker l’énergie solaire sous forme d’hydrogène, et à une pile à combustible de 100 kW qui fonctionne en période de forte consommation, par exemple le soir quand les panneaux ne produisent plus d’électricité.
Des catalyseurs bioinspirés
Présentation
Si les systèmes de photosynthèse artificielle sont bioinspirés, il peut en être de même de certains composants de ces systèmes. C’est le cas notamment des catalyseurs. Comme les sites actifs des systèmes enzymatiques sont à base de métaux non nobles, manganèse, nickel, fer (voir Figure 1), ils constituent des sources d’inspiration uniques. Une telle approche parie sur le fait qu’une connaissance extrêmement précise, au niveau moléculaire, de la structure d’un site actif enzymatique peut être exploitée pour en faire une copie synthétique fidèle (on parlera de modèle biomimétique), ou plus largement, pour inventer des catalyseurs dont les principes de fonctionnement s’inspirent de ceux de l’enzyme en activité (mécanisme enzymatique). Cette seconde variante autorise notamment l’utilisation d’éléments chimiques ou de combinaisons d’atomes que la Nature n’a ni explorés pour des questions de biodisponibilité, ni sélectionnés durant l’évolution à cause par exemple de leur toxicité. On parlera alors de modèles bioinspirés. Parce qu’il contient l’information structurale clé issue de notre connaissance du site actif de l’enzyme, là où se produit effectivement la catalyse de la réaction, ce catalyseur, biomimétique ou bioinspiré, va en reproduire l’activité mais en réduisant à la fois la complexité et la sensibilité aux conditions réactionnelles.
Leurs avantages
De tels catalyseurs présentent de nombreux avantages. Faciles à synthétiser et peu coûteux à produire à grande échelle car ils ne renferment généralement pas de métaux nobles ou rares (Pt, Pd, Ir, Rh ou Ru), ils peuvent, contrairement aux enzymes dont ils s’inspirent, être utilisés dans de nombreux solvants organiques ou même dans l’eau pour certains et dans une grande gamme de température ou de pression. Ils sont également moins sensibles à l’oxydation à l’air. Parmi les inconvénients, les catalyseurs bioinspirés sont souvent, mais pas toujours, moins actifs, moins stables et moins sélectifs que les enzymes. Solubles, ils souffrent également d’un problème récurrent, à savoir celui de leur intégration dans un procédé technologique. Ainsi, la découverte d’un catalyseur moléculaire prometteur pour une application industrielle appelle souvent son greffage sur un matériau insoluble.
Quelques exemples
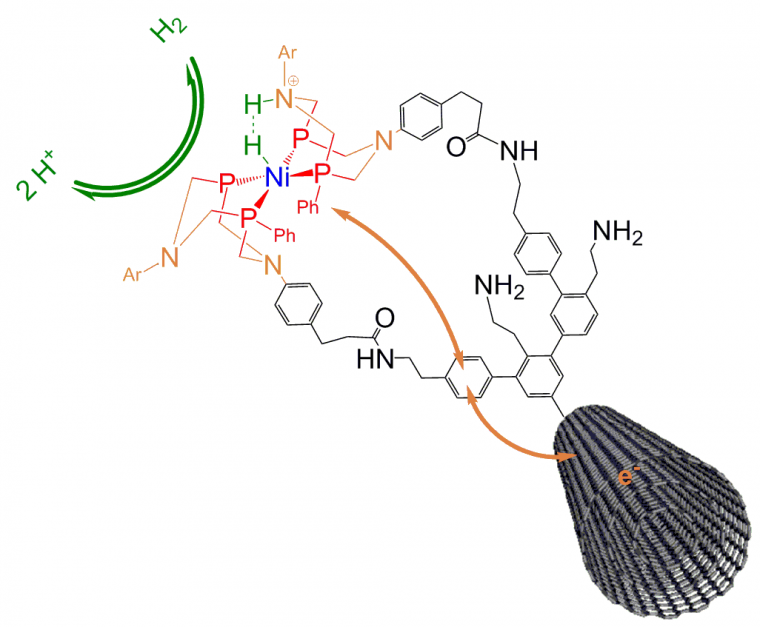
Les quelques exemples ci-dessous, issus de notre recherche, illustrent cette démarche. Les performances des sites actifs des hydrogénases, ainsi que leur relative simplicité (Figure 1), ont conduit au cours de 15 dernières années de nombreux chimistes à synthétiser des complexes mimant leur structure [12]. Certains peuvent être remarquablement actifs. L’un des systèmes synthétiques bioinspirés les plus performants est le matériau à base de nickel que V. Artero et moi-même avons mis au point en 2009 (Figure 6) [13].
Il s’agit d’un complexe diphosphine de nickel attaché à des nanotubes de carbone qui présente des caractéristiques structurales et fonctionnelles proches de celles du site actif naturel des hydrogénases [13]. En particulier, sur le ligand un atome d’azote pour l’échange de protons, comme celui de la dithiométhylamine dans l’enzyme (cadre c ; Figure 1), est essentiel à l’activité tandis que les nanotubes de carbone, mimant la chaîne de clusters fer-soufre dans l’enzyme, assurent la conduction électrique à « longue » distance.
Depuis, les travaux de V. Artero ont permis d’améliorer considérablement ce catalyseur, pour en faire un matériau dont les performances se rapprochent de celles du platine [14]. Il a également été utilisé pour construire la première pile à hydrogène sans métaux nobles [15].
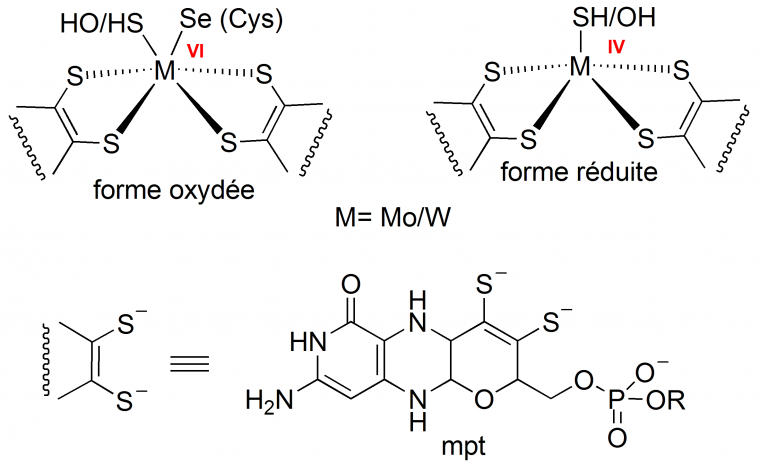
Plus récemment, nous avons synthétisé un complexe biomimétique original, ressemblant au site actif des formiate-déshydrogénases, des métalloenzymes bactériennes catalysant l’interconversion entre le formiate et le CO2 [16]. Certaines formiate-déshydrogénases (FDH) ont dans leur site actif un atome de molybdène (parfois de tungstène), complexé par un ligand très particulier à fonction dithiolène, la molybdoptérine (Figure 7).
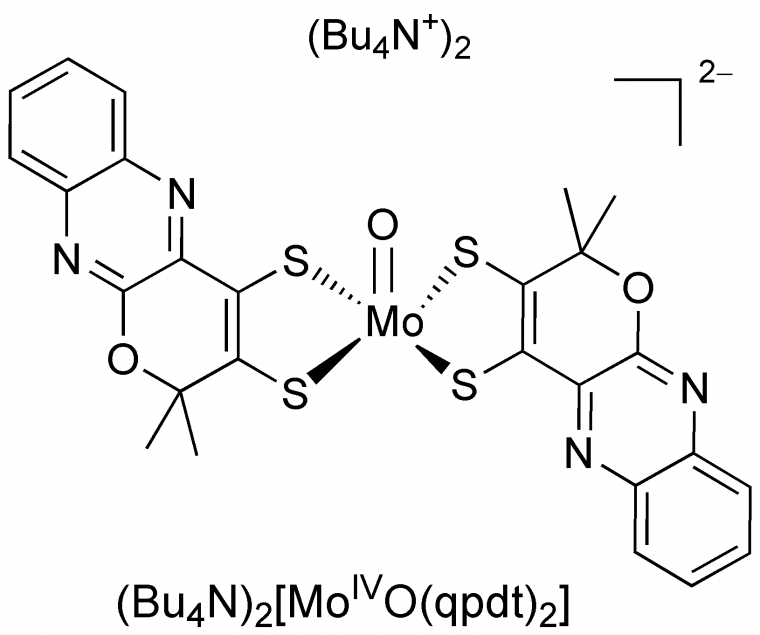
Même s’il ne catalyse pas la réduction du CO2, notre complexe bis-dithiolène de molybdène bioinspiré, (Figure 8), présente d’excellentes activités de catalyseur pour l’électroréduction des protons en hydrogène [17]. Ces travaux ouvrent la voie vers de nouveaux catalyseurs pour des réactions multiélectroniques et multiprotoniques complexes.
Conclusion
Depuis F. Wöhler, qui réalisa la première synthèse de l’urée, pour le chimiste, reproduire un morceau de la matière vivante, en quelque sorte reconstruire un fragment de vie, ou plutôt d’une autre vie, puisqu’en effet la chimie bioinspirée nous emmène dans des mondes matériels que le monde vivant n’a pas explorés ou n’a pas retenus, est une source de bonheur inégalé. C’est encore plus fort lorsque ce défi s’applique à la résolution des problèmes de l’énergie que l’humanité doit affronter. Avec la photosynthèse artificielle, il s’agit de saisir, maitriser l’énergie solaire et l’enfermer dans nos moteurs, nos maisons et nos usines. Il faudra réussir ce projet en moins de temps que ne l’a fait la nature vivante, qui a mis des milliards d’années pour transformer la lumière qui nous inonde en carburants cellulaires.
Références
[1] Fontecave M., Editorial: Sustainable Chemistry for Energizing the Planet, Angew. Chem. Int. Ed., 2015, 54 (24), p. 6946.
[2] Tran P. D., Artero V., Fontecave M., Water Electrolysis and Photoelectrolysis on Electrodes Engineered Using Biological and Bio-Inspired Molecular Systems, Energy Environ. Sci., 2010, 3 (6), p. 727.
[3] Andreiadis E. S., Chavarot-Kerlidou M., Fontecave M., Artero V., Artificial Photosynthesis: From Molecular Catalysts for Light-Driven Water Splitting to Photoelectrochemical Cells, Photochem. Photobiol., 2011, 87 (5), p. 946.
[4] Faunce T., Styring S., Wasielewski M. R., Brudvig G. W., Rutherford A. W., Messinger J., Lee A. F., Hill C. L., deGroot H., Fontecave M., et al., Artificial Photosynthesis as a Frontier Technology for Energy Sustainability, Energy Environ. Sci., 2013, 6 (4), p. 1074.
[5] Michel H., Editorial: The Nonsense of Biofuels, Angew. Chem. Int. Ed., 2012, 51 (11), p. 2516.
[7] Reece S. Y., Hamel J. A., Sung K., Jarvi T. D., Esswein A. J., Pijpers J. J. H., Nocera D. G., Wireless Solar Water Splitting Using Silicon-Based Semiconductors and Earth-Abundant Catalysts, Science, 2011, 334 (6056), p. 645.
[9] Huan T. N., Andreiadis E. S., Heidkamp J., Simon P., Derat E., Cobo S., Royal G., Bergmann A., Strasser P., Dau H., et al., From Molecular Copper Complexes to Composite Electrocatalytic Materials for Selective Reduction of CO2 to Formic Acid, J. Mater. Chem. A, 2015, 3 (7), p. 3901.
[10] Schreier M., Curvat L., Giordano F., Steier L., Abate A., Zakeeruddin S. M., Luo J., Mayer M. T., Grätzel M., Efficient Photosynthesis of Carbon Monoxide from CO2 Using Perovskite Photovoltaics, Nat. Commun., 2015, 6, 7326.
[11] Artero V., Guillet N., Fruchart D., Fontecave M., L’hydrogène : Une énergie Propre Pour Demain?, Pour la Science, 2011, 405.
[12] Simmons T. R., Berggren G., Bacchi M., Fontecave M., Artero V., Mimicking Hydrogenases: from Biomimetics to Artificial Enzymes, Coord. Chem. Rev., 2014, 270-271, p. 127.
[13] Le Goff A., Artero V., Jousselme B., Phong D. T., Guillet N., Métayé R., Fihri A., Palacin S., Fontecave M., From Hydrogenases to Noble Metal–Free Catalytic Nanomaterials for H2 Production and Uptake, Science, 2009, 326 (5958), p. 1384.
[14] Huan T. N., Jane R. T., Benayad A., Guetaz L., Tran P. D., Artero V., Bio-Inspired Noble Metal-Free Nanomaterials Approaching Platinum Performances for H2 Evolution and Uptake, Energy Env. Sci., 2016, 9 (3), p. 940.
[15] Tran P. D., Morozan A., Archambault S., Heidkamp J., Chenevier P., Dau H., Fontecave M., Martinent A., Jousselme B., Artero V., A Noble Metal-Free Proton-Exchange Membrane Fuel Cell Based on Bio-Inspired Molecular Catalysts, Chem Sci., 2015, 6 (3), p. 2050.
[16] Porcher J.-P., Fogeron T., Gomez-Mingot M., Chamoreau L.-M., Li Y., Fontecave M., Synthesis and Reactivity of a Bio-Inspired Dithiolene Ligand and Its Mo Oxo Complex, Chem. - Eur. J., 2016, 22 (13), p. 4447.
[17] Porcher J.-P., Fogeron T., Gomez-Mingot M., Derat E., Chamoreau L.-M., Li Y., Fontecave M., A Bioinspired Molybdenum Complex as a Catalyst for the Photo- and Electroreduction of Protons, Angew. Chem. Int. Ed., 2015, 54 (47), p. 14090.