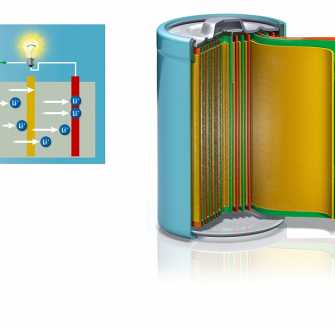
Ce troisième article du dossier Le stockage de l’énergie électrochimique en technologie Lithium-ion présente le parcours du litihum, depuis l'extraction jusqu'à la batterie Li-ion. Il traite de la préparation des électrodes, des différents électrolytes utilisés et de l'assemblage des accumulateurs en cellule puis en pack.
Le lecteur est invité à consulter au préalable les premiers articles du dossier, intitulés :
- La réactivité du lithium à l'origine de performances électriques extraordinaires
- La technologie Li-ion
Production du lithium
Le lithium qui est le 33e élément le plus abondant sur terre n’est pas trouvé sous forme métallique à l’état natif tant il est réactif. Il peut être extrait par lixiviation de roches magmatiques dites pegmatites (silicate de type spodumène, lépidolite et pétalite – Australie occidentale : 1er producteur mondial), dans une moindre mesure de granite, mais aussi d’argiles (hectorites - Nevada, Etats-Unis – Sonora, Mexique) ou encore à partir de réservoirs de saumures naturellement riches en sels de lithium, sodium et potassium localisés sous le lit de lacs salés (salars), notamment en Amérique du sud. Aucune solution viable économiquement n’a été jusqu’ici proposée pour extraire le lithium de l’eau de mer.
Dans le cas des salars, les saumures sont pompées en surface et stockées dans des marais salants pendant plusieurs mois (18-24 mois) afin d’en extraire l’eau par évaporation (l’osmose inverse peut être utilisée afin d’accélérer le processus de concentration). Environ 2 millions de litres d’eau sont évaporés pour produire une tonne de lithium. Les saumures concentrées subissent différents traitements chimiques et physiques (précipitation, filtration, échange d’ions) et sont mises au contact de réactifs permettant de produire du carbonate de lithium (Li2CO3), de l’hydroxyde de lithium (LiOH), du bromure de lithium (LiBr), du butyllithium... Ces sels de lithium sont utilisés comme ingrédients de base lors de la synthèse des matériaux de cathode ou bien comme sels dans les électrolytes de batteries au lithium (LiClO4, LiPF6, LiAsF6, LiBF4). Le lithium métallique est quant à lui produit par électrolyse d’un sel fondu composé d’un mélange eutectique de chlorure de lithium (55%) et potassium (45%) porté à 450°C.
Les salars
Les sels de lithium (Li2CO3) peuvent être produits à partir de saumures pompées dans les lacs salés (salars) situés sur les hauts plateaux andains, qu’on laisse évaporer pendant des mois. Le Chili (Salar d’Atacama), l’Argentine (Salar d’Arizaro) et la Bolivie (Salar d’Uyuni), forment « le triangle du lithium » et compteraient à eux seuls plus de 80% des réserves mondiales. L’extraction à outrance du lithium dans ces régions désertiques menace les écosystèmes et l’accessibilité à l’eau pour les populations locales.
Synthèse des matériaux
Les matériaux d’électrodes positives sont synthétisés à partir de sel de métaux de transition, de sel de lithium (Li2CO3 facilement obtenu à partir des saumures et LiOH à partir de spodumène), éventuellement de sel de phosphate, de silicate ou de fluor pour les matériaux polyanioniques ou d’agents réducteurs (acide fumarique, citrique). Plusieurs voies de synthèse ont été envisagées selon la taille et la structuration des objets souhaités :
- par voie solide - mélange et broyage des précurseurs et traitement haute température,
- par voie sol-gel - hydrolyse et condensation/polymérisation d’un mélange des précurseurs produisant un gel qui est par la suite déshydraté/calciné pour produire après léger broyage des matériaux nanostructurés,
- ou par voie hydro/solvothermale - coprécipitation à haute température et pression sous agitation en autoclave.
L’enrobage de carbone de nano-objets peut être obtenu par l’ajout d’un agent chélatant (lactose, glucose) et un traitement par calcination. Plus récemment, de nouvelles techniques de synthèse ont été introduites parmi lesquelles la synthèse par micro-ondes, la pyrolyse d’aérosol (un aérosol produit par nébulisation ultrasonique d’une solution de précurseur est introduit grâce à un gaz vecteur dans un four tubulaire à haute température), et la synthèse par combustion spontanée (SCS) ou bien auto-propagée (SHS) à haute température utilisant l’exothermicité de réactions entre un oxydant et un combustible afin de minimiser l’apport d’énergie de chauffe.
Préparation des électrodes
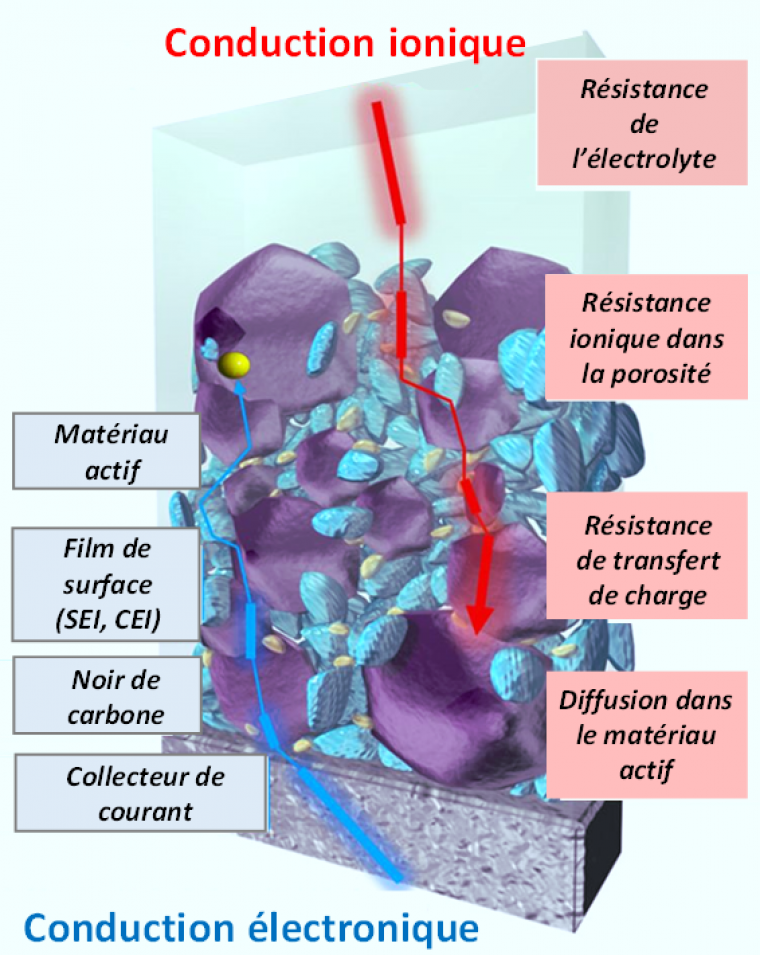
Les électrodes composites utilisées dans les batteries Li-ion sont toujours enduites sur un collecteur de courant (souvent une feuille d’aluminium à l’électrode positive et une feuille de cuivre à l’électrode négative) permettant d’assurer le contact électrique depuis le circuit extérieur vers le matériau actif. Le composite est constitué de trois composants donc le matériau majoritaire dit « actif » qui insère les ions lithium, un percolant électronique (souvent du noir de carbone amorphe) assurant le passage des électrons du collecteur de courant vers les différents grains de matériaux actifs et enfin un liant (souvent un polymère fluoré PVDF ou des liants à base de cellulose CMC ou encore de gomme SBR) permettant la tenue mécanique des électrodes et l’adhésion des matériaux sur le collecteur de courant. Une électrode composite typique est composée des matériaux actifs, carbone et liant dans les rapports respectifs 96 %, 1 % et 3 % en masse, avec un grammage (« loading ») de 1,4 g.cm-2 et une porosité de 35%.
Les électrodes sont constituées du matériau actif, de liant (polymère : non conducteur) et d’un agent conducteur d’électrons, le noir de carbone. Les conductions électronique et ionique au sein des particules de matière active, et à travers l’épaisseur du composite, déterminent les performances de l’électrode.
Figure adaptée de Sci Rep 6 (2016) 26382.
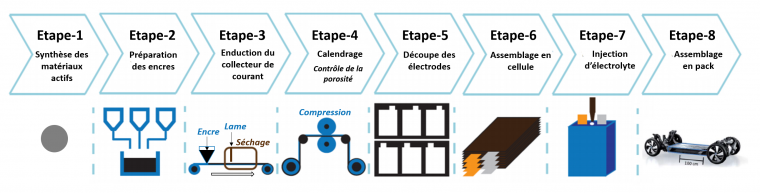
La préparation des électrodes est toujours réalisée en 4 étapes :
- Une encre liquide est d’abord préparée en mixant les trois composants de l’électrode dans un solvant (souvent la N-méthyl-2-pyrrolidone : NMP) à l’aide d’outils tels que des défloculeuses et autres homogénéisateurs et disperseurs permettant une bonne homogénéité des encres produites.
- Ces encres sont ensuite enduites sur les collecteurs de courant à l’aide d’une table à enduction (lame d’encrier « Doctor Blade») en ajustant la hauteur de la règle à enduction afin d’obtenir le grammage visé (quantité de matériau par unité de surface en mg.cm-2), puis les électrodes enduites sont chauffées pour évaporer le solvant.
- Enfin, les électrodes sont calandrées (passage des électrodes entre deux rouleaux imposant une pression homogène sur la surface de l’électrode) afin de contrôler son épaisseur finale et sa porosité (voir figure 11, étapes 2-5 et figure 12 - vidéo).
Les électrolytes
Les électrolytes à base de carbonates organiques
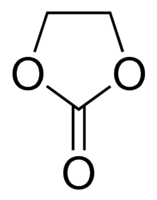
L’électrolyte constitué d’une solution de LiClO4 dans le carbonate de propylène (PC), utilisé dès 1958, s’est avéré problématique pour deux raisons : le sel LiClO4 est explosif et le carbone graphite utilisé aujourd’hui côté anodique en remplacement du coke se dégrade très rapidement en cyclage puisque PC tend à s’intercaler dans les feuillets de graphite avec les ions lithium donnant lieu à ce qu’on appelle une exfoliation.
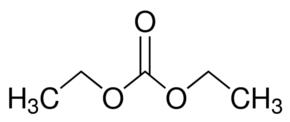
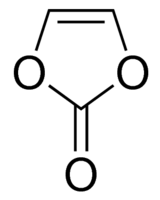
Cet électrolyte a depuis été remplacé par des mélanges du sel LiPF6 (1 mol.L-1) et de carbonates cycliques (carbonate d’éthylène EC) et linéaires :
- carbonate de diméthyle DMC,
- carbonate de diéthyle DEC,
- carbonate de méthyle et éthyle EMC,
qui permettent notamment de solubiliser EC (solide à température ambiante). Ces électrolytes, connus sous les dénominations LP30, LP40, LP50, sont stables sur une large fenêtre électrochimique : 1,1 - 4,4 V vs Li+/Li.
Ils ont permis le développement d’anodes en graphite naturel et synthétique car ils permettent la formation d’une SEI stable (E < 1,1 V) de faible résistance, mais aussi de matériaux de cathode haute-tension, de par leur large fenêtre de potentiel. Leur grande conductivité ionique (≈ 10-2 S.cm-1) sur une large plage de température est également intéressante pour les applications en puissance.
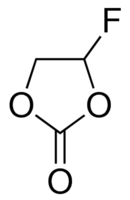
Des additifs à ces électrolytes sont régulièrement employés parmi lesquels le carbonate de vinylène (VC) ou le carbonate de fluoroéthylène (FEC).
L'électrolyte de référence
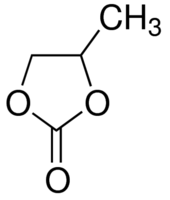
L’électrolyte de référence LP30 est constitué de carbonates cyclique (d’éthylène : EC) et linéaire (de diméthyle : DMC) de fraction massique 50/50% et de sel LiPF6 à 1 mol.L-1. La qualité de cet électrolyte (pureté du solvant et du sel et teneur en eau) est primordiale au risque d’observer une rapide dégradation liée à la formation d’acide fluorhydrique HF, associée à un changement de couleur. La concentration en eau peut être évaluée par la méthode de titration dite de Karl Fisher (1935).
L’électrolyte de référence LP30 est constitué de carbonates cyclique (d’éthylène : EC) et linéaire (de diméthyle : DMC) de fraction massique 50/50% et de sel LiPF6 à 1 mol.L-1.
Les photos illustrent la dégradation de cet électrolyte par formation d'acide fluorhydrique HF.
Le sel LiPF6
Le sel LiPF6 est utilisé dans les batteries Li-ion principalement parce qu'il assure la passivation (par AlF3) des collecteurs de courant en aluminium utilisés pour l'électrode positive. De nombreuses tentatives pour remplacer le LiPF6 (par exemple par des imides comme LiTFSI) ont jusqu’ici échoué. À température élevée, LiFP6 tend en revanche à former PF5 (acide de Lewis) qui favorise l’ouverture et la réactivité des cycles carbonates (transestérifications) et donc la dégradation de l’électrolyte (l’électrolyte transparent devient turbide et noirâtre). De même en présence d’eau, LiFP6 se décompose pour former de l’acide fluorhydrique (HF) qui solubilise la SEI, dégrade les matériaux d’électrode et décompose l’électrolyte.
Les électrolytes avec matrice polymère
Le recours à des électrolytes polymère ou polymère gélifié composés d’une matrice polymère (ex : Poly(oxyde d'éthylène)s PEO, polyacrylonitrile PAN, Fluorure de poly(vinylidène)– hexafluoropropylène PVdF-HPF d’une phase liquide (solvant inorganique ou liquide ionique), de sel (LiPF6, LiClO4, LiTFSI : LiN(SO2CF3)2 et éventuellement de charges (« fillers » en céramique SiO2, Al2O3) et d’additifs (plastifiants) permet de pallier à la fois la stabilité électrochimique relative des électrolytes liquides et leur tenue en température limitée. L’évaporation du solvant débute en effet à 65°C dans les électrolytes liquides et peut atteindre 100°C dans les électrolytes gélifiés. En revanche, la faible conductivité de ces électrolytes polymères (10-5 S.cm-1 à température ambiante) nécessite une température de fonctionnement élevée et un maintien constant de la batterie entre 60 et 80°C (10-3 S.cm-1). De plus, les polymères tels que PEO présentent une faible stabilité à haut potentiel (limite à 3,8 V vs Li+/Li), empêchant leur association avec les matériaux populaires NCA et NMC.
Les voitures 100% électrique Bluecar utilisent des batteries LMP.
L’oxyde de vanadium V2O5 ou bien LFP sont donc utilisés comme par exemple dans la batterie Lithium Métal Polymère (LMP) développée par le groupe Bolloré. Etant donné que les propriétés mécaniques de PEO ne permettent pas de limiter la croissance de dendrites dans les LMPs, un second polymère (co-polymère de PVDF) est ajouté.
L’électrolyte polymère et la batterie Lithium Métal Polymère
Développée industriellement par le groupe Bolloré, cette dernière utilise du lithium métal comme électrode négative, LFP comme matériau d’électrode positive et un électrolyte polymère permettant de limiter la formation de dendrites métalliques. Cette batterie dont le mécanisme de fonctionnement n’est pas de type rocking-chair n’est donc pas une batterie Li-ion.
Assemblage des accumulateurs en cellule puis assemblage en pack
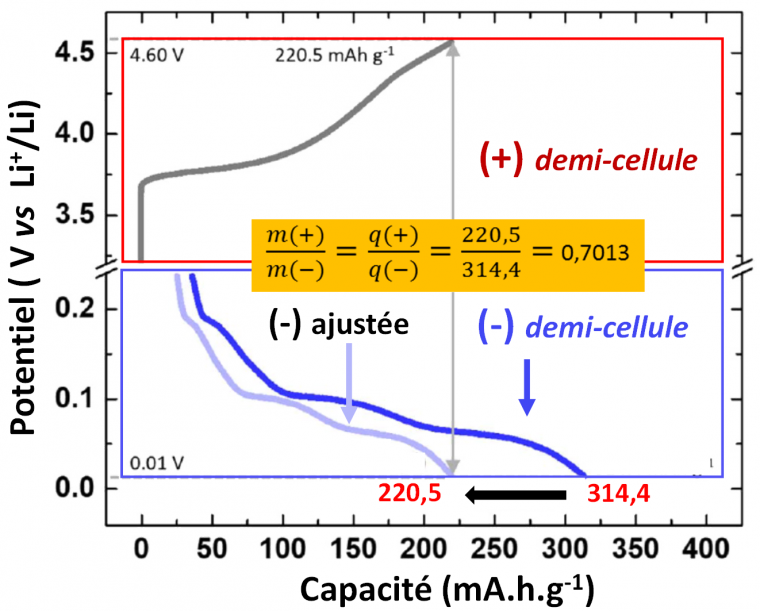
La préparation des électrodes (quantité de matière active par unité de surface, ou « loading ») doit prendre en compte la différence de capacité des matériaux d’électrodes négative et positive mis en regard dans l’accumulateur, mais aussi la capacité irréversible observée principalement à la négative (graphite) : on parle d‘équilibrage (« balancing »). En effet, le matériau de cathode est initialement totalement lithié tandis que le graphite ne l’est pas. Lors du premier cycle de charge, dit de formation (réalisé en usine), le lithium est extrait de la positive pour être inséré dans la négative, or une partie non négligeable de ce lithium dit « cyclable » est consommé de façon irréversible pour former la SEI à la négative. Il ne sera donc pas possible de relithier complètement l’électrode positive à la décharge suivante, à moins de prendre en compte dès le départ un léger excès de matériau de cathode. L’ajustement précis de cet excès devra prendre en compte également le possible piégeage d’ions lithium au sein de la structure hôte positive au cours du cyclage. Le mauvais équilibrage d’un système peut être dramatique car il entraînera une diminution trop importante du potentiel de l’électrode de graphite en fin de charge, provoquant ainsi la formation de dendrites de lithium.
Les capacités des électrodes composites sont d’abord mesurées en demi-cellule puis la masse de matière active est ajustée dans les électrodes (+) et (-) qui seront préparées puis assemblées en cellule complète.
Figure adaptée de Journal of The Electrochemical Society 164 (2017) A2479-A2486.
Calcul de grammage
Le grammage désigne la masse surfacique, autrement dit la masse par unité de surface. Sa valeur permet de déterminer la masse de matériau actif à incorporer au liant et à l’agent conducteur lors de la préparation des électrodes composites négatives et positives permettant de mettre au point une batterie de capacité donnée. Considérons une batterie de type pile bouton composée d’une électrode positive composite de LNMO et d’une électrode négative composite de graphite. Nous visons une capacité totale de l’accumulateur de 1,3 mAh.
- Prenons une électrode positive de LNMO, dont la capacité spécifique théorique est de 147mAh/g, composée à 92% de matériau actif, et dont la surface est de 1,76 cm² (disque de 15 mm de diamètre pour une pile bouton) ; le grammage à viser pour l’électrode positive lors de sa fabrication est obtenu par le calcul suivant :
Masse LNMO = 1,3 mAh / 147 mAh.g-1 = 8,8 mg
Masse électrode composite = 8,8 mg / 0,92 = 9,6 mg
Grammage visé = 9,6 mg / 1,76 cm² = 5,45 mg.cm-2
- Prenons une électrode négative composée à 90% de graphite, dont la capacité spécifique théorique est de 372 mAh/g et dont la surface est équivalente à celle de l’électrode positive. Afin d’équilibrer le système, prenons un rapport 1,2 entre la capacité de l’électrode négative et celle de l’électrode positive (cette valeur diffère selon les systèmes afin de compenser la perte de capacité irréversible subie lors du premier cycle). Le grammage à viser lors de la fabrication de l’électrode négative est obtenu par le calcul suivant :
Capacité de l’électrode négative = 1,3 × 1,2 = 1,56 mAh
Masse de graphite = 1,56 mAh / 372 mAh.g-1 = 4,2 mg
Masse électrode composite = 4,2 mg / 0,90 = 4,7 mg
Grammage visé = 4,7 mg / 1,76 cm² = 2,7 mg.cm-2
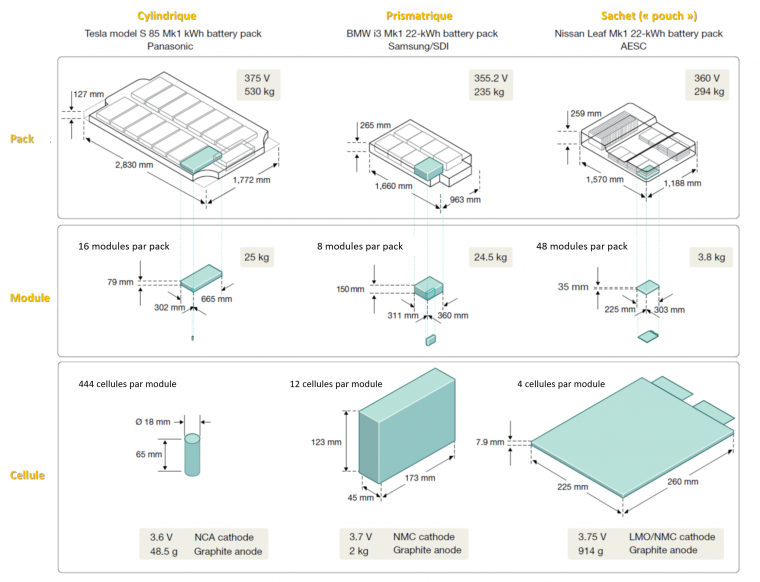
Les électrodes, une fois équilibrées, sont découpées puis assemblées en sandwich de chaque côté d’une ou deux feuilles de polypropylène (Celgard©), matériau polymère isolant d’épaisseur 15 à 25 µm perméable à l’électrolyte et utilisé comme séparateur. Les sandwiches obtenus sont utilisés tels quels dans des piles boutons ou des cellules « pouch » (sachets en aluminium plastifié), ou bien sont roulées pour leur donner une forme cylindrique ou prismatique et sont maintenus sous pression au sein d’une coque rigide. La pression des sandwiches est en effet déterminante pour obtenir les meilleures performances (polarisation minimisée, tenue en cyclage optimisée). Enfin, l’électrolyte est introduit en quantité contrôlée de façon à ce que l’ensemble des pores des matériaux d’électrode en soit imprégné.
La diminution de la densité d’énergie accessible entre le matériau actif (étape 1) et après son intégration au sein d’un pack de batteries (étape 8) est considérable (chute d’un facteur 4). Une étape importante, non représentée ici, est celle du recyclage des packs de batteries.
Figure adaptée de https://rheonics.com/
La vidéo ci-dessous (en anglais) illustre le processus de fabrication d'une batterie Li-ion au laboratoire.
Le système de protection « BMS »
Les accumulateurs sont assemblés en parallèle et en série sous forme de cellules puis de modules afin d’obtenir respectivement le courant et la tension désirée. Ils sont ensuite intégrés dans un pack résistant aux chocs et composé d’un système de refroidissement/chauffage et d’une électronique de contrôle, le BMS pour « Battery management system ». Afin d’estimer en temps réel le bon fonctionnement de la batterie, à la fois le potentiel, le courant, la température, l’état de charge et l’état de santé de chaque élément (capacité restante par rapport à l’originale) sont monitorés sur chaque cellule. Le BMS, sur la base de ces données:
- permet d’éviter que la batterie ne travaille en dehors de sa plage de fonctionnement sûr (température élevée, sur/sous-tension, sur-intensité),
- régule la sollicitation de la batterie et sa température,
- peut éventuellement rediriger l’énergie provenant du freinage ou de systèmes thermoélectriques vers le pack de batterie
- et équilibre la charge en la redistribuant entre les différents éléments.
Ce diagnostic en temps réel pourrait être complété dans le futur par des capteurs additionnels (capteur à fibres optiques intégrée aux accumulateurs permettant la cartographie précise de température au sein des éléments) afin d’obtenir un état de santé précis de chaque élément de la batterie. Des systèmes d’autoréparation des batteries contrôlés par le BMS sont aussi envisagés (injection de constituants « réparateurs »).
Une liste des acronymes utilisés dans tout le dossier, ainsi qu'une version au format PDF de cet article sont fournies ci-après.
Documents à télécharger