Cet article en deux volets présente l'historique des batteries depuis leur création à nos jours.
Le premier volet s'attache à donner les définitions et grandeurs caractéristiques d'une batterie, ainsi que l'historique des technologies utilisées pour les batteries du XIXème siècle jusqu'aux années 1970, avec la technologie lithium métal.
Le deuxième volet (ci-dessous) s'attache à décrire les batteries lithium ion et les futurs systèmes (ceux utilisant le lithium et ceux proposant une alternative à cet élément, comme l'élément sodium).
Batteries Li-ion
Les batteries Li-ion, contrairement aux batteries à base de nickel, présentent l’avantage d’envisager une multitude de possibilité pour les matériaux d’électrodes [8,9]. Les matériaux d’électrodes présentés par la suite sont les plus courants mais ne sont en aucun cas les seuls présents sur le marché ou en cours de développement.
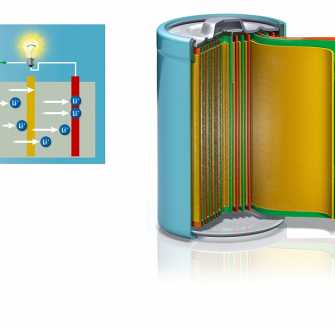
Les travaux de recherche sur les batteries lithium-ion commencent dans les années 1980 et aboutissent à une première commercialisation par Sony en 1991. Les premières batteries Li-ion présentent une cathode en oxyde de cobalt lithié de type LiCoO2 (LCO) [10] permettant l’insertion et la désinsertion du lithium, une anode en graphite permettant l’intercalation du lithium et un électrolyte sous forme d’une solution organique contenant un sel de lithium tel que LiPF6. Il sert au transport des éléments d’une électrode à l’autre. Le lithium est « stocké » dans le graphite de l’anode et se déplace vers l’oxyde de cobalt lithié lors de son fonctionnement. La batterie est déchargée quand plus aucun ion lithium ne peut circuler dans ce sens. La recharge de la batterie consiste à forcer le mouvement du lithium vers l’anode en inversant la polarité des électrodes. L'animation ci-dessous illustre la décharge et la charge d'une batterie lithium ion.
Les réactions se produisant aux électrodes lors de la décharge sont (on prend ici l’exemple d’une cathode en LiCoO2) :
-
À l’anode : LiC6 = 6 C + Li+ + e− (le lithium métal piégé dans le graphite est oxydé en ion Li+, qui passe dans l’électrolyte).
-
À la cathode : Li1-xCoO2 + x Li+ + x e− = LiCoO2 (les ions lithium sont réduits en atomes de lithium et viennent s’insérer dans l’oxyde mixte).
Matériaux d’électrode positive
Le cobalt est un métal cher et toxique, on tente donc de limiter son utilisation pour les applications de batteries en développant des cathodes LiNiO2 (LNO) [11] et LiMnO2 [12] ou LiMn2O4 (LMO), malheureusement ces systèmes ont de gros désavantages. La cathode d’oxyde de nickel est très instable et pose des problèmes de sécurité (surchauffe) ; la batterie utilisant une cathode constituée d’oxyde de manganèse possède généralement une plus faible énergie spécifique (Tableau 1).
Pour avoir une meilleure stabilité tout en conservant de bonnes propriétés énergétiques, les cathodes sont constituées d’oxydes mixtes. Un exemple est un oxyde mixte d’aluminium, de nickel et de cobalt : LiNi0.8Co0.15Al0.05O2 (NCA) [13]. Cette cathode commercialisée possède de bonnes propriétés mais l’une des plus répandue de nos jours est constituée d’oxyde LiNi0.33Mn0.33Co0.33O2 (NMC) [14]. La catégorie des NMC est composée d’un ensemble d’oxydes dont les proportions peuvent varier afin d’avoir un bon compromis entre stabilité et puissance. Ce type d’électrode est largement utilisé car la batterie obtenue possède une bonne énergie spécifique, certes inférieure à celle utilisant l’électrode NCA, et une très bonne cyclabilité (plus du double de celle utilisant l’électrode NCA) (Tableau 2).
Parallèlement à ce type de systèmes, les électrodes LiFePO4 (LFP) avec une structure de type olivine commencent à se développer. Malgré des propriétés moins bonnes que celles des autres matériaux présentés auparavant, cette formulation d’électrode confère néanmoins une grande stabilité thermique [15]et une bonne cyclabilité à la batterie (Tableau 1).
| Matériaux de cathode | Energie spécifique en Wh/kg | Capacité spécifique (théorique/expérimentale) en mAh/g | Fem en V | Cyclabilité |
|---|---|---|---|---|
| LCO | 150-200 | 274/148 | 3,6 | 500-1000 |
| LNO | 150-200 | 275/150 | 3,6 | 300-600 |
| LMO | 100-150 | 285/140 | 3,7 | 300-700 |
| NMC | 150-200 | 280/180 | 3,6-3,7 | 1000-3000 |
| NCA | 200-260 | 279/200 | 3,6 | 500 |
| LFP | 90-120 | 170/165 | 3,2-3,3 | 1000-2000 |
| Li-S |
2500 (théorique) 500 (expérimentale) |
1000 | 2,2 | 100 |
| Li-Air | 3500 (théorique) | 2000 | 3,0-3,2 | 50 |
Tableau 1. Caractéristiques des batteries lithium ion en fonction de la nature de leur électrode positive.
Matériaux d’électrode négative
Cet article s’intéresse particulièrement aux matériaux d’électrodes positives mais il faut savoir qu’il existe aussi un grand effort de recherche pour augmenter la capacité des batteries en modifiant les matériaux de l’anode, majoritairement en graphite actuellement. Ces matériaux doivent permettre la lithiation et la délithiation avec un changement de volume le plus restreint possible. Un des matériaux envisagé est un oxyde de titane lithié de formule Li4Ti5O12 (LTO), qui présente un changement de volume de seulement 0,2 % lors d’une charge complète ; à titre de comparaison, le changement de volume est de 10 % pour une anode en graphite et de 270 % pour une anode en silicium, lors d’une charge complète[8]. Le prix élevé du titane du LTO restreint néanmoins son utilisation à grande échelle.
Futurs systèmes au lithium
Pour améliorer les énergies spécifiques des batteries Li-ion actuelles, de nouveaux systèmes basés sur d’anciennes technologies sont en cours de développement. Les systèmes les plus prometteurs sont les batteries Lithium/air et Lithium/Soufre (Li/S) [1,4].
La batterie Li/S est composée notamment d’une anode métallique en lithium et d’une cathode en soufre. Le principal avantage de cette batterie est le remplacement de l’oxyde mixte de la cathode par du soufre, plus léger, plus abondant et donc peu coûteux [16]. Cette batterie possède une énergie spécifique d’environ 500 Wh/kg, ce qui est très encourageant mais très éloigné de la valeur théorique (environ 2500 Wh/kg) (Tableau 1). Ce système possède néanmoins de nombreuses limitations comme une faible conductivité, c’est à dire une faible capacité à laisser circuler les différents ions, une grande instabilité qui conduit à la dégradation de la cathode et donc une très faible cyclabilité (seulement 50 cycles pour les tests actuels) [16]. Plusieurs projets sont actuellement en cours pour développer et améliorer ce système.
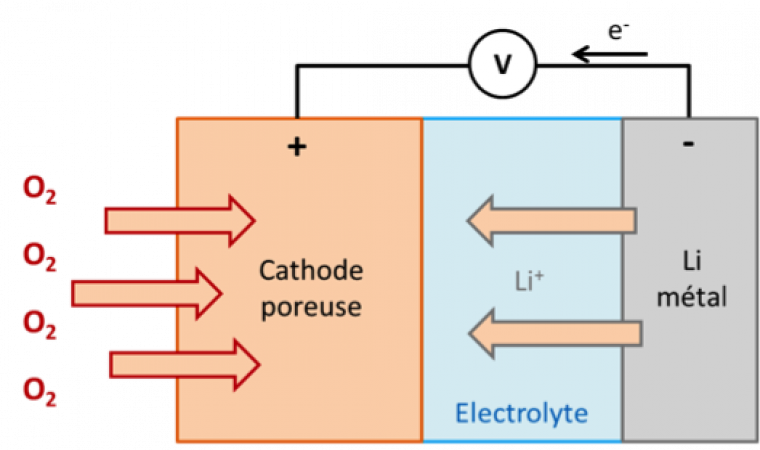
La batterie Li/air est elle aussi composée d’une anode de lithium métallique et d’une cathode poreuse qui serait capable de réagir avec l’oxygène de l’air pour former lors de la décharge du Li2O2 ou du LiOH suivant que le milieu soit aqueux ou non (Figure 1). Ce système pourrait avoir un rendement énergétique record et se rapprocher de celui du carburant traditionnel (Tableau 1). Les inconvénients sont les sous-produits formés au cours du fonctionnement du système qui bloquent le mouvement des électrons et diminuent la capacité de stockage effective ; par ailleurs, une limitation importante réside dans le fait que l’air doit être pur, ce qui n’est pas le cas dans la plupart des villes. La batterie devrait donc être équipée d’un filtre pour pouvoir fonctionner [1,16].
Malgré l’émergence de ces nouveaux systèmes prometteurs un problème majeur demeure : l’utilisation du lithium. C’est pourquoi de nombreuses recherches se portent sur les batteries de type X-ion avec d’autres éléments que le lithium.
Conclusions et Perspectives : Alternatives au lithium
Le marché des batteries rechargeables est en pleine expansion. La transition énergétique qui devra s’effectuer quand les ressources fossiles viendront à manquer nécessite des batteries avec une plus grande durée de vie et pouvant stocker plus d’énergie. Cette demande de plus en plus forte pousse au développement de nouveaux matériaux qui permettraient d’allier sécurité et plus grande capacité spécifique. De nombreuses possibilités existent pour des applications portables mais ce marché est dominé par les batteries Li-ion avec des cathodes de type NMC et les batteries Li-Po.
Le lithium, bien que possédant des avantages en termes de taille et de capacité spécifique, est un élément dont les ressources sont limitées et désormais difficiles d’accès ; son coût est donc relativement élevé et son cours ne fera qu’augmenter. De plus, des problèmes de sécurité liés aux batteries Li-ion subsistent [17]. Pour éviter ces problèmes, d’autres éléments plus abondants sont envisagés tel que le sodium (Na), le magnésium (Mg), le potassium (K) ou encore le calcium (Ca) et l’aluminium (Al) car leurs propriétés (Tableau 3) peuvent permettre leur utilisation en tant qu’éléments de batteries de type X-ion [18]. Si certains systèmes sont encore peu développés comme les batteries K-ion, Ca-ion et Al-ion, d’autres comme les batteries Na-ion [18,19] et Mg-ion [17,18,20] commencent à se développer de façon industrielle.
| Couple | Capacité volumique en mAh/mL | Capacité spécifique en mAh/g | Potentiel standard de réduction en V vs. ESH | Rayon ionique en pm |
|---|---|---|---|---|
| Li+/Li | 2026 | 3861 | -3,04 | 76 |
| Na+/Na | 1128 | 1165 | -2,71 | 102 |
| K+/K | 591 | 685 | -2,93 | 138 |
| Mg2+/Mg | 3833 | 2205 | -2,37 | 72 |
| Ca2+/Ca | 2073 | 1337 | -2,87 | 100 |
| Zn2+/Zn | 5851 | 820 | -2,20 | 74 |
| Al3+/Al |
8040 |
2980 | -1,67 | 54 |
Tableau 3. Caractéristiques des batteries X-ion selon la nature de l'élément X.
Le sodium, environ 1000 fois plus abondant que le lithium et nettement moins coûteux que celui-ci, est l’objet de nombreuses recherches. Des batteries au sodium pour le stockage de l’énergie existent déjà, notamment dans les parcs éoliens et photovoltaïques. La technologie sodium-soufre nécessite une température de 300 °C pour pouvoir fonctionner, ce qui entraîne une perte de rendement non négligeable [1]. L’enjeu est donc de développer des batteries Na-ion pouvant fonctionner à température ambiante.
Un autre frein à l’utilisation du sodium dans des batteries Na-ion reste son rayon ionique plus élevé que celui du lithium ; en effet, le challenge est de composer des électrodes avec une porosité suffisante pour permettre l’intercalation du sodium et une bonne diffusion des ions au sein de la matrice [18]. Néanmoins, sa plus faible capacité est compensée par son faible coût de fabrication (Tableau 2).
Si de nombreux essais sont en cours dans différents laboratoires, le premier prototype de batteries Na-ion, fruit d’une collaboration entre le CEA et le CNRS, a vu le jour en 2015 (Figure 2). Ce prototype possède une énergie spécifique de 90 Wh/kg, qui peut être améliorée jusqu’à 130-140 Wh/kg, ce qui est encourageant pour l’avenir des batteries Na-ion [21].
L'animation pédagogique ci-dessous présente cette innovation :
Le Sodium, un nouvel avenir pour les batteries ! par CNRS
Pour en savoir plus sur cette innovation du CNRS et du CEA
Comme le sodium, le magnésium est très abondant et a un coût peu élevé. Contrairement au sodium, la taille l’ion magnésium n’est pas un problème pour la diffusion (Tableau 3) car elle est du même ordre de grandeur que celle de l’ion lithium. Un des grands avantages de cet élément est de pouvoir conduire deux charges par atome au lieu d’une pour les éléments Li ou Na mais sa divalence est également l’inconvénient majeur pour le développement de ces batteries. En effet, sa mobilité est impactée par ses deux charges (liaisons plus fortes entre le métal et la matrice) et les efforts dans le cas des batteries Mg-ion sont dirigés vers de nouvelles formulations d’électrolyte adaptées aux éléments divalents [20].
Références (communes aux deux volets)
[1] J.M. Tarascon, Enjeux et défis du stockage électrochimique de l’énergie, (2014)
[2] M. Joulié, Mécanismes de dissolution de matériaux actifs d’électrodes de type LiNi1/3Mn1/3Co1/3O2 d’accumulateurs Li-ion en vue de leur recyclage, Ecole Nationale Supérieure de Chimie Montpellier, 2015.
[3] Site Sciences de l'Ingénieur de l'ENS Paris-Saclay
[4] J.M. Tarascon, Histoire et évolution des technologies d’accumulateurs, (2011).
[5] Nickel-based Batteries Information – Battery University, (n.d.). (accessed August 24, 2016).
[6] Lithium-based Batteries Information – Battery University, (n.d.). (accessed August 24, 2016).
[7] Li-polymer Battery: Substance or Hype? – Battery University, (n.d.). (accessed August 24, 2016).
[8] N. Nitta, F. Wu, J.T. Lee, G. Yushin, Li-ion battery materials: present and future, Mater. Today. 18 (2015) 252–264. doi:10.1016/j.mattod.2014.10.040.
[9] Types of Lithium-ion Batteries – Battery University, (n.d.). (accessed August 24, 2016).
[10] K. Mizushima, P.C. Jones, P.J. Wiseman, J.B. Goodenough, LixCoO2.
[11] A. Rougier, Optimization of the Composition of the Li[sub 1−z]Ni[sub 1+z]O[sub 2] Electrode Materials: Structural, Magnetic, and Electrochemical Studies, J. Electrochem. Soc. 143 (1996) 1168. doi:10.1149/1.1836614.
[12] A.R. Armstrong, P.G. Bruce, Synthesis of layered LiMnO2 as an electrode for rechargeable lithium batteries, Nature. 381 (1996) 499–500. doi:10.1038/381499a0.
[13] C.H. Chen, J. Liu, M.E. Stoll, G. Henriksen, D.R. Vissers, K. Amine, Aluminum-doped lithium nickel cobalt oxide electrodes for high-power lithium-ion batteries, J. Power Sources. 128 (2004) 278–285. doi:10.1016/j.jpowsour.2003.10.009.
[14] K.M. Shaju, P.G. Bruce, Macroporous Li(Ni1/3Co1/3Mn1/3)O2: A High-Power and High-Energy Cathode for Rechargeable Lithium Batteries, Adv. Mater. 18 (2006) 2330–2334. doi:10.1002/adma.200600958.
[15] A. Yamada, S.C. Chung, K. Hinokuma, Optimized LiFePO[sub 4] for Lithium Battery Cathodes, J. Electrochem. Soc. 148 (2001) A224. doi:10.1149/1.1348257.
[16] Experimental Rechargeable Batteries – Battery University, (n.d.). (accessed August 24, 2016).
[17] M.-S. Park, J.-G. Kim, Y.-J. Kim, N.-S. Choi, J.-S. Kim, Recent Advances in Rechargeable Magnesium Battery Technology: A Review of the Field’s Current Status and Prospects, Isr. J. Chem. 55 (2015) 570–585. doi:10.1002/ijch.201400174.
[18] Y. Wang, R. Chen, T. Chen, H. Lv, G. Zhu, L. Ma, C. Wang, Z. Jin, J. Liu, Emerging non-lithium ion batteries, Energy Storage Mater. 4 (2016) 103–129. doi:10.1016/j.ensm.2016.04.001.
[19] X. Xiang, K. Zhang, J. Chen, Recent Advances and Prospects of Cathode Materials for Sodium-Ion Batteries, Adv. Mater. 27 (2015) 5343–5364. doi:10.1002/adma.201501527.
[20] P. Saha, M.K. Datta, O.I. Velikokhatnyi, A. Manivannan, D. Alman, P.N. Kumta, Rechargeable magnesium battery: Current status and key challenges for the future, Prog. Mater. Sci. 66 (2014) 1–86. doi:10.1016/j.pmatsci.2014.04.001.
[21] Batterie sodium-ion: une révolution en marche | CNRS Le journal (n.d.). (accessed August 25, 2016).