Il s'agit du second article du dossier traitant de l'écocatalyse, domaine de la chimie verte associant phytoremédiation de régions polluées par des éléments métalliques et synthèse de molécules utilisant ces éléments métalliques comme catalyseurs. Les applications de l'écocatalyse sont nombreuses : domaines des colorants, des polymères, des cosmétiques et plus largement toute la chimie de synthèse.
Le premier article aborde les notions de pollution métallique, de phytoremédiation et d'écocatalyse ; le deuxième article (ci-dessous) présente quelques exemples des performances de l'écocatalyse.
Quels exemples concrets des performances de l’écocatalyse
Réactions multicomposants
Au-delà des transformations simples, la catalyse polymétallique est particulièrement adaptée aux réactions multi-composants (RMC) qui présentent des mécanismes séquentiels et complexes.
Les réactions multicomposants mettent en jeu au moins trois réactifs et conduisent à un produit dans lequel sont imbriqués tous les atomes (ou du moins la majeure partie) de ces réactifs. Elles permettent d'obtenir, à partir de réactifs aux structures assez simples, un produit à la structure complexe.
Étant donné que les réactifs (et l'éventuel catalyseur) sont introduits en même temps dans un unique réacteur, les réactions multicomposants font partie des réactions « one-pot ».
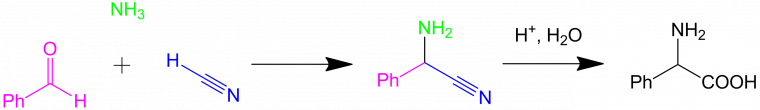
La découverte de la première réaction multicomposants revient à Auguste Laurent et Charles GERHARDT en 1838. Elle implique l'acide cyanhydrique, l'ammoniac et le benzaldéhyde :
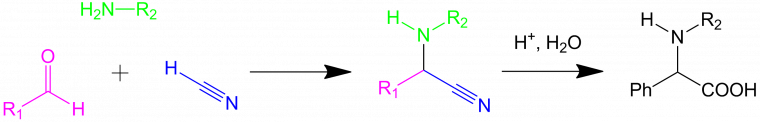
Quelques années plus tard, en 1850, Strecker synthétise des α-amino-acides à partir d'un aldéhyde, d'acide cyanhydrique et d'ammoniac, selon le schéma ci-dessous :
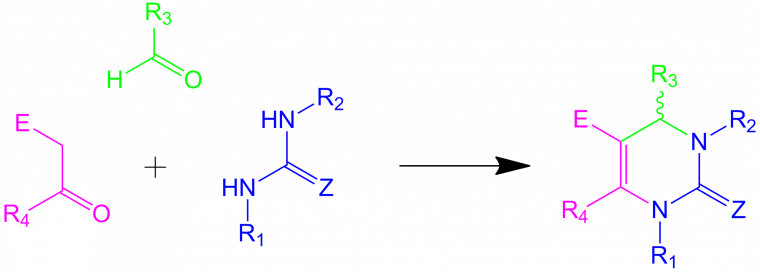
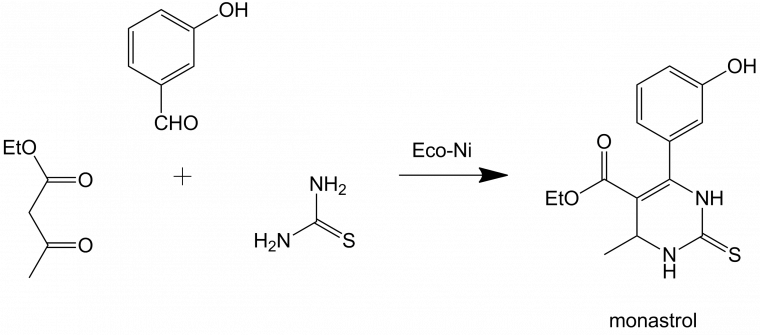
La fin du XIXe siècle voit la découverte d'autres RMC. Ne pouvant toutes les citer, intéressons-nous à la réaction de Biginelli, découverte en 1891, qui met en jeu l’urée, le benzaldéhyde et un β-cétoester. Elle conduit à des dihydropyrimidones, qui ont souvent des propriétés biologiques :
L'intérêt des réactions multicomposants est leur gain de temps et la minimisation des pertes de matière : la réaction de Biginelli illustre la possibilité d'obtenir un hétérocycle complexe en une seule étape réactionnelle, ce qui économise autant d'étapes de traitement et de purification qui sont habituellement nécessaires lors d'une synthèse multi-étapes. Quand on sait que chaque étape réactionnelle induit de facto une chute de rendement, les réactions multicomposants revêtent un intérêt tout particulier pour l'optimisation du rendement d'une synthèse. Pour ces raisons, elles sont très prisées de l'industrie pharmaceutique et l'industrie agrochimique.
Par ailleurs, les RMC sont en adéquation avec certains principes de la chimie verte, notamment la limitation des déchets. Elles s'inscrivent donc parfaitement dans le cadre d'une chimie durable et respectueuse de l'environnement [25].
Une nouvelle approche de la chimie pharmaceutique : de l’hyperaccumulateur de nickel Psychotria douarrei au monastrol
La supériorité de l’écocatalyse pour la synthèse organique semble découler de la possibilité de sélectionner précisément l’interaction métal-substrat grâce à la présence de différents sites métalliques aux propriétés complémentaires. Dans ce contexte, les réactions multicomposants, telles que la réaction de Biginelli, sont d’excellents modèles d’études.
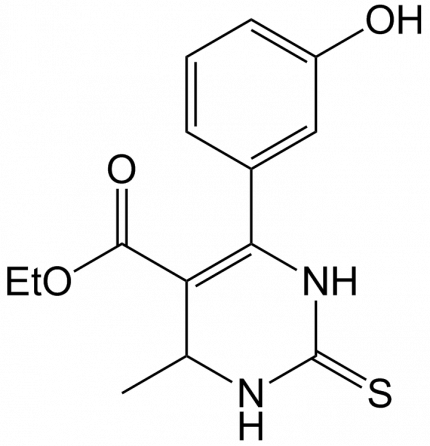
L’exemple choisi est la synthèse du monastrol, un hétérocyle intéressant pour ses propriétés antimitotiques. Il est, en effet, capable de bloquer la migration des chromosomes vers les pôles cellulaires lors de la mitose.
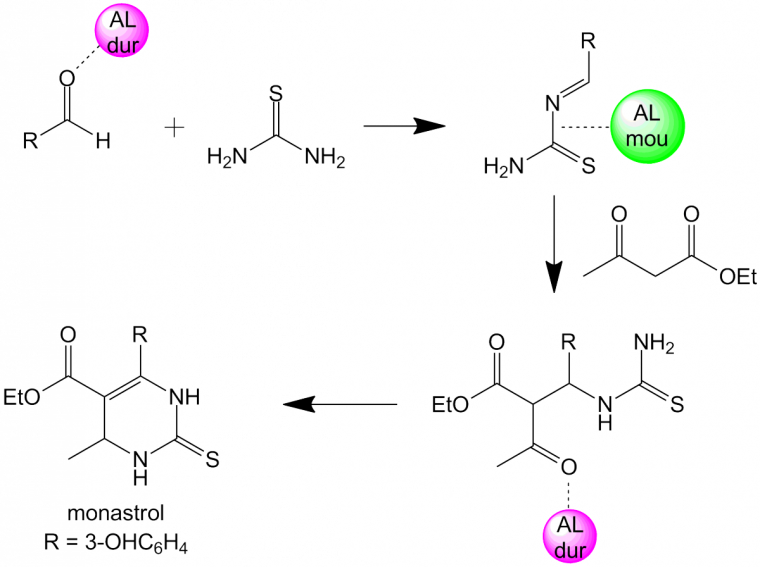
La préparation du monastrol nécessite l’activation successive de sites basiques durs et mous pour construire l’hétérocycle final. Les résultats obtenus sont le reflet de la théorie « Hard and Soft Acid and Base ». Un acide dur (c’est-à-dire une espèce accepteuse d’électrons, de forte charge positive, de petite taille) réagira préférentiellement avec une base dure (soit une espèce donneuse d’électrons, de faible polarisabilité, de forte électronégativité, présentant des orbitales vacantes difficilement accessibles) et inversement.
Cette situation a été exploitée par le laboratoire ChimEco, notamment dans le cas de la réaction multicomposants de Biginelli, où la première étape implique une catalyse par un acide de Lewis dur, formant une alkylidène thiourée, base molle typique, qui réagit avec l’acétoacétate d’éthyle sous catalyse par un acide de Lewis mou.
Enfin, le dernier intermédiaire subit une cyclisation sous catalyse acide de Lewis dur, pour aboutir au monastrol, molécule ayant révélé une forte activité antimitotique.
L’un des acides de Lewis utilisés lors de cette synthèse peut être l’ion Ni2+. La comparaison de l’activité de l’Eco-Ni à celle de NiCl2 montre l’intérêt d’une catalyse polymétallique par des acides de Lewis modulés, puisque le monastrol est obtenu à raison de 72 % avec Eco-Ni et seulement 11 % avec NiCl2 [10]. Une raison pouvant expliquer ce résultat est l’activité plus douce des sels mixtes métal de transition/métal alcalin ou alcalino-terreux, dont la densité électronique est différente de celle des sels simples tels que NiCl2.
Pour plus d'information, lire La transcription chez les eucaryotes édité par Planet-Vie
Synthèse chimique d'ARN 5'-coiffés
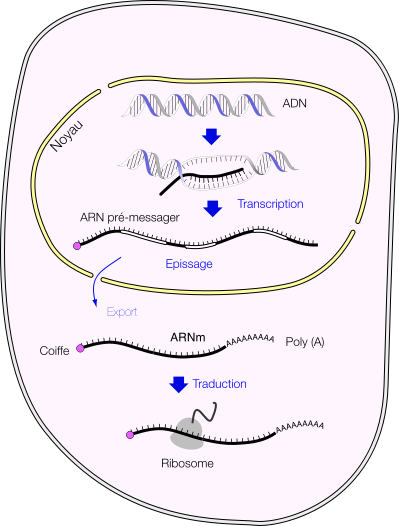
Les ARN messagers (notés ARNm) sont l'intermédiaire entre l’ADN et les protéines ; ils permettent l'exportation de l’information génétique contenue dans le noyau vers le cytoplasme de la cellule eucaryote. Après leur synthèse dans le noyau cellulaire à partir de l’ADN, les pré-ARNm subissent des modifications post-transcriptionnelles : l'épissage, le coiffage et la polyadénylation sont les trois étapes menant du pré-ARNm à l’ARNm mature.
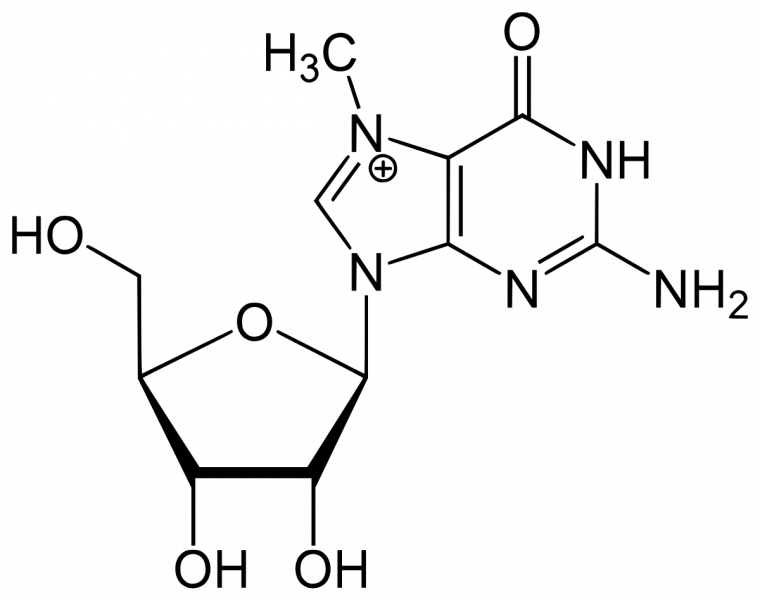
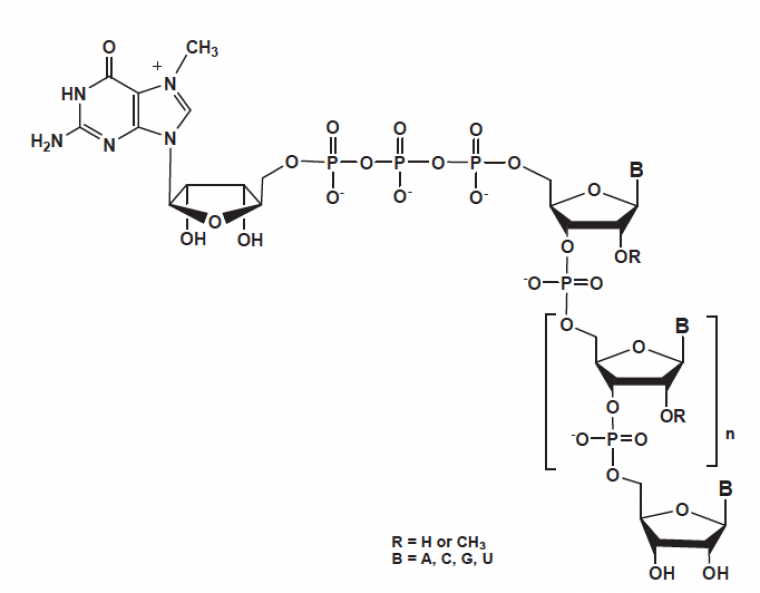
Dans l'étape de coiffage, une 7-méthylguanosine est attachée à l'extrémité 5'-terminale du pré-ARNm :
Au cours de la traduction, le recrutement des ribosomes est réalisé par des contacts entre la coiffe et une sous-unité ribosomale.
L'étape de coiffage est catalysée in vivo par l'activité d'enzymes spécifiques. Le processus de laboratoire habituel pour procéder à cette étape de coiffe utilise également des enzymes avec de faibles quantités produites. La capacité à produire des ARNm en grande quantité à des fins industrielles ou académiques est en réalité très intéressante. La synthèse de la coiffe 5'-triphosphate a de nombreuses applications en biologie moléculaire et constitue en soi un résultat intéressant en termes de synthèse organique. En virologie par exemple, la possibilité de synthétiser des ARNm matures est nécessaire pour produire de grandes quantités de protéines, afin d’en réaliser l’analyse cristallographique et d’accéder ainsi à leurs structures tridimensionnelles. La synthèse de l'oligonucléotide GpppT6 (une guanosine liée à six thymines par une liaison phosphate) a été réussie par écocatalyse dans des conditions très prometteuses :
Les écocatalyseurs à base de zinc (Eco-Zn) et de nickel (Eco-Ni) se sont révélés être les plus efficaces. Leur structure polymétallique permet en effet d’activer simultanément les trois sites réactionnels nécessaires à la transformation fonctionnelle recherchée [11].
Anthyllis vulneraria et Noccaea caerulescens sont des plantes hyperaccumulatrices permettant d'obtenir des écocatalyseurs à base de zinc. Geissois pruinosa et Psychotria douarrei sont des plantes hyperaccumulatrices permettant d'obtenir des écocatalyseurs à base de nickel.
Les exemples d’applications de l’écocatalyse sont nombreux et ont permis de revisiter l’ensemble des grands mécanismes de la chimie organique (catalyse acide de Lewis, oxydations, réductions, couplages croisés). Ces résultats pionniers ont révélé le potentiel extraordinaire des catalyseurs dérivés des plantes hyperaccumulatrices d’ETM développées en phytoextraction. Il s’agit des écocatalyseurs de première génération (Eco-Zn, Eco-Ni, Eco-Mn) [12-19], qui découlent de la phytoextraction des ressources minérales primaires (Zn, Ni, Mn). Le concept est aujourd’hui étendu aux métaux nobles (exemple : Pd, Pt), aux terres rares (par exemple Eu, Ce) et aux éléments métalliques d’avenir (Fe, Cu) considérés comme une alternative catalytique durable aux métaux nobles. Le développement de ces écocatalyseurs de deuxième génération est possible grâce à la rhizofiltration [20-23]. Ce sont donc, cette fois, des efforts de dépollution de l’eau contaminée par les métaux qui conduisent à des catalyseurs polymétalliques d'origine purement écologique. La combinaison rhizofiltration – écocatalyse conduit à des applications extrêmement vastes en chimie catalytique. Un exemple typique est développé ci-dessous ; il permet de montrer qu’un catalyseur homogène peut être facilement recyclé.
Quand les catalyseurs homogènes deviennent recyclables
L’exemple choisi pour illustrer ce nouveau principe est celui de la chimie clic (« click ») qui permet de clipser une biomolécule d'intérêt (une protéine par exemple) à une autre molécule. L’exemple le plus connu est celui de la cycloaddition de Huisgen catalysée par le Cu(I). Cette réaction, catalysée par le Cu(I), permet de lier deux molécules par un lien triazole extrêmement stable via une réaction de cycloaddition [3+2] entre un azoture (2) et un alcyne terminal (1). La présence du cuivre permet d’accélérer la réaction de manière considérable mais également d’obtenir sélectivement le triazole-1,4 (3), un des deux isomères possibles.
Du fait de sa simplicité de mise en œuvre, de son efficacité et de l’absence de sous-produits, cette réaction est rapidement devenue l’une des réactions les plus utilisées dans tous les domaines des sciences chimiques et biologiques. Compte-tenu de ses applications dans le domaine des mimes synthétiques de peptides naturels, de la bioconjugaison (couplage chimique de biomolécules in vivo et in cellulo), des modifications de produits naturels et bioactifs, des réactions de marquages in vivo, et donc de son utilité en milieu aqueux, la préparation de catalyseurs efficaces en milieu aqueux présente un intérêt certain.
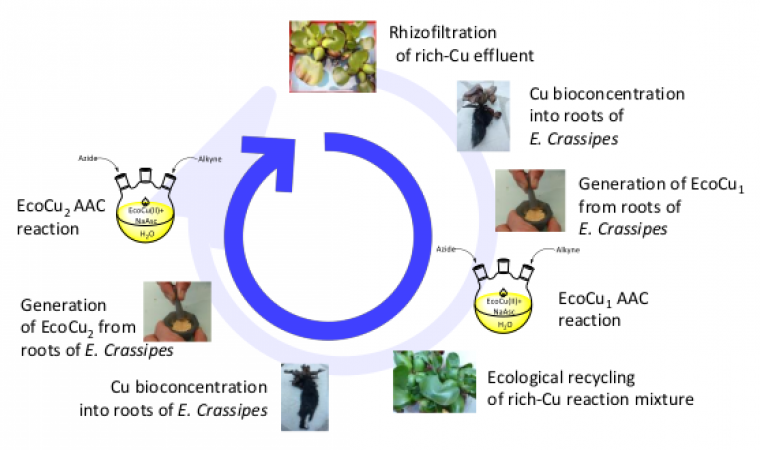
La rhizofiltration d’effluents contaminés par des sels de cuivre (Cu(II)) a permis de régénérer un Eco-Cu (II) dans des conditions d’efficacité et de rapidité impressionnantes (95% du cuivre contenu dans les effluents est extrait en moins de 2h) [21].
Les Eco-Cu(II) sont solubles dans l’eau, stables et faciles à manipuler ont été réduits in situ par l’ascorbate de sodium (sel de sodium de l’acide ascorbique, appelé aussi vitamine C) en Eco-Cu(I). Ils ont alors permis de catalyser la réaction clic de Huisgen de façon performante. En fin de réaction, les Eco-Cu (II), solubles dans l’eau, ont été recyclés par simple rhizofiltration de la phase aqueuse, puis retransformés en Eco-Cu(I), sans perte d’activité. Il s’agit d’un principe qui s’appuie sur un fonctionnement en économie circulaire.
Cette étude a permis de prouver qu’il était possible de travailler en catalyse homogène tout en recyclant le catalyseur, ce qui ouvre de nouvelles perspectives en chimie catalytique. Ce principe a été étendu à l’ensemble des métaux de transition et des terres rares [24].
Conclusion
Afin de restaurer les milieux naturels dégradés ou pollués par des activités industrielles passées ou en cours, des programmes de phytoremédiation sont développés dans quelques pays. La phytoextraction et la rhizofiltration font partie des phytotechnologies les plus prometteuses, capable d’apporter une dimension sociale et économique aux efforts de réhabilitation. Elles reposent sur l’utilisation de plantes capables d’extraire les éléments métalliques des sols ou de l’eau, contribuant ainsi à la diminution progressive de la teneur en ETM dans l’environnement. Bien que ces phytotechnologies présentent de nombreux avantages, leur développement est resté limité par l’absence de procédés économiquement viables de valorisation de la biomasse hautement chargée en ETM et donc considérée, jusqu’à présent, comme un déchet contaminé et indésirable.
L’existence de ces différentes problématiques a conduit à rechercher une solution durable et rentable de valorisation de cette biomasse, grâce à la mise en place d’une nouvelle filière verte circulaire basée sur le recyclage des éléments métalliques accumulés par les plantes utilisées en phytoextraction et en rhizofiltration. Tirant parti de la capacité remarquable de ces végétaux à accumuler les cations tels que Zn2+, Ni2+, Mn2+, Cu2 +, Pd2+,…, la conception du procédé repose sur l’utilisation directe des espèces métalliques d’origine végétale comme réactifs ou catalyseurs de réactions chimiques organiques. Cette approche originale offre la première perspective de valorisation de cette biomasse unique et initie une nouvelle branche de la chimie verte : l’écocatalyse. Les phytotechnologies de récupération des ETM telles que la phytoextraction sont désormais des sources d’innovation en synthèse organique et la synthèse organique est la force motrice des phytotechnologies développées.
Les résultats obtenus par le Laboratoire de chimie bio-inspirée et innovations écologiques ont montré que les écocatalyseurs peuvent présenter des performances et des sélectivités très supérieures aux catalyseurs classiques. Ce nouveau concept a permis la préparation d’une large variété de catalyseurs écologiques performants, à réactivité modulable, tout en respectant les principes de la chimie durable. Les écocatalyseurs ont permis de revisiter tous les grands mécanismes de la synthèse organique en accord avec la réglementation REACH.
L’approche biosourcée de la catalyse, pilier de la chimie verte, permet d’associer les avantages des catalyses homogène et hétérogène, telles que sélectivité, activité et recyclabilité.
Le concept de l’écocatalyse permet de se libérer de l’intégralité des limitations propres aux méthodes existantes via une nouvelle génération de matériaux fonctionnels écologiques stables et présentant plusieurs interfaces réactives dont les propriétés sont directement liées à la biodiversité des efforts de phytoextraction et de rhizofiltration.
Les écocatalyseurs possèdent un haut potentiel synthétique et des performances très supérieures aux catalyseurs conventionnels dans un certain nombre de transformations, qui peuvent être mises à profit dans la synthèse de biomolécules complexes à l’impact industriel et sociétal important. Ils permettent notamment la synthèse de molécules recherchées telles que molécules antimitotiques, molécules actives contre le paludisme, parfums, arômes, cosmétiques et intermédiaires-clés de l’industrie chimique.
Ils ne sont donc pas de simples substituts à des catalyseurs issus de la métallurgie, mais de nouveaux outils qui intègrent une triple vision : chimie, écologie, environnement.
Bibliographie et références (communes aux deux volets)
- Baker A.J., Ernst W.H., Van der Ent A. et al., « Metallophytes : the unique biological resource, its ecology and conservational status in Europe, Central Africa and Latin America », Ecology of Industrial Pollution, Cambridge University Press, Cambridge 2010, 7-40.
- Van der Ent A., Baker A.J.M., Reeves R.D. et al., « Hyperaccumulators of metal and metalloid trace elements : facts and fiction », Plant Soil, 2013 362, 319-334.
- Bert V., Seuntjens P.Dejonghe W.Lacherez S.Thi Thanh Thuy H.Vandecasteele B. Phytoremediation as a management option for contaminated sediments in tidal marshes, flood control areas and dredged sediment landfill sites. Environmental Science and Pollution Research 2009, 16, 745 – 764
- Bert V, Tack K, Vialletelle F, Magnie MCL, Berquet A, Cochet N, Schoefs O. Prospects in biomass valorization from phytoextraction of Cd, Pb and Zn with hyperaccumulators. Recents Progrès en Génie des Procédés, 2009, 98: 297-1:6, Ed. SFGP, Paris (Fr).
- Delplanque M., Collet S., Del Gratta F. et al., « Combustion of Salix used for phytoextraction : the fate of metals and viability of the processes », Biomass & Bioenergy, 2013, 49, 160-170.
- Chaney, R.L., Angle, J.S., Baker, A.J.M., Li, Y.M.. Method for phytomining of nickel, cobalt and other metals from soils. U.S. Patent 5 711 784 1998.
- Bani, A (2009), Thèse de l’Université Agricole de Tirana
- Grison C., Special Issue in Environmental Science and Pollution Research (Ed. Invite C. Grison) : Combining Phytoextraction and EcoCatalysis: an Environmental, Ecological, Ethic and Economic Opportunity, Environ. Sci. Pollut. Res. 2015,22, 5589-5698.
- P.-A. Deyris, C. Grison, Nature, Ecology and Chemistry : an unsual combination for a new green catalysis, Ecocatalysis, Curr. Opin. Green Sustain. Chem. 2018 (Ed. invited) doi :10.1016/ j.cogsc.2018.02.002.
- Grison C.M., Escande V., Petit E., Garoux L., Boulanger C., Grison C. Psychotria douarrei and Geissois pruinosa, novel resources for the plant-based catalytic chemistry, RCS Advances, 2013, 3(44), 22340-22345.
- Thillier Y., Losfeld G., Escande V., Dupouy C., Vasseur J-J., Debart, F. Grison C., Solid-phase synthesis of 5’-capped RNA with polymetallic catalysts prepared from metallophytes species, RCS Advances 2013, 3 (15), 5204-5212.
- P.-A. Deyris, E. Petit, Y.-M. Legrand, S. Diliberto, C. Boulanger, V.Bert, C. Grison, Biosourced polymetallic catalysis : A surprising and efficient means to promote the Knoevenagel condensation, Front. Chem.2018. doi : 10.3389/fchem.2018.00048, P.-A. Deyris, E. Petit, Y.-M. Legrand, S. Diliberto, C. Boulanger, V.Bert, C. Grison
- V. Escande, C. Poullain, G. Clavé, E.Petit, N. Masquelez, P. Hesemann, C. Grison, Alternative Green and Ecological Input for Transfer Hydrogenation using EcoNi(0) Catalyst in Isopropanol, Applied Catalysis B., 2017, 2017, 210, 495-503.
- V. Escande, C. H. Lam, C. Grison, P.T. Anastas, EcoMnOx, a Biosourced Catalyst for Selective Aerobic Oxidative Cleavage of Activated 1,2-Diols, ACS Sustainable Chem. Eng., 2017, 5 (4), pp 3214–3222
- Escande V., Petit E., Garoux L., Boulanger C., Grison C., Switchable alkene epoxidation/oxidative cleavage with H2O2-NaHCO3: efficient heterogeneous catalysis derived from biosourced Eco-Mn, ACS Sustainable Chem. Eng., 2015, 3 (11), 2704–2715.
- Escande V., Garoux L., Grison C.M., Thillier Y., Debart F., Vasseur J.J., Boulanger C., Grison C., Ecological catalysis and phytoextraction Symbiosis for future, Appl. Catal. B, 2014, 146, 279-288.
- Escande V., T.K. Olszewski, E. Petit, C. Grison Biosourced Polymetallic Catalysts: An Efficient Means To Synthesize Underexploited Platform Molecules from Carbohydrates, ChemSusChem, 2014, 7, 1915-1923. .
- Escande V., Velati A., Garel C., Renard B.L., Petit, E., Grison C., Phytoextracted mining wastes for Ecocatalysis: Eco-Mn®, an efficient and eco-friendly plant-based catalyst for reductive amination of ketones, Green Chemistry, 2015, 17, 2188-2199.
- Losfeld G., Vidal de la Blache P., V. Escande V., L’huillier L., Jaffre T., Grison C. The chemical exploitation of nickel phytoextraction : an environmental, ecologic and economic opportunity for New-Caledonia, Chemosphere, 2012, 89 (7) 907-910.
- G. Clavé, F. Pellissier, S. Campidelli, C. Grison Ecocatalyzed Suzuki-Miyaura cross coupling of heteroaryl compounds, Green Chem. 2017,19, 4093-4103
- G. Clavé, L. Garoux, C. Boulanger,P. Hesemann. C. Grison, Ecological Recycling of a Bio-Based Catalyst for Cu Click Reaction: a New Strategy for a Greener Sustainable Catalysis, Chemistry Select, 2016, 1410-1416
- Clavé G., Garel C., Poullain C., Renard B.L., Lange B., Shutcha M., Faucon M.P., Grison C., Ulmann reaction through ecocatalysis: insights from bioressource and synthetic potential, RCS Advances 2016, 6, 59550–59564.
- Garel C., Renard B.L., Escande V.,Galtayries A., Hesemann P., Grison C., C-C bond formation strategy through ecocatalysis: insights from structural studies and synthetic potential, Applied Catalysis A. 2015, 504, 272-286
- C. Grison, A. Stanovych, Procédé de préparation de matériau d'origine végétale riche en acides phénoliques, comprenant au moins un métal, pour la mise en œuvre de réaction de synthèse organique, PCT/EP2018/058362 déposé le 30/03/2018
- Synthèse parallèle basée sur la réaction multicomposants de Biginelli, Xavier Bataille et Erwan Beauvineau, Actualité Chimique, mai 2009.
- Françoise Ibarrondo, Gilles Camus, La transcription chez les eucaryotes, Planet-Vie, Mardi 12 décembre 2006, https://planet-vie.ens.fr/article/1482/transcription-eucaryotes