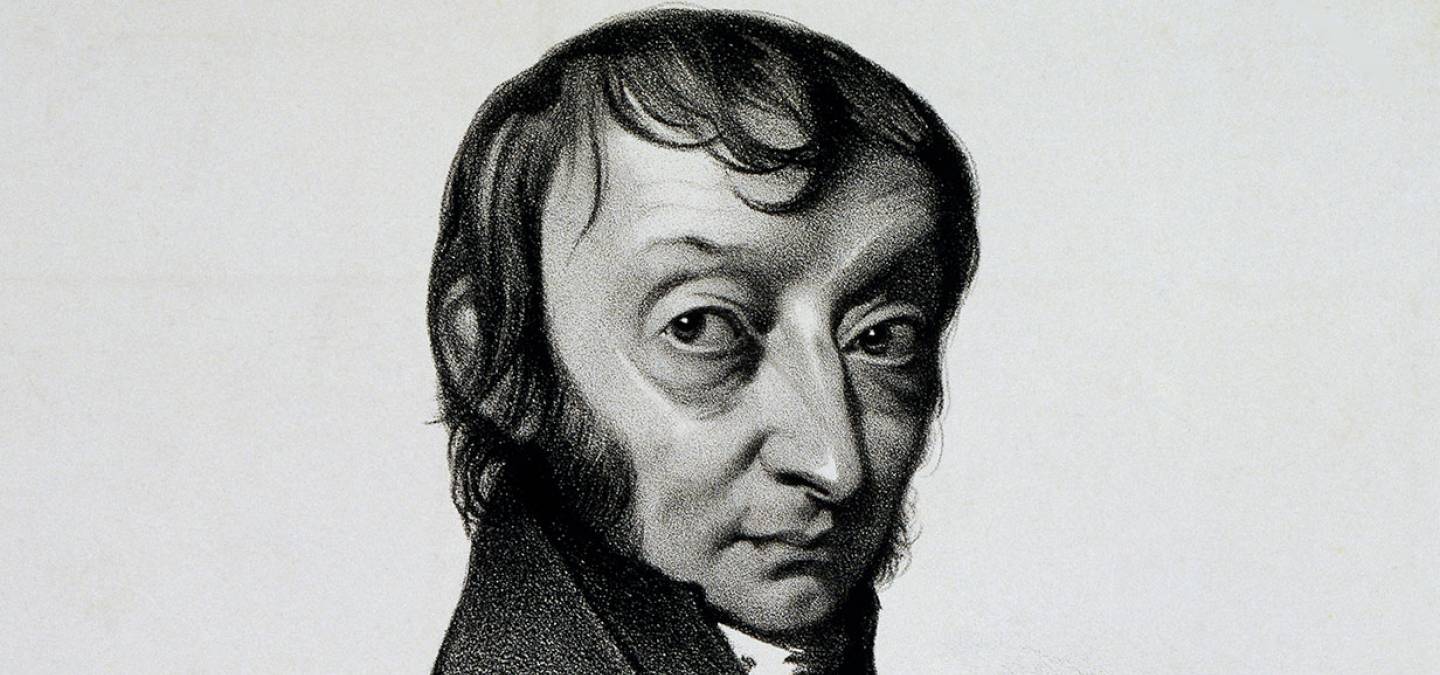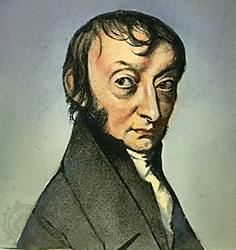La définition de la mole1, unité de mesure des quantités de matière du Système International, date de 1971 soit il y a seulement 41 ans ! Le nombre d'entités (atomes, molécules, ions, électrons, etc.) contenues dans une mole est connue sous le nom de constante d'Avogadro. C'est l'histoire particulière de cette constante et du scientifique dont elle porte le nom que nous allons détailler dans cet article.
Biographie d'Avogadro
Né à Turin en Italie, le 9 août 1776, le comte Amedeo Avogadro (figure 1) obtient son baccalauréat en 1792. Il suit les pas de son père, célèbre avocat, en entrant à l’université de droit de Turin. Trois années plus tard il reçoit son diplôme de jurisprudence puis le titre de docteur en droit canonique. Exerçant dans des cabinets d’avocats et autres positions administrative, ce n'est que sur la tard qu'émerge sa vocation scientifique.
A la toute fin du XVIIIème siècle, il reçoit des cours de physique, notamment d’électricité et publie, dans la foulée, deux essais sur l’électricité. Ses débuts au sein de la communauté scientifique de Turin sont remarqués et Avogadro devient membre de l’Académie de Sciences de Turin en 1804.
En 1809, ses travaux prennent une nouvelle direction après la lecture de l’ouvrage System of Chemistry de Thomas Thomson, un des premiers chimistes à accepter la théorie atomique. Avogadro s’attache alors durant deux années à prouver, comme nous le verrons, que l’approche atomistique de Dalton et l’approche volumétrique proposée par Gay-Lussac ne sont pas aussi incompatibles qu’elles le semblent au début du XIXème siècle. C'est en 1811 qu'Avogadro énonce sa célèbre hypothèse. Ignorée durant les cinquante années qui suivent sa publication, son hypothèse est aujourd’hui reconnue pour avoir permis une avancée conséquente dans la recherche scientifique du XIXème siècle.
En janvier 1815 il épouse Felicita Mazzia avec qui il aura 7 enfants. Avogadro consacre alors le reste de sa vie à la famille plutôt qu’à la poursuite de son succès professionnel. Il décède le 9 juillet 1856 à Turin à l'âge de 80 ans.
Contribution d'Avogadro à la chimie du XIXème siècle
Pour la majorité des chimistes du début du XIXème siècle, l’existence d’atomes semble être une idée complètement farfelue. Une description précise de la matière devient alors nécessaire pour expliquer de nombreux résultats expérimentaux.
Les partisans de la théorie atomique s'accordent sur une description corpusculaire de la matière. C'est à dire que la matière n'est ni continue, ni divisible à l'infini et est donc constituée de particules insécables aujourd'hui appelées atomes. John Dalton (1766-1844), fidèle défenseur de cette théorie énonce, en 1810, dans la deuxième partie de son ouvrage New System of Chemical Philosophy, la loi des proportions multiples. Si deux corps simples A et B forment plusieurs composés - AB, AB2, A2B, etc... -, le poids de l'un des corps rapporté au poids de l'autre dans un composé sont entre eux dans le rapport de deux nombres entiers petits. Par exemple, le chlore se combine à l’oxygène pour donner trois composés différents : Cl2O, ClO2 et Cl2O7. Les masses de l’oxygène ramenés à une masse constante de chlore (par exemple 100 g) sont entre eux dans un rapport simple entier, en l’occurrence 1, 4 et 7. Grâce à cette loi, Dalton détermine les poids atomiques relatifs des corps simples en prenant pour unité la masse de l'hydrogène et en considérant que le poids atomique de chaque élément est la quantité pondérale qui s’unit avec un gramme d’hydrogène pour former la combinaison la plus stable.
A la même époque, Gay-Lussac s'intéresse à la combinaison de composés chimiques gazeux et énonce une loi assez semblable à celle de Dalton : « Tous les gaz, en agissant les uns sur les autres, se combinent toujours dans les rapports les plus simples... de 1 à 1, de 1 à 2, ou de 1 à 3...Ces rapports de volume ne s'observent point dans les substances solides et liquides, ou lorsqu'on considère les poids. »
Cette théorie est fortement rejetée par Dalton puisqu’elle lui paraissait être incompatible avec la synthèse de l'eau. En effet, Dalton fait l'hypothèse simple – simpliste ? - que deux éléments ne formant qu'une seule combinaison s'associent forcément atome à atome. Il décrit alors la réaction de formation de l'eau par la réaction H + O → HO tandis que les mesures des volumes de Gay-Lussac vont dans le sens de la réaction 2H + O → H2O puisqu’elle nécessite la réaction entre deux volumes d’hydrogène et un volume d’oxygène.
Afin de donner une explication théorique à la loi des volumes de Gay-Lussac, Avogadro énonce dans son essai publié en 1811 (voir figure 3) intitulé Essai d'une manière de déterminer les masses relatives des molécules élémentaires des corps et les proportions selon lesquelles elles entrent dans les combinaisons :
« Le nombre de molécules intégrantes (i.e ce que l'on appelle simplement les molécules aujourd'hui) dans les gaz quelconques est toujours le même à volume égal, ou est toujours proportionnel aux volumes. »
Pour arriver à son hypothèse, Avogadro explique : puisque les gaz ont tous sensiblement le même coefficient de dilatation et qu’ils se compriment de la même façon (à température et pression identiques), il y a forcément le même « vide » entre les particules donc le même nombre d’espèces dans un même volume. Cependant Avogadro produit une objection à son hypothèse. En effet, si dans une combinaison une molécule d’un gaz se combine avec plusieurs molécules d’un autre gaz, le nombre de molécules du composé résultant devrait rester le nombre de molécules du premier gaz. Or ce n’est pas en accord avec les résultats de Gay-Lussac concernant la réaction de formation de l’eau. Pour résoudre ce problème Avogadro émet l'hypothèse que l’hydrogène et l’oxygène sont en fait des molécules diatomiques. L’équation de formation de l’eau devient : 2H2 + O2 → 2 H2O. Avogadro conclut son travail en affirmant que son hypothèse « n’est au fond que le système de Dalton, muni d’un nouveau moyen de précision par la liaison que nous y avons trouvée avec le fait général établi par M. Gay-Lussac ». Grâce à son hypothèse Avogadro réconcilie les travaux de Dalton et Gay-Lussac.
Ampère énoncera en 1814, trois années plus tard, une hypothèse analogue tout en précisant qu'il n'a eu connaissance de l'hypothèse d'Avogadro qu'après la rédaction de son travail.
L'incompréhension de la communauté scientifique
Dans un premier temps, l’hypothèse d’Avogadro est ignorée, rejetée ou encore incomprise. Cette ignorance peut en partie se justifier par la personnalité quelque peu atypique d'Avogadro. Contrairement à bon nombre de ses contemporains, il n’a pas de mentor. Ne faisant parti d’aucun groupe de recherche, il ne communique et ne voyage pratiquement jamais. Son manque de contact avec le monde intellectuel et scientifique limite l’engouement autour de son essai.
De plus, à cette époque peu de crédits sont apportés aux travaux n’ayant pas été vérifiés expérimentalement. Or Avogadro se restreint à une étude théorique de la chimie, utilisant les résultats expérimentaux d’autres scientifiques.
L'hypothèse d'Avogadro est sans doute trop novatrice par rapport au savoir de l'époque. Supposer des molécules composées de deux atomes semblables paraît scandaleux, surtout dans le cadre de la théorie électrochimique de Berzelius où toute combinaison s’explique par des charges électriques opposées. Enfin son hypothèse suppose l’existence d’atomes au sein du gaz, théorie qui est encore fortement rejetée à cette époque.
La reconnaissance : la constante d’Avogadro
Ce n'est qu'une cinquantaine d'années plus tard que l'hypothèse d'Avogadro est ressuscitée. Dans son mémoire Sunto di un corso di Filosofia chimica publié en 1858, Stanislao Cannizzaro (1826-1910), qui a alors 33 ans, présente ses investigations sur le travail d’un demi-siècle de chimistes et physiciens à travers l’Europe (figure 4). Bien qu’il n’ajoute pas de nouvelles pièces au puzzle, Cannizzaro a la capacité intellectuelle de relier toutes les informations dont il dispose, éclairant des conceptions qui étaient auparavant obscures et confuses. Il y fait notamment le point sur les cinquante ans qui ont suivi la publication de l’hypothèse moléculaire d’Avogadro.
La première estimation de la constante est réalisée par Loschmidt, à partir de la densité de particules dans un gaz idéal ; elle a pour valeur NL = 2.6868x1025 m-3 (constante de Loschmidt). Lorsque le physicien américain Robert Millikan détermine la charge d’un électron en 1910, la communauté scientifique accède à des mesures plus précises de la constante. La charge d’une mole d’électron est connue depuis 1834 grâce aux travaux de Michael Faraday sur l’électrolyse. La valeur du nombre d’Avogadro est alors obtenue en divisant la charge d’une mole d’électron par la charge d’un électron.
En 1909, le physicien Jean Perrin, qui a déterminé le nombre d’Avogadro par différentes méthodes, propose de le nommer en honneur à Avogadro. Depuis 1971, date à laquelle la mole devient l'unité de base des quantités de matière, le nombre d’Avogadro se dote d’une unité, la mol-1 et devient alors une constante.
Importance de la constante d'Avogadro dans la science d'aujourd'hui
Étudier le comportement de chaque atome, molécule ou ion dans un milieu est en pratique impossible. Il est donc nécessaire de généraliser l’étude d’un système à un grand nombre de particules. La grandeur permettant de faire ainsi le lien entre l’échelle microscopique (c’est-à-dire l’échelle qui considère les propriétés individuelles de chaque particule) et l’échelle macroscopique (c’est-à-dire l’échelle qui étudie globalement un grand nombre de particules) est justement la constante d’Avogadro.
En effet on peut facilement faire le lien entre la quantité de matière en mol n, grandeur macroscopique, et le nombre d’atomes N, grandeur microscopique, grâce à la relation suivante : n = N/NA avec NA la constante d’Avogadro.
Avogadro est donc en quelque sorte à la base de la physique statistique, appelée aussi thermodynamique statistique, qui, à partir des propriétés microscopiques, décrit les propriétés et les évolutions des systèmes physico-chimiques comportant un grand nombre de particules.
La constante d’Avogadro est aujourd'hui l'une des plus importantes constantes de la chimie. Elle apparaît dans de nombreuses lois utilisées aujourd’hui, on peut citer notamment la loi des gaz parfaits :
PV = nRT
où R, constante universelle des gaz parfait est le produit du nombre d’Avogadro et de la constante de Boltzmann kB :
R = NAkB
L’hypothèse émise par Avogadro apparaît directement dans la loi des gaz parfait. A pression et température identiques, un même volume de gaz contient le même nombre de mole donc le même nombre d’entité chimique !
Conclusion
Bien qu'à quelques exceptions près, ses principaux travaux sont tombés dans l'oubli, Avogadro reste connu plus d'un siècle après la publication de son hypothèse. Celle-ci a en effet contribué à de grandes avancées dans la compréhension de la chimie, en particulier :
- distinguer atomes et molécules ;
- élaborer un système de poids atomiques ,
- définir un symbolisme chimique des éléments.
Bibliographie et Ressources en ligne
- Amedeo Avogadro, a Scientific Biography, Mario Morselli (Chemists and Chemistry).
- Histoire de la constante d'Avogadro, Jean-Paul Mathieu (Cahiers d'Histoire et de Philosophie des Sciences).
- Des chimistes de A à Z, Eric Brown (Ellipses).
- A chemical history tour, Arthur Greenberg.
- Penser la matière, une histoire des chimistes et de la chimie, Jean Baudet.
- Histoire de la chimie, Bernadette Bensaude-Vincent.
- L’atome, chimère ou réalité ?, Claude Lécaille.
- Histoire de la chimie, B. Wojtkowiak.
- Essai d'une manière de déterminer les masses relatives des molécules élémentaires des corps et les proportions selon lesquelles elles entrent dans les combinaisons, Amedeo Avogadro