L'ionisation par impact électronique (I.E.) est une technique choisie pour créer des ions à partir de molécules volatiles en phase gazeuse. L'ionisation chimique (I.C.) est une réaction ion-molécule entre une molécule M et un ion réactant NH4+ ; il en résultera soit un transfert de proton et l'on obtiendra (M + H)+, soit la réaction d'adduit et l'on obtiendra (M + NH4)+ . Dans ces deux méthodes, l'échantillon à analyser est en phase gazeuse. Le processus de volatilisation met l'échantillon en phase gazeuse sans décomposition.
Introduction
L'ionisation par impact électronique (I.E.) est une technique choisie pour créer des ions à partir de molécules volatiles en phase gazeuse. L'ionisation chimique (I.C.) est une réaction ion-molécule entre une molécule M et un ion réactant NH4+ ; il en résultera soit un transfert de proton et l'on obtiendra (M + H)+, soit la réaction d'adduit et l'on obtiendra (M + NH4)+ . Dans ces deux méthodes, l'échantillon à analyser est en phase gazeuse. Le processus de volatilisation met l'échantillon en phase gazeuse sans décomposition.
Par contre, pour des échantillons non volatils et thermolabiles de masses moléculaires élevées, d'autres techniques d'ionisation qui sont des techniques de désorption-ionisation ou de désolvatation-ionisation ont été mises au point depuis 20 ans. On dira d'un composé solide qu'il est « désorbé » tandis qu'un composé en solution est « désolvaté ». Il s'agit de la PD-MS (désorption plasma), du MALDI (désorption-ionisation laser assistée par matrice), du LSIMS (spectrométrie de masse à ions secondaires avec cible liquide), du FAB (bombardement par atomes rapides), de l'APCI (ionisation chimique à pression atmosphérique) et de l'ESI (électrospray) qui sont des techniques de désolvatation-ionisation à pression atmosphérique.
Cette technique utilise les produits de fission de l'isotope radioactif 252 du Californium 252Cf pour bombarder une cible sur laquelle est déposée l'échantillon à analyser. Le californium se désintègre en émettant des ions multichargés de très grande énergie cinétique (environ 100 MeV). Ce principe est illustré sur la figure ci-dessous :
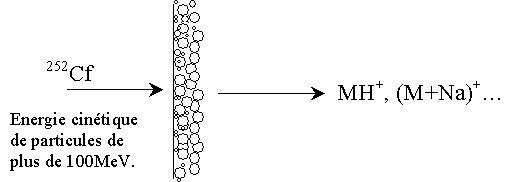 |
Le Maldi est une méthode d'ionisation introduite en 1988 par Karas et Hillenkamp d'une part et par Tanaka d'autre part permettant d'analyser des molécules de hautes masses moléculaires, supérieures à 300 kDa. Elle s'utilise pour analyser les peptides et les protéines.
Actuellement, le mécanisme exact du Maldi n'est pas encore décrit avec précision. Un échantillon solide, dispersé dans une grande quantité de matrice (cristalline) est irradié par des photons émis par un laser dont la longueur d'onde est située dans la bande d'absorption de la matrice. L'irradiation de la matrice et de l'échantillon va provoquer la création d'une grande quantité d'énergie dans la phase condensée, par excitation électronique des molécules de la matière. Des ions, formés par transfert de protons ou d'électrons entre la matière photoexcitée et l'échantillon analysé désorbent. Ce principe est illustré par la figure ci-dessous :
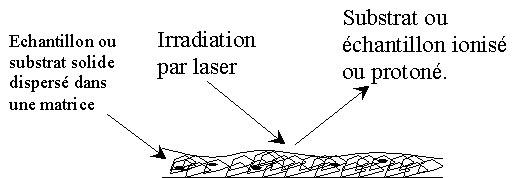 |
En général, la source MALDI est utilisée avec un analyseur à temps de vol (TOF). On obtient des ions en phase gazeuse en irradiant le composé à analyser en utilisant un laser à impulsion courte (1-10 ns). L'échantillon est incorporé uniformément dans une matrice cristalline solide possédant une grande absorbance. Le rapport matrice-échantillon est un paramètre important pour réussir les analyses en MALDI, les rapports peuvent varier de 1000/1 à 5000/1. Les matrices sont des chromophores à faible enthalpie de sublimation, les plus utilisées sont les dérivés des acides cinnamiques et benzoïques : l'acide sinapinique, l'acide ferrulique, l'acide cafféique et l'acide gentisique.
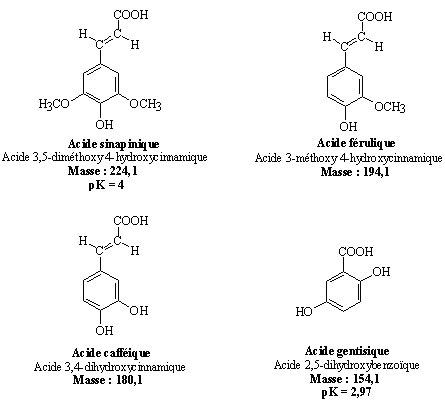 |
Le rôle de la matrice est le suivant :
-
Favoriser la séparation des molécules en réduisant les forces intermoléculaires.
-
Absorber l'énergie du faisceau laser.
-
Favoriser l'ionisation en induisant des transferts de protons.
Le choix de la matrice est donc important, il permet effectivement de jouer sur la production d'ions multichargés. D'autre part, certaines matrices comme l'acide sinapinique ne permettent pas de détecter des peptides de masses moléculaires voisines de 1000, en raison du bruit de fond dû à la matrice dans cette gamme de masse. Il faut alors changer de matrice pour voir apparaître de petits peptides.
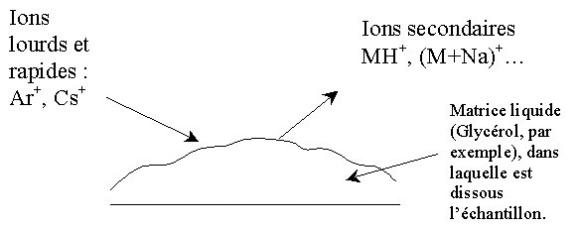
Dans cette technique, l'échantillon est déposé en mélange avec une matrice liquide ( le plus souvent du glycérol, mais parfois des mélanges tels que le Magic Bullet, qui est un mélange 4/1 de 1,4-dithio-L-threitol et de 1,4-dithioerythritol) sur le méplat métallique d'une canne d'introduction. Des ions lourds tels que l'argon ou le xénon sont produits par une cathode froide placée à quelques centimètres de l'échantillon à analyser. Les ions lourds produits lors de la décharge sont accélérés à haute énergie par un potentiel de quelques kV maintenu entre ces deux électrodes. A la sortie très étroite du canon, il se produit un échange de charges donnant des atomes lourds à partir de ces ions lourds. C'est le bombardement par ces atomes lourds, ayant une énergie cinétique de l'ordre du keV, qui produit des ions quasi moléculaires tels que (M+H)+, (M+Na)+, (M+K)+ en mode positif et (M-H)- en mode négatif. Grâce à cette technique, on peut analyser des molécules polaires de haut poids moléculaire (peptides, protéines, nucléosides, saccharides, antibiotiques, sels d'acides minéraux) et faire des déterminations de structure ; mais malheureusement on obtient souvent un bruit de fond important dû à la matrice liquide.
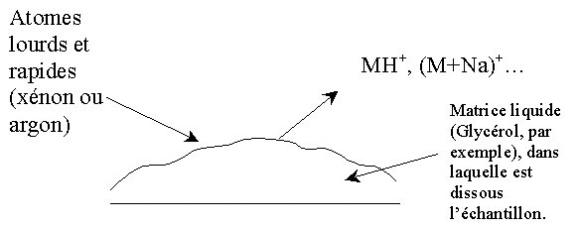 |
C'est une technique de désorption-ionisation par des ions rapides (Cs+ ou Ar+, ayant une énergie cinétique de l'ordre de 30 keV) en présence d'une matrice liquide tel que le glycérol ou l'alcool métanitrobenzylique.
 |
- F. Hillenkamps, M. Karas, R.C. Beavis, B.T Chait, Anal. Chem., 63, 1193A, 1991
- K.L. Bush, J. of Mass Spectrometry, 30, 233, 1995
- Cours de Spectrométrie de Masse. Garchy. 1994.
- Spectrométrie de Masse : Principes et Applications. Technique et Documentation Lavoisier. 1996, 2ème édition.
- M. Barber, R.S. Bordoli, G.J. Elliott, R.D. Sedgwick, A.N. Tyler, Anal. Chem., 54, 645A, 1982
- Continuous-Flow Fast Atom Bombardment Mass Spectrometry. Wiley. 1990.






