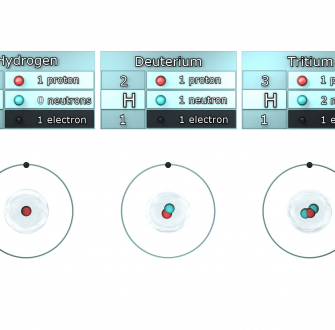
L'objectif de cette expérience est de montrer l'influence de la substitution isotopique de l'hydrogène par le deutérium dans l'eau. On constate que la densité de l'eau lourde solide est plus élevée que celle de l'eau. Cette manipulation simple permet de rappeler plusieurs aspects importants de la structure usuelle de l'eau solide/liquide.
Introduction
L'objectif de cette expérience est de montrer l'influence de la substitution isotopique de l'hydrogène par le deutérium dans l'eau. On constate que la densité de l'eau lourde solide est plus élevée que celle de l'eau. Cette manipulation simple permet de rappeler plusieurs aspects importants de la structure usuelle de l'eau solide/liquide.
Expérience
Protocole expérimental
On plonge des glaçons d'eau puis d'eau lourde dans un bécher rempli d'eau.
Réalisation de l'expérience
Voir ci-dessous la séquence expérimentale provenant du site Chemical Education administré par l'équipe du Dr. George Bodner.
Observations et interprétations
On observe que les glaçons d'eau solide flottent tandis que ceux d'eau lourde restent entre deux eaux. Cela permet d'affirmer que les densités suivent l'ordre croissant suivant :
d(eau solide) < d(eau liquide) < d(eau lourde)
Connaissant la masse molaire de l'eau (18,0 g/mol) et celle de l'eau lourde (20,0 g/mol) ainsi que les paramètres de la maille hexagonale dans laquelle cristallise l'eau (a = 452 pm et c = 739 pm) à raison de quatre molécules par maille, on peut calculer les densités des solides dans l'hypothèse de paramètres de maille identiques pour les deux. On trouve : d(eau solide) = 0,915 et d(eau lourde) = 1,02. Cela permet d'interpréter les observations précédentes.
Bibliographie pour approfondir
Tables de données physiques : « Handbook »