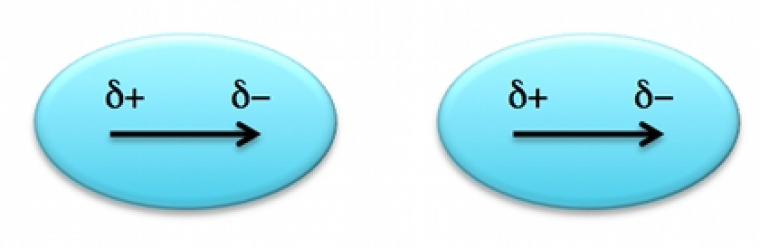Les forces de van der Waals correspondent à une interaction électrique d‘intensité faible ayant lieu à courtes distances entre atomes et/ou molécules. Ces forces ont été nommées en l'honneur du physicien néerlandais Johannes Diderik van der Waals (1837-1923), prix Nobel de physique en 1910, qui fut le premier à introduire leurs effets dans les équations d'état des gaz en 1873 permettant d’aller au delà de la description simpliste du gaz parfait.
On présentera donc d’abord les différentes composantes des forces de Van der Waals, puis comment ces dernières s’expriment sur l’exemple surprenant du gecko (Figure 1) !
Forces de Van der Waals
Les forces de Van der Waals ont différentes origines et peuvent être décomposées en trois termes différents qui correspondent à des interactions électriques différentes entre atomes et/ou molécules. La caractéristique commune de ces trois termes est que leur énergie est proportionnelle à -1/r6.
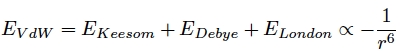
Par conséquent, on en déduit que les forces de Van der Waals sont proportionnelles à 1/r7 ce qui montre bien qu’elles correspondent à des interactions à courtes distances.
Les forces de Keesom
Le premier type d’interactions de Van der Waals que l’on considére est la force dite de Keesom. Elle résulte de l’interaction entre dipôles électriques permanents et n’a donc lieu qu’entre molécules polaires (Figure 2).
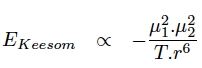
L’expression de l’énergie de Keesom nous montre que cette dernière dépend bien de l’interaction entre les dipôles électriques permanents mais également de la température. La force de Keesom est d’autant plus forte, que les dipôles permanents sont grands et alignés, et, que la température est basse. Cette interaction est assez faible car elle dépend de l’orientation des dipôles et possède une énergie assez basse allant de 0,5 à 3 kJ/mol (sachant que l'énergie d’une liaison chimique est de l'ordre de plus de 100 kJ/mol).
Les forces de Debye
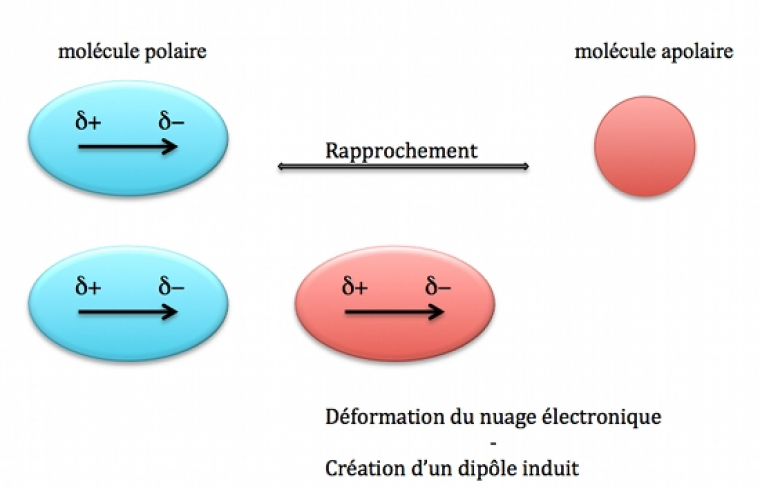
La seconde contribution aux forces de Van der Waals est la force de Debye qui provient de l’interaction entre un dipôle permanent et un dipôle induit. Cette interaction peut avoir lieu entre une molécule polaire et une autre qui peut être polaire ou apolaire. Tout atome ou molécule est polarisable c’est-à-dire que son nuage électronique se déforme suite à la présence d’un champ électrique. Ce champ électrique est créé par le dipôle permanent de la molécule polaire qui induit un dipôle au niveau de l'autre molécule. Il est important de rappeler que la polarisabilité d’un atome ou d’un molécule augmente avec la taille.
Si, par simplification, on s’intéresse à l’interaction d’une molécule polaire avec une molécule apolaire (les conclusions seront les même avec un molécule polaire), on peut schématiser Figure 3 l'interaction de Debye par :
Ce schéma permet de montrer comment on obtient un moment dipolaire induit sur une molécule apolaire par rapprochement d’une molécule polaire.
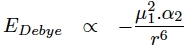
L’énergie de cette interaction est directement proportionnelle au dipôle permanent de la molécule polaire et à la polarisabilité (α) de la molécule apolaire. Ainsi cette énergie sera d’autant plus grande (en valeur absolue) que le dipôle permanent sera grand et que la polarisabilité aussi (donc molécule apolaire grande). L’énergie de cette interaction est du même ordre de grandeur que celle de Keesom (de 0,5 à 3 kJ/mol).
Les forces de London
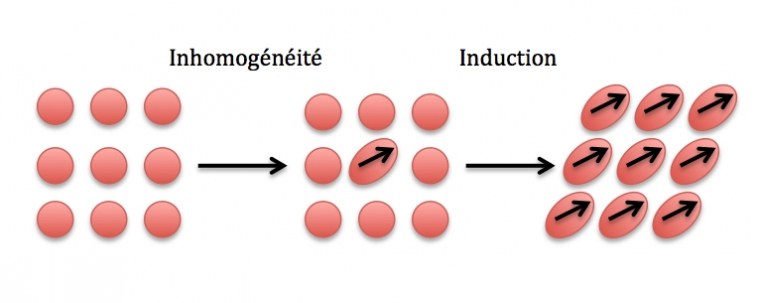
La dernière contribution à prendre en compte dans les forces de Van der Waals est la force de London qui traduit l’interaction entre deux dipôles induits. Une légère répartition inhomogène du nuage électronique dans une molécule va créer un dipôle induit qui va lui même entrainer la création d’un dipôle induit sur la molécule voisine. Cette interaction peut avoir lieu a priori entre une molécule polaire/apolaire et une molécule polaire/apolaire mais elle est prépondérante lorsqu’elle a lieu entre molécules apolaires.
Le schéma suivant Figure 4 traduit comment les dipôles induits se créent au sein de molécules apolaires.
Comme on peut le voir sur l’expression suivante, l’énergie due à l’interaction de London est proportionnelle aux polarisabilités des deux molécules interagissant.
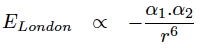
Cette énergie est prépondérante entre deux molécules apolaires et va de 0,5 à 30 kJ/mol (entre deux molécules apolaires très polarisables).
Le Gecko
Anatomie du gecko
Le gecko est un petit lézard qui fascine depuis très longtemps la communauté scientifique. En effet, le gecko est capable de grimper sur des murs et des plafonds de natures très différents tout en se déplaçant à des vitesses atteignant plusieurs m.s-1. Ce défi du gecko aux lois de la pesanteur est une question dont la réponse n’a été trouvé qu’il y a quelques années par les scientifiques.
La spécificité du gecko qui lui permet de se déplacer sur des surfaces verticales sont ses pattes et plus particulièrement ses orteils. Capable de coller et décoller ses pattes en quelques millisecondes, le gecko parcourt des distances sur des surfaces verticales en des temps records !
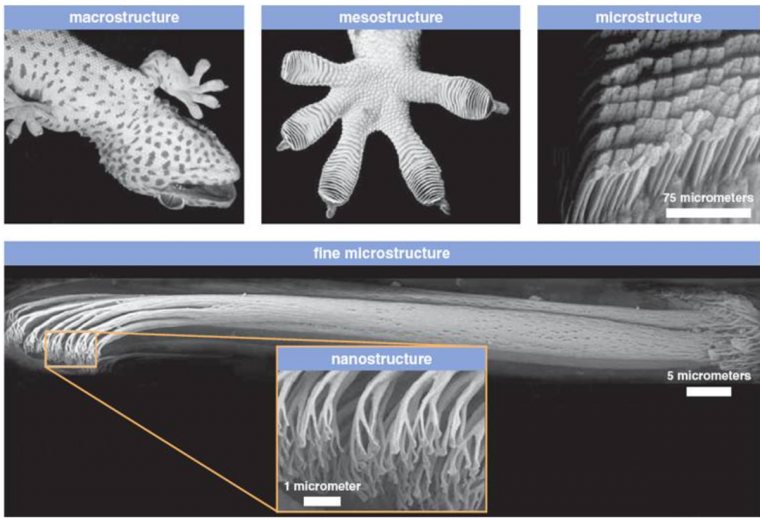
Comme on peut le voir sur les images micrométrique et nanométrique Figure 5, les orteils « fractals » du gecko sont recouverts de sétules ou setae (forme de cheveux) qui se ramifient elles-même en spatules ou spatulae. La taille des sétules et des spatules sont minuscules. Une sétule mesure 110 micromètres de long pour 4.2 micromètres de large. Chaque sétule contient plusieurs centaines voire milliers de spatules mesurant 200 nanomètres de long et de large.
La surface d’une patte (orteils + voute plantaire) de gecko est d’environ 220 mm2 (2,20 cm2 soit moins qu’une pièce de 2 euros). On dénombre 14 400 sétules par mm2, ce qui fait environ 6,5 millions de sétules pour l’ensemble du gecko.
Cette anatomie particulière permet à un gecko de 50 grammes de pouvoir supporter 20 N (soit une masse de plus de 2 kg) c'est à dire plus de 40 fois son poids ! A titre de comparaison c’est comme si un homme de 80 kg supportait une masse de 3,2 tonnes.
Lien avec les forces de Van der Waals
L’anatomie particulière du gecko a amené les scientifiques à émettre deux hypothèses possibles pour expliquer le mécanisme d’adhésion du gecko.
Le premier mécanisme est une adhésion par capillarité qui est un phénomène qui se produit aux interfaces entre deux liquides non miscibles ou encore entre un liquide et une surface. La capillarité provient des forces de tensions superficielles entre les différentes phases. On ne détaillera pas plus le phénomène de capillarité ici mais les forces capillaires sont très sensibles aux interactions entre les molécules (d’eau par exemple) « collées » sur les pattes du gecko et celles de la surface à laquelle ce dernier se « colle » et donc il y a une différence d’adhésion selon que la surface soit hydrophobe (repousse les molécules d’eau) ou hydrophile (attire les molécules d’eau).
Le second mécanisme envisagé est une adhésion par forces de Van der Waals qui ont été décrites précédemment. Contrairement au mécanisme d’adhésion par capillarité celui par forces de Van der Waals n’entraine pas de différence d’adhésion selon que la surface soit hydrophobe ou hydrophile. Les expériences menées par l’équipe de Kellar Autumn (Lewis & Clark College - Portland -Oregon) ont permis de montrer que le gecko est insensible à la nature à laquelle il se colle.
Par conséquent, le gecko adhère aux murs par des forces de Van der Waals. Les spatules permettent aux pattes du gecko d’aller « coller » à une surface par des forces de Van der Waals car elles approchent la surface à une échelle nanométrique, condition nécessaire pour les forces de Van der Waals significatives qu’à courtes distances.
L’équipe de Kellar Autumn a également démontré qu’une sétule pouvait supporter au maximum une force de 200 μN tout en restant collée à une surface verticale. Ainsi théoriquement, si toutes les sétules avaient une force d’adhésion de 200 μN, la force d’adhésion totale (6,5 millions de sétules) du gecko serait de 1300 N. Le gecko serait donc capable de supporter une masse d’environ 130 kg sur son dos tout en restant coller au plafond.
Comme dit précédemment ceci n’est évidemment pas le cas car le gecko a une force d’adhésion réelle de 20 N. Par conséquent, seulement 3 % des sétules sont nécessaires pour que le gecko adhère à la surface verticale avec une telle force d'adhésion. Dans la pratique, plus impressionnant encore, seuls 0,04 % des sétules « collées » sont nécessaires pour que le gecko supporte son poids sur une surface verticale.
Calcul du nombre de spatules utiles
On sait maintenant que le gecko adhère aux murs par des forces de Van der Waals. Or, l’expression des forces de Van der Waals entre deux surfaces planes est la suivante :
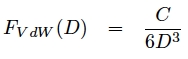
avec D la distance entre les deux plans et C une constante caractéristique non détaillée ici. Cette expression s’obtient à partir des forces de Van der Waals entre deux molécules (donc Debye+London+Keesom) que l’on intègre sur les deux plans et par conséquent on passe d’une force en 1/r7 à 1/r3. Si l’on considère notre gecko immobile et donc à l’équilibre, on obtient en appliquant la première loi de Newton :
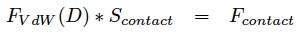
Les valeurs typiques de la force de contact d’une sétule sur une surface verticale, de C et D sont les suivantes :
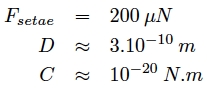
D correspond à la distance entre deux molécules proches ce qui est permis grâce à la structure speciale des orteils du gecko.
Ainsi la surface « effective » de la sétule qui permet d’obtenir la force d’adhésion maximale est :
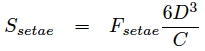
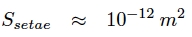
Si l’on considère maintenant les spatules comme des petites branches avec un petit disque au bout qui vient adhérer à la surface, on a :

Ainsi seulement 8 spatules suffisent sur l’ensemble de la sétule afin d'assurer une force d’adhésion de 200 μN d'une sétule.
Pour résumer, 0,04 % des sétules (ou setae Figure 6) sont utiles et au sein des sétules, seulement un pourcentage faible des spatules (ou spatulae) est nécessaire pour l'adhérer à la surface. Mais alors pourquoi le gecko a-t-il tant de sétules et de spatules ? Tout simplement parce que la nature n’est pas aussi idéale que la situation qui vient d’être présentée ici. En effet, les surfaces sur lesquelles le gecko essaie d’adhérer ne sont pas planes, des poussières collées sur les pattes du gecko viennent perturber son adhésion aux murs. De plus, le gecko doit pouvoir résister aux tempêtes, à ses prédateurs ou même à une chute.
Il reste un dernier mystère à éclaircir. Comment le gecko fait-il pour courir vite sur les parois verticales ? En effet, on a montré que ce dernier pouvait adhérer facilement aux murs mais pour vite se déplacer cela veut dire qu’il peut également facilement se détacher. Kellar Autumn et son équipe ont démontré que la force d’adhésion des sétules aux parois verticales dépend en fait fortement de l’orientation de la cette sétule. Au-delà d’une inclinaison de 30° la force d’adhésion devient faible et la sétules peut facilement se détacher. Le gecko n’a donc qu’à orienter sa patte correctement pour adhérer et se détacher des surfaces.
Applications Biomimétiques
Le mécanisme d’adhésion et de décollage du gecko a inspiré les scientifiques pour fabriquer un super adhésif sur le même principe. La nature est ici une source d’inspiration pour créer de nouvelles technologies, et les pattes du gecko n’échappent pas à la règle.
Plusieurs laboratoires à travers le monde ont reproduit la structure nanométrique des spatules du gecko pour créer un adhésif fonctionnant à l’aide des forces de Van der Waals. Cet adhésif un peu spécial fonctionne très simplement. En effet, on le colle sur une surface lisse par simple pression (on peut ensuite tirer dessus très fort et rien ne bouge). Pour le décoller, il suffit d’avoir un mouvement de pelage exactement comme pour le gecko et l’adhésif se détache.
Le temps où l’homme pourra imiter Spiderman n’est peut être pas si éloigné de notre époque.
Bibliographie et Ressources en Ligne
[1] J.N.Israelachvili, Intermolecular and surface forces, Academic Press, 2e édition, Londres, 1997.
[2] Le collage : un moyen ancestral, moderne et durable d'assemblage
[3] Le Kellar Autumn Lab au Lewis & Clark College.