Tomas Lindhal, Paul Modrich et Aziz Sancar ont obtenu en 2015 le prix Nobel de Chimie pour leurs travaux, réalisés de manière indépendante, concernant les mécanismes de réparation de l’ADN au sein des cellules.
L’instabilité de l’ADN
Jusqu’à la fin des années 60, la communauté scientifique pensait que la molécule d’ADN était extrêmement stable, en l’absence d’agression due à des radiations ou des composés mutagènes.
Tomas Lindhal, de nationalité suédoise, réalise à cette époque des expériences sur l’ARN lors de son post-doc à l’Université de Princeton (Etats-Unis) : il observe que l’ARN se dégrade rapidement sous l’effet de la chaleur. Il était bien connu alors que l’ARN était bien plus sensible que l’ADN mais vu la relative instabilité de l’ARN, pouvait-on continuer à croire que l’ADN restait stable tout au long de la vie ? Quelques années plus tard, au début des années 70, de retour au Karolinska Institutet de Stockholm, il met en évidence le fait que l’ADN subit une lente dégradation au cours du temps, via des réactions de désamination, d’oxydation ou de méthylation ayant lieu in vivo.
L’inhérente instabilité de l’ADN constitue à la fois une opportunité et une menace : les modifications qu’il subit permettent d’assurer l’évolution de l’espèce mais elles peuvent induire un changement de l’expression des protéines codées par les gènes et conduire à des maladies graves. Leur nombre doit donc rester modéré.
Tomas Lindhal estime lors de ses travaux que le génome peut subir des milliers de modifications chaque jour, incompatibles avec la vie sur Terre. Il en conclut qu’il existe forcément des mécanismes de réparation de l’ADN au sein des cellules et ouvre alors un tout nouveau champ de recherches.
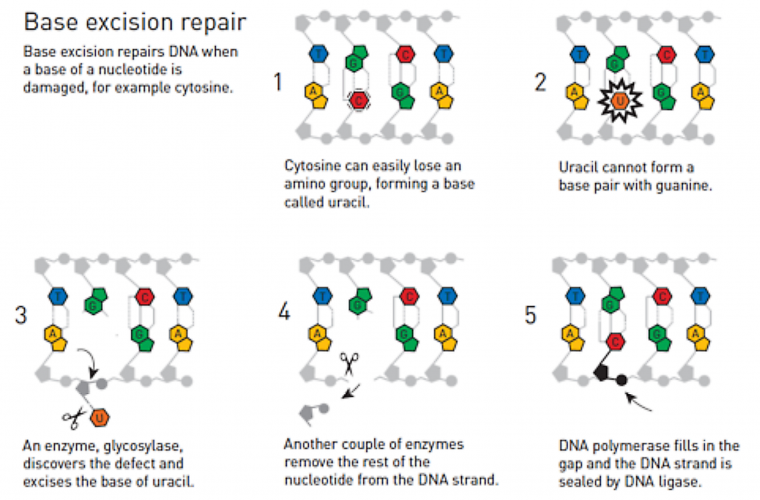
La réparation par excision de bases (Base Excision Repair)
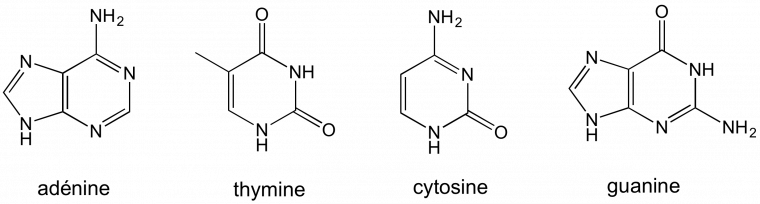
L’ADN est constitué de deux brins constitués eux-mêmes de nucléotides utilisant 4 bases : adénine, thymine, cytosine et guanine (Figure 1).
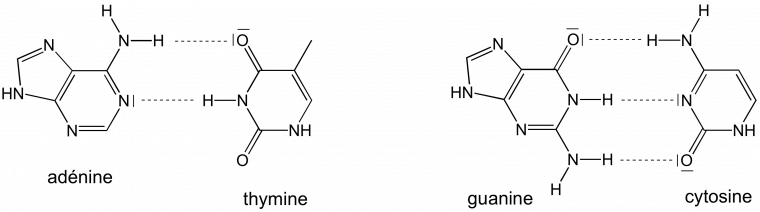
Grâce à des liaisons hydrogène, elles s’associent en paires : l’adénine avec la thymine et la cytosine avec la guanine (Figure 2).
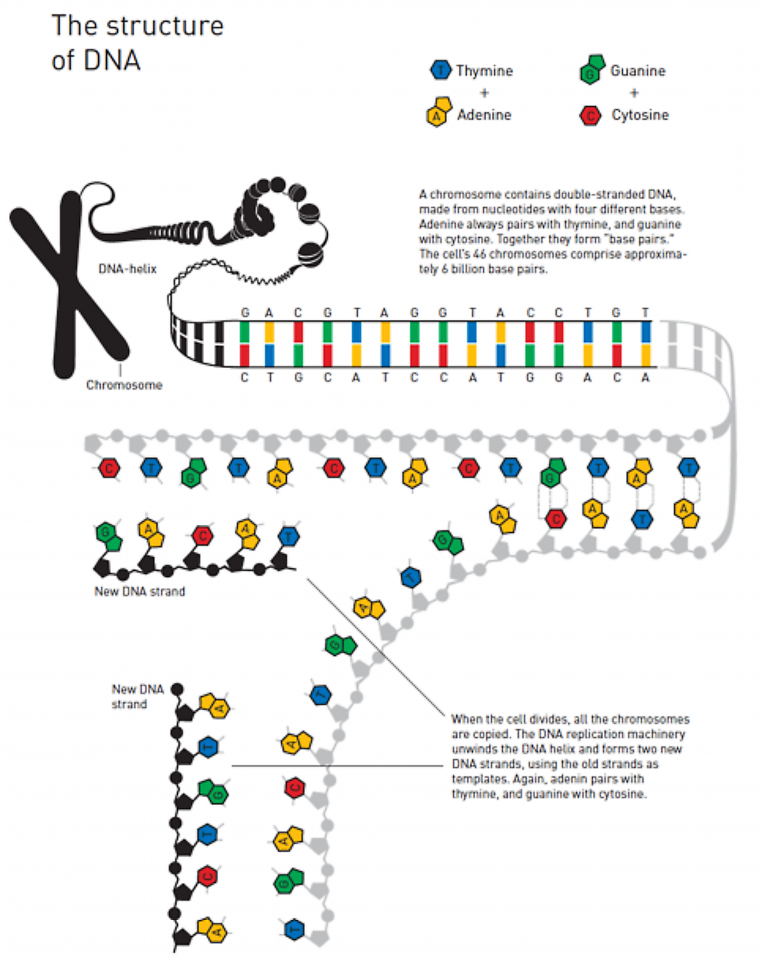
L'ADN peut être représenté schématiquement de cette façon Figure 3 :
Lors de la division cellulaire, l'ADN est répliqué: les deux brins de dissocient et sont chacun utilisés comme modèles pour la création des nouveaux brins.
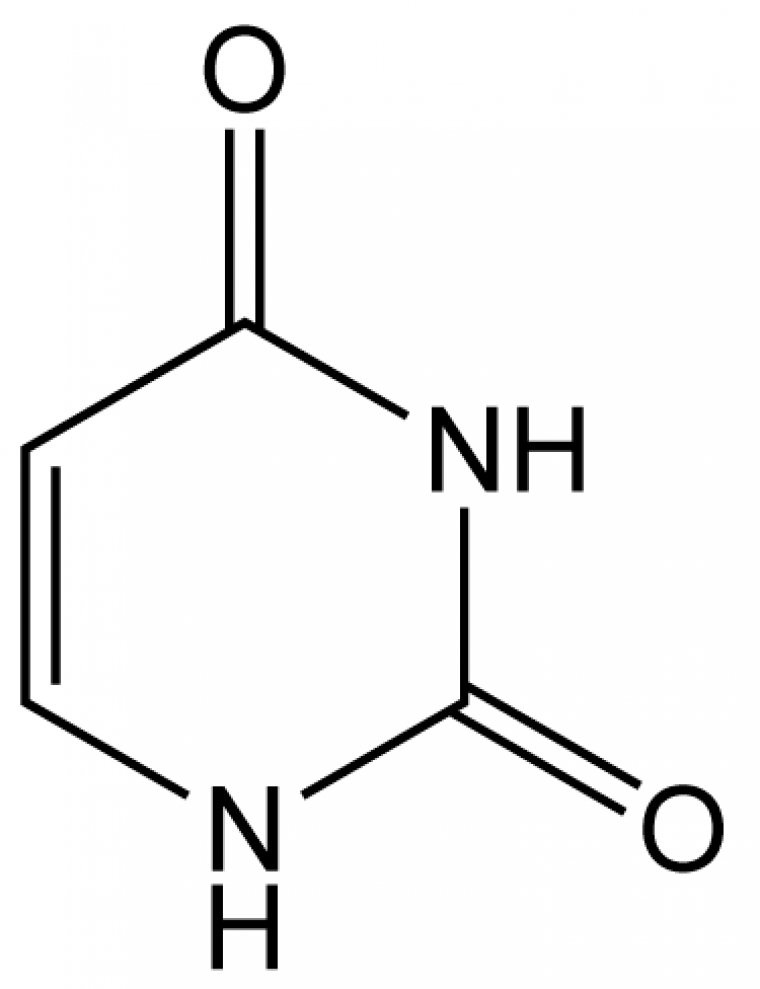
Tomas Lindhal découvre que la cytosine subit spontanément une désamination dans les conditions physiologiques, conduisant à la formation d’uracile.
L’uracile (Figure 4) formé ne peut plus s’associer avec la guanine mais a au contraire tendance à s’associer à l’adénine. Si le dommage n’est pas réparé, une mutation aura lieu lors de la prochaine réplication du brin d’ADN.
Tomas Lindhal est persuadé qu’il existe un mécanisme (Figure 5) permettant de réparer ce défaut : il travaille d’abord sur l’ADN de bactéries, puis sur l’ADN humain et finit par identifier le processus de réparation de l’ADN par excision de base (en anglais, Base Excision Repair). Il met notamment en jeu l’action de plusieurs enzymes, dont la glycosylase, qui découpent le brin d’ADN au niveau du défaut (la molécule d’uracile) et celle d’autres enzymes, l’ADN-polymérase et l’ADN-ligase, qui reconstruisent le brin d’ADN.
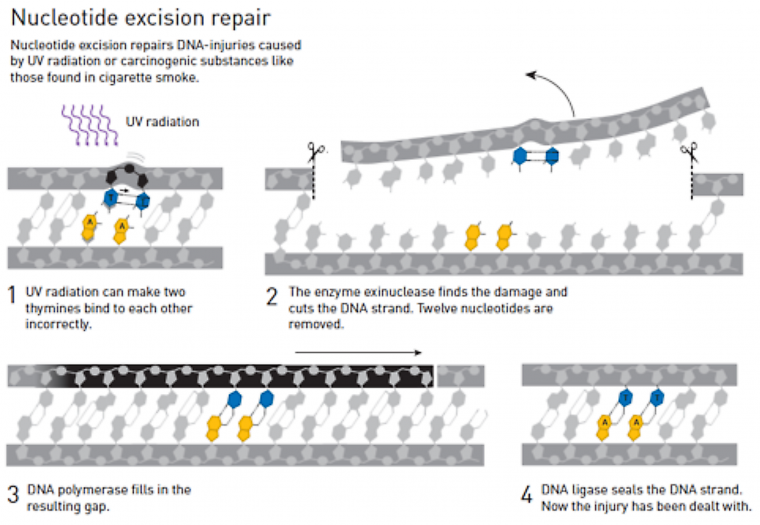
La réparation par excision de nucléotides
Aziz SANCAR s’est, lui, intéressé aux mécanismes de réparation des dommages causés à l’ADN par des rayons UV ou des substances cancerogènes.
Une des modifications dues aux rayonnements UV est la formation de paires de thymine au sein d’un même brin d’ADN, ce qui interfère avec l’association normale adénine-thymine et cytosine-guanine, et déforme ainsi la structure hélicoïdale de l’ADN.
Grâce à des expériences in vitro sur l’ADN de bactéries, Aziz SANCAR met en évidence l’existence d’enzymes qui découpent la partie endommagée du brin d’ADN en faisant une excision de part et d’autre. Il s’agit du processus de réparation par excision de nucléotides, ou encore Nucleotide Excision Repair en anglais (Figure 6).
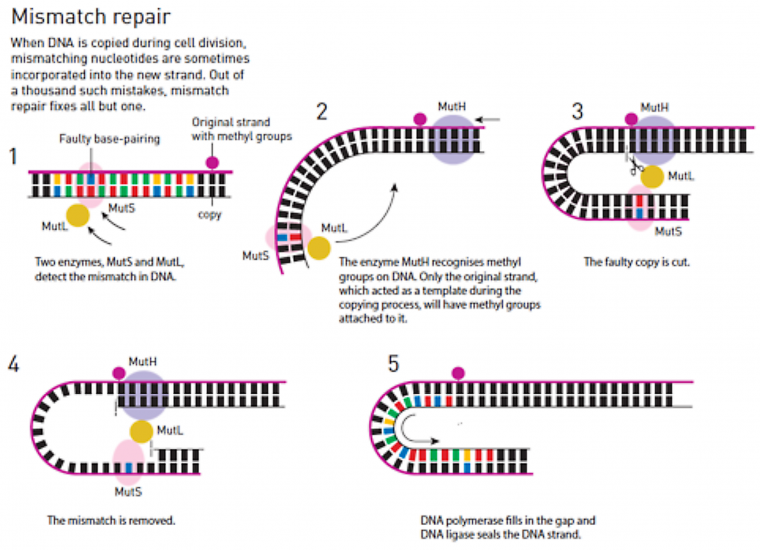
La réparation des mauvaises associations
Lors de la réplication de l’ADN, il arrive que des bases soient mal associées : par exemple une adénine est associée à une cytosine au lieu d’une thymine. Paul MODRICH s’est intéressé à la réparation de ces mauvaises associations Figure 7 (en anglais mismatch repair). Des études mises en œuvre sur l’ADN de bactéries mettent en évidence une enzyme appelée Deoxyadenosine methylase (en abrégé Dam méthylase), dont le rôle est de fixer des groupes méthyles sur les brins d’ADN, groupes méthyles qui servent alors de repères. Lors de la réplication de l’ADN, le brin méthylé sert de modèle au brin en cours de construction. Si une mauvaise association a lieu lors de cette réplication, un ensemble d’enzymes est capable de distinguer, grâce à ce groupe méthyle, le brin originel du nouveau brin défectueux, qui n’a pas encore été méthylé. Cet ensemble d’enzymes réalise ensuite la découpe de la partie défectueuse du nouveau brin ; deux autres enzymes, l’ADN-polymérase et l’ADN-ligase reconstruisent ensuite la partie manquante.
Les processus de réparation des mauvaises associations dans l’ADN humain fonctionne de façon similaire, mais on ne connaît pas, à l’heure actuelle, le mécanisme d’identification du brin originel.
Et si les systèmes de réparation de l’ADN fonctionnent mal ?
Il existe d’autres mécanismes que les trois présentés précédemment qui maintiennent l’ADN en bon état. Des défauts dans ces systèmes de réparation entraînent rapidement une modification de l’information génétique et augmentent le risque de cancers. Par exemple, un défaut dans le mécanisme de réparation des mauvaises associations de bases augmente le risque de développer un cancer du colon.
Dans bon nombre de cancers, un ou plusieurs des systèmes de réparation ne fonctionnent pas ou fonctionnent mal, ce qui rend l’ADN des cellules cancéreuses particulièrement instable. Par suite, ces cellules mutent et peuvent devenir résistantes à la chimiothérapie. Paradoxalement, ces cellules malades, qui prolifèrent suite à un manquement dans un système de réparation de l’ADN, ont besoin de tels systèmes en état de marche : sans eux, leur ADN serait trop endommagé et ces cellules mourraient. Certains chercheurs travaillent actuellement sur ce paradoxe pour mettre au point de nouveaux médicaments contre le cancer : ils cherchent à inhiber complètement certains systèmes de réparation de l’ADN pour limiter la croissance des cellules cancéreuses. Un exemple de médicament de ce type est l’oliparib.
En conclusion, le travail de recherche fondamentale mise en œuvre par les trois lauréats du prix Nobel de Chimie 2015 a non seulement permis d’approfondir nos connaissances sur la façon dont nous fonctionnons mais aussi conduit au développement de traitements. Paul MODRICH dit très bien lui-même « C’est pourquoi la recherche fondée sur la curiosité est si importante : vous ne savez jamais ou cela va vous mener… Un peu de chance aide aussi. »
Les Lauréats
Tomas LINDHAL: de nationalité suédoise, né en 1938 à Stockholm, Suède. Professeur émérite au Francis Crick Institute et directeur émérite du Cancer Research UK au Clare Hall Laboratory, Hertfordshire, UK.
Paul MODRICH: de nationalité américaine, né en 1946. Chercheur à Howard Hughes Medical Institute et Professeur de biochimie à Duke University School of Medicine, Durham, NC, USA.
Aziz SANCAR: de nationalité turco-américaine, né en 1946 à Savur, Turquie. Professeur de biochimie et biophysique à University of North Carolina School of Medicine, Chapel Hill, NC, USA.
Pour en savoir plus, consulter: