Cette ressource donne quelques définitions au sujet des polymères (notamment celles de monomère, homopolymère, copolymère) et traite des interactions physico-chimiques entre unités monomère, interactions qui gouvernent directement les différents états physiques et les propriétés des polymères.
Définitions préalables
Les polymères sont principalement utilisés pour l’élaboration de matériaux polymères, c’est-à-dire toute matière utile d’origine naturelle ou synthétique, mise en œuvre par l’homme et transformée en vue d’élaborer un objet (on parle couramment d’objet en matière plastique ou plus simplement d’objet en plastique) offrant des propriétés d’usage. Le polymère de base est très souvent mélangé avec des additifs, des charges qui modifient les caractéristiques physico-chimiques de la matière plastique et donc ses propriétés.
Les propriétés thermomécaniques spécifiques des matériaux polymères ainsi que leur aptitude à être mis en forme les différencient des autres classes que sont les matériaux inorganiques (métaux, verres, céramiques). Les composites permettent d’allier les propriétés des matériaux polymères et inorganiques.
Contrairement aux « petites » molécules organiques constituées de quelques dizaines d’atomes, et donc de faible masse molaire, un polymère est un assemblage de macromolécules comprenant des milliers d’atomes et dont la masse molaire peut dépasser 106 g.mol-1.
Les polymères peuvent être issus du milieu naturel (végétal et animal) ou obtenu par polymérisation de monomères. Polymères naturels et synthétiques peuvent aussi subir des réactions chimiques ultérieures pour répondre à un cahier des charges particulier. Plus spécifiquement, un polymère artificiel est un polymère naturel modifié chimiquement.
Unités monomère, homo- et copolymères
Malgré leur masse molaire élevée, les macromolécules peuvent être simplement décrites en termes d’unités monomère issues directement des monomères mis en œuvre lors de la synthèse des polymères. Celles-ci constituent donc les éléments de base de la construction des macromolécules et permettent de comprendre un certain nombre de propriétés fondamentales des polymères.
Les différents états physiques et les propriétés des polymères qui en découlent sont directement fonction des interactions physico-chimiques entre ces unités monomère et dépendent donc étroitement de leur nature chimique et de leur nombre dans les macromolécules. Ce point fera l’objet de la ressource n° 3.
On peut utiliser un ou plusieurs monomères pour synthétiser les polymères. On parlera d’homopolymère lorsqu’un seul monomère sera impliqué dans la synthèse, par exemple le polyéthylène, le polystyrène, le poly(chlorure de vinyle), le poly(acétate de vinyle)…sont des homopolymères. Le Tableau 1 montre la structure de quelques homopolymères.
 |
|||
| monomère | polymère | ||
| formule | nom usuel | unité de répétition | nom usuel |
| CH2=CH2 |
éthène (éthylène) |
-(CH2-CH2)n-(1) | polyéthylène |
 |
propène (propylène) |
 |
polypropylène |
 |
chlorure de vinyle |
 |
poly(chlorure de vinyle) |
 |
styrène |
|
polystyrène |
 |
acétate de vinyle |
 |
poly(acétate de vinyle) |
 |
ε-caprolactone |  |
polycaprolactone |
 |
ε-caprolactame |  |
polycaprolactame polyamide 6 (PA 6) |
| H2N-(CH2)10-COOH | acide amino-11-undécanoïque |  |
polyamide 11 (PA 11) |
Tableau 1. Exemples d'homopolymères. (1) Le polyéthylène est issu de la polymérisation de l’éthylène CH2=CH2, d’où la structure –CH2–CH2– et non simplement –CH2– pour l’unité de répétition.
L’utilisation de plusieurs monomères conduira à des copolymères. Selon le mode opératoire et la réactivité des monomères, ceux-ci peuvent s’insérer de différentes façons dans les macromolécules et donner lieu à des copolymères alternés ×××ABABABA×××, statistiques ×××AABABBBAABB××× à blocs ×××AAAAAABBBBB×××, voire ramifiés. Un grand nombre de polyesters tels que le poly(éthylène téréphtalate) ou de polyamides comme le polyamide 6,6 sont des copolymères alternés. L’ABS est un copolymère ramifié à base d’acrylonitrile, de styrène et butadiène. Quelques exemples de structures chimiques de copolymères sont rapportés dans le Tableau 2.
|
copolymère alterné
|
||
| monomères |
unité de répétition des macromolécules nom usuel du polymère |
|
 |
Acide téréphtalique + éthylène glycol |
poly(éthylène téréphtlalate) (PET) |
 |
acide adipique + hexaméthylène diamine (hexane-1,6-diamine) |
polyamide 6,6 (PA 6,6) |
|
copolymère statistique
|
||
| monomères |
une séquence représentative des macromolécules nom du polymère |
|
 |
styrène + acrylonitrile |
poly(styrène-stat-acrylonitrile) |
 |
éthylène + acétate de vinyle |
poly(éthylène-stat-acétate de vinyle) |
|
copolymère à blocs
|
|
styrène + butadiène (CH2=CH-CH=CH2) → polystyrène-bloc-polybutadiène
|
Tableau 2. Exemples de copolymères. Les unités monomère peuvent être alternées (PET, PA 6,6), réparties de façon statistique (poly(styrène-stat-acrylonitrile), poly(éthylène-stat-acétate de vinyle) ou former des blocs (polystyrène-bloc-polybutadiène).
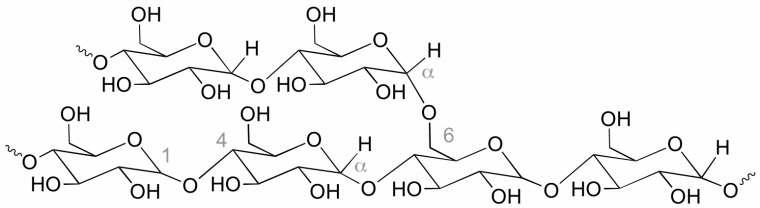
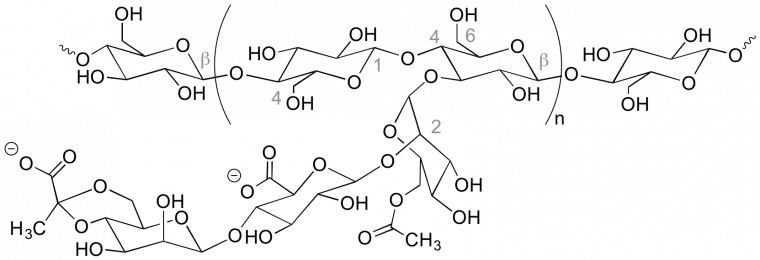
Même si la structure des polymères naturels est généralement plus complexe, il est souvent possible de retrouver les unités monomère. Par exemple, on retrouve facilement les enchaînements des unités glucose dans la formule générale de l’amidon et du xanthane.
L’amidon (Figure 1) est un mélange d’amylose et d’amylopectine. Les macromolécules d’amylose sont formées de 500 à 2000 unités glucose reliées les unes aux autres par des liaisons α(1→4) de type étheroxyde. L’amylopectine est formée de chaînes d’amylose avec des ramifications en α(1→6). Il y a environ une ramification toutes les 30 unités glucose avec une masse molaire comprise entre 100 × 106 et 400 × 106 g.mol-1. Le pourcentage d'amylopectine (environ 70 %) dépend de l'origine de l'amidon.
Le xanthane (E415) (Figure 2) est un polysaccharide synthétisé par la bactérie Xanthomonas campestris. Sa structure de base est formée de chaînes de glucose reliées par des liaisons β(1→4) portant des chaînons latéraux constitués d'un trisaccharide (β-D-mannose (1→4)-β-D-acide glucoronique (1→2)-α-D-mannose). Le mannose terminal peut porter des résidus pyruvate et le mannose précédent peut être acétylé en 6.
Unités monomère et unités de répétition
Il y a très souvent confusion dans la définition des unités monomère et des unités de répétition. L’IUPAC définit très précisément le degré de polymérisation comme le nombre d’unités monomère dans une macromolécule. Il est donc nécessaire de savoir faire la distinction. Comme son nom l’indique, l’unité de répétition est la structure qui se répète tout au long de la chaîne et qui la caractérise en premier lieu. Elle peut être issue d’un seul monomère ou de plusieurs. Dans le premier cas, unité monomère et unité de répétition sont identiques (exemple 1 ci-dessous). Dans le second cas, il est souvent plus difficile, voire impossible de définir une unité de répétition. Le cas le plus simple à décrire est celui où les unités monomère sont alternées. L’unité de répétition est alors constituée par la succession de deux unités monomère différentes (exemple 2). Les exemples ci-dessous permettront d’identifier monomères, unités de répétition et unités monomère sans ambiguïté.
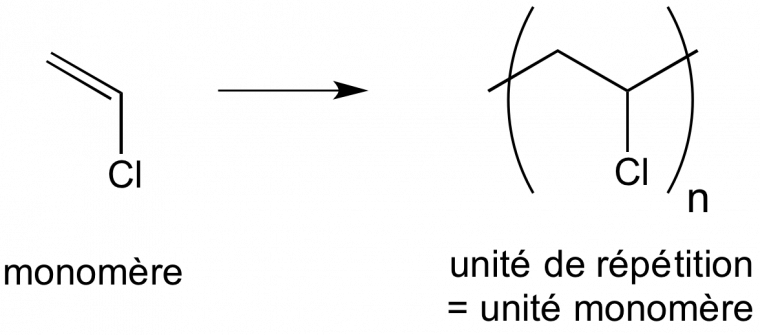
Exemple 1. La polymérisation du chlorure de vinyle conduit au poly(chlorure de vinyle) dont l’unité de répétition est –CH2–CH(Cl)–. Cette unité de répétition est aussi l’unité monomère (Figure 3).
Il faut souligner que cette représentation souvent utilisée n’a pas de sens en termes de réaction chimique dans la mesure où l’on ne tient pas compte de la stœchiométrie. Elle montre simplement que l’on utilise des molécules de chlorure de vinyle pour former un polymère constituée de macromolécules de poly(chlorure de vinyle) dont l’unité de répétition qui est aussi l’unité monomère est une unité chlorure de vinyle.
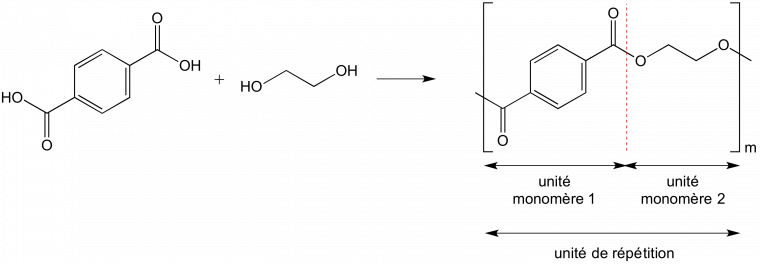
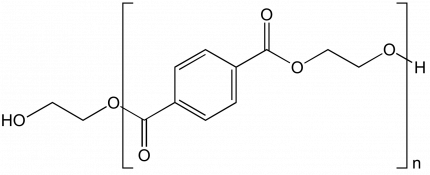
Exemple 2. La copolymérisation de l’acide téréphtalique avec l’éthylène glycol donne le poly(éthylène téréphtalate) (Figure 4). La chimie impose qu’une fonction alcool réagisse avec une fonction acide conduisant à une alternance des unités monomère et donc à un copolymère alterné (copolymère puisque l’on utilise deux monomères différents pour former les macromolécules). L’unité de répétition est constituée de deux unités monomère.
Les extrémités de chaîne changent selon les conditions et les protocoles opératoires. Dans certains cas, on peut obtenir un polymère dont toutes les macromolécules présentent deux fonctions alcool en extrémité de chaîne (Figure 5). La structure générale de ces macromolécules est représentée ci-dessous, avec n unités de répétition et 2n + 1 unités monomère. Le degré de polymérisation est bien (2n + 1).
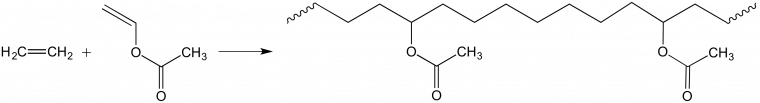
Exemple 3. Le troisième exemple se réfère à la synthèse de copolymères statistiques à base d’éthylène et d’acétate de vinyle (Figure 6). L’enchaînement des unités monomère éthylène et acétate de vinyle dépend de la réactivité chimique des monomères et du protocole opératoire. On observe une distribution statistique des unités monomère dans les macromolécules. On ne peut plus représenter simplement les macromolécules en termes d’unités de répétition, mais simplement par une suite d’unités monomère.
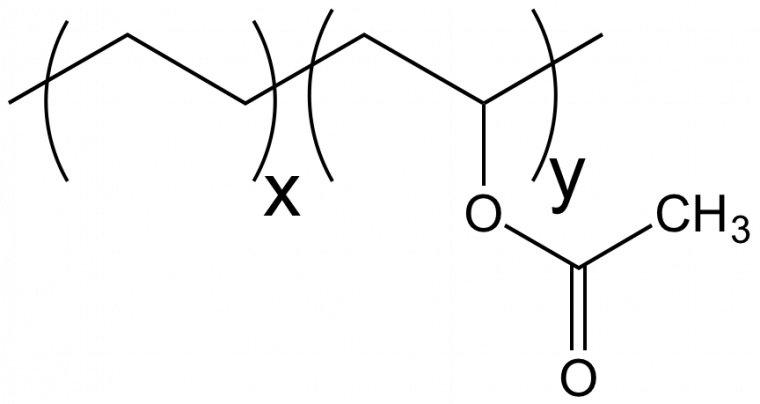
En pratique, on utilise souvent la représentation suivante, analogue à celle des copolymères à blocs (Figure 7).
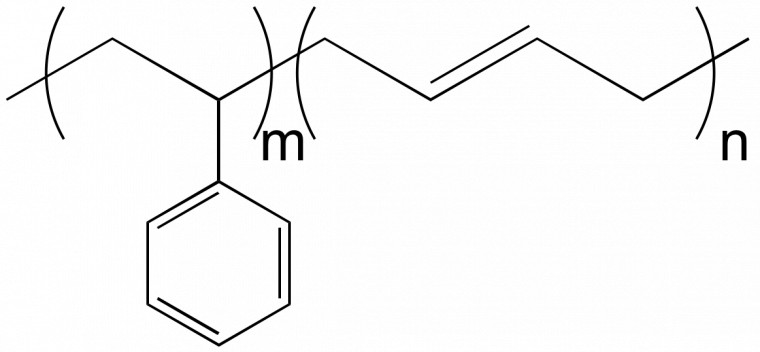
x et y représentent alors la fraction molaire en unités éthylène et acétate de vinyle dans le copolymère. Cette représentation peut prêter à confusion si l’on n’y fait pas attention. Par exemple, styrène et butadiène peuvent donner lieu à des copolymères à blocs ou des copolymères statistiques. On peut représenter la structure générale des macromolécules dans les deux cas sous la forme suivante (Figure 8).
Dans le cas d’un copolymère à blocs, m et n indiquent le nombre d‘unités monomère dans chacun des deux blocs polystyrène et polybutadiène. Le degré de polymérisation est égal à (m + n). Dans le cas d’un copolymère statistique, m et n font référence à la fraction molaire des unités styrène et butadiène dans le copolymère statistique. Il n’y a pas d’information sur le degré de polymérisation.
Macromolécules linéaires et réseaux
Une structure macromoléculaire à conformations multiples
La structure macromoléculaire peut être décrite par l’arrangement des unités monomère les unes par rapport aux autres.
Considérons le cas simple des macromolécules de polyéthylène constituées d’unités monomère –CH2–CH2–. De par les possibles rotations autour des liaisons σ (- C–C-), une macromolécule de polyéthylène peut prendre de multiples conformations. Une macromolécule peut changer de conformations au cours du temps. Ainsi, la probabilité de rencontrer une macromolécule dans sa conformation étirée est minime. Celle-ci est plus facilement décrite par une pelote de laine débobinée et plus ou moins repliée sur elle-même.
De même, un polymère peut être décrit à un instant donné, par une collection de très nombreuses macromolécules présentant toutes des conformations variées. Dans le cas d’un matériau polymère dont les macromolécules ne présentent aucune organisation conformationnelle (matériau amorphe), on utilisera des valeurs moyennes pour décrire la structure générale de ces macromolécules (notion de pelote statistique).
Macromolécules linéaires, ramifiées et réticulées
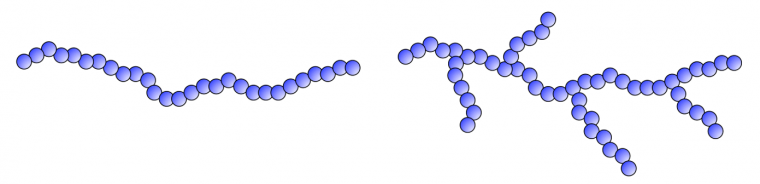
On parle de macromolécules linéaires lorsque les unités monomère sont toujours placées les unes à la suite des autres, quelle que soit la conformation envisagée (Figure 9 gauche).
Les macromolécules peuvent aussi présenter des points de ramification (Figure 9 droite). Les chaînes issues de ces points de ramification peuvent aussi être ramifiées. Ces différentes structures dépendent de la chimie de polymérisation mise en jeu et/ou du mode de synthèse. Par exemple, le PE haute densité (PE-HD) est constitué de macromolécules linéaires alors que le PE basse densité (PE-BD) est formé de macromolécules très fortement ramifiées.
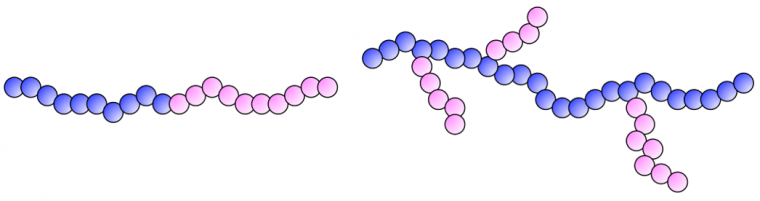
On parle de copolymère greffé lorsque les macromolécules portent des chaînes latérales constituées de motifs de structure chimique différente de la chaîne principale. L’ABS (copolymère acrylonitrile – butadiène – styrène) est un matériau polymère représentatif de cette classe, constitué d’une chaîne principale de polybutadiène sur laquelle sont greffées des ramifications d’un copolymère statistique acrylonitrile-stat-styrène. Ces différentes structures sont illustrées dans la Figure 10.
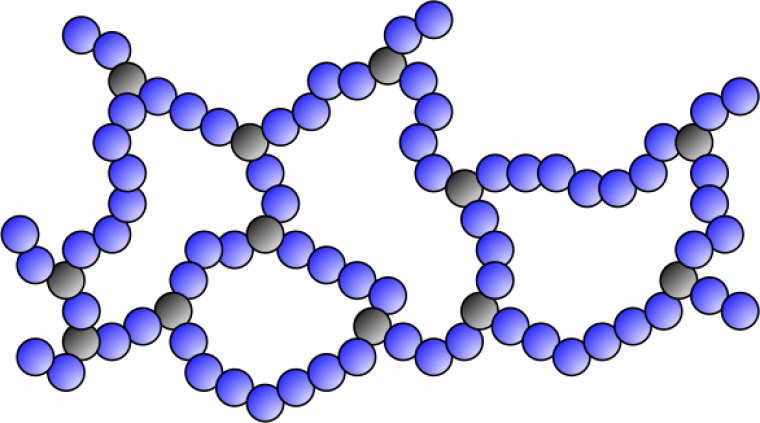
Plusieurs de ces ramifications peuvent finalement être connectées les unes aux autres de façon à former un réseau tridimensionnel macroscopique. On parlera de réseau covalent lorsque les connections seront formées de liaisons chimiques covalentes. Sur la Figure 11, on visualise des nœuds de réticulation et une longueur de chaîne entre points de réticulation.
Thermoplastiques, thermodurs et élastomères réticulés
Dans le cas des macromolécules linéaires et greffées, le polymère est toujours constitué d’un ensemble de macromolécules individuelles qui pourront éventuellement être séparées les unes des autres par solubilisation. D’autre part, face à une sollicitation mécanique adéquate à une température pertinente, les macromolécules peuvent se déplacer les unes par rapport aux autres et conduire à un matériau présentant une nouvelle forme.
On définit ainsi les thermoplastiques comme des polymères pouvant être remis en forme après ramollissement par chauffage et retrouvant une dureté notable après refroidissement.
Dans le cas des polymères réticulés, la notion de macromolécule individuelle n’existe plus et la solubilisation du polymère est impossible, de même que sa remise en forme. La mise en forme définitive de l’objet doit être effectuée lors de la dernière étape de la synthèse. Parmi les polymères réticulés, on distingue les thermodurs et les élastomères réticulés.
Les premiers sont des objets habituellement rigides à la température d’usage avec une densité de réticulation importante. Ils sont souvent obtenus par réaction chimique d’un polymère de base (encore appelé résine ou prépolymère) avec un durcisseur ou par réticulation ultérieure via une autre polymérisation. Par exemple, les résines époxyde sont obtenues par réaction chimique d’un prépolymère porteur de fonctions époxydes avec un durcisseur à fonctions amine. Les polyesters insaturés conduisent à des réseaux thermodurs après réticulation par polymérisation avec le styrène. En toute rigueur, il convient de distinguer les thermodurcissables (polymères susceptibles de conduire à des systèmes réticulés) des thermodurs (thermodurcissables ayant subi une réticulation). L’usage confond très souvent les deux termes au profit du premier.
Contrairement aux thermodurs, les élastomères réticulés sont des matériaux souples à la température d’usage avec une densité de réticulation faible. Par exemple, les polybutadiènes ou polyisoprènes réagissant avec du soufre (vulcanisation) conduisent à des élastomères réticulés.
En guise de conclusion : ce qu’il faut retenir
Nous avons vu dans cette première ressource que les polymères sont un assemblage de macromolécules de haute masse molaire caractérisées par une succession d’unités monomère issues des monomères mis en œuvre lors de la synthèse des polymères.
Les homopolymères et les copolymères tant linéaires que ramifiés ou réticulés sont définis par le nombre de monomères mis en jeu et leur organisation au sein des macromolécules.
Les interactions physico-chimiques entre ces unités monomère gouvernent directement les différents états physiques et les propriétés des polymères. La connaissance de leurs structures chimiques et leur organisation, tant intra- que intermacromoléculaire, permet de comprendre par exemple les comportements mécaniques et les propriétés en solution des polymères. Certaines propriétés ont été évoquées dans cette première ressource et seront développées dans les ressources 3 et 4 (à venir).
La ressource 2 (à venir) est consacrée à la problématique des masses molaires des macromolécules et à leur distribution au sein du polymère.
Quelques références
Cette liste de références francophones, bien sûr non exhaustive, est commune à l’ensemble des ressources ayant trait aux polymères.
- Introduction aux matériaux polymères. Rémi Deterre, Bernard Lestriez. Lavoisier Tec& Doc. 2de édition. 2016.
- De la macromolécule au matériau polymère. Jean-Louis Halary, Françoise Lauprêtre. Belin. 2006.
- Chimie et physico-chimie des polymères. Michel Fontanille, Yves Gnanou. Dunod.
- Traité des matériaux. Matériaux polymères. Propriétés mécaniques et physiques. Hans-Henning Kausch, Nicole Heymans, Christopher John Plummer, Pierre Decroly. Presses Polytechniques et Universitaires Romandes.
- Chimie des polymères. Exercices et problèmes corrigés. Thierry Hamaide, Laurent Fontaine, Jean-Luc Six. Lavoisier Tec& Doc. 2de édition. 2014.
- Initiation à la chimie et à la physico-chimie des polymères. Ouvrages de la commission pédagogique du Groupe Français des Polymères (GFP).