Cet article est à l'origine une séance de Travaux Pratiques proposée dans le cadre des Olympiades de Chimie par Laure Fort. Par des expériences originales et tout à fait accessibles au niveau du secondaire, Laure Fort nous propose d'illustrer « l'agroressource » algue en tant que matière première dans la production d'iode et d'alginate.
Les algues
Autrefois sur ces côtes nord du Finistère, durant l'été, on pouvait voir sur les dunes et les grèves l'activité des paysans goémoniers. Le travail se faisait en famille. Le marin allait récolter les laminaires sur les hauts fonds proches de la côte. A l'arrivée des bateaux sur la grève, les algues étaient transférées sur une charrette et transportées sur les dunes pour le séchage. Ensuite, elles étaient mises en tas en attendant le brûlage qui se faisait dans des fours en pierres sur la dune. On obtenait ainsi des pains de soude qui étaient vendus aux industriels pour en exploiter l'iode.

Les algues sont les plus anciennes formes de vie sur notre planète. Riche de variétés, le champ algal breton recèle, à lui seul, plus de 800 espèces de ces végétaux marins. Les hommes ont cependant utilisé cette ressource abondante de façons très diverses selon les cultures. Si les Asiatiques ont développé très tôt une alimentation puis une gastronomie à base d'algues, les peuples du nord les ont toujours considérées comme un aliment de misère. Engrais naturel, combustible, nourriture, l'algue est devenue avec l'âge industriel une source de matières premières pour la pharmacie, la cosmétique, l'agroalimentaire et l'agro-fourniture.
On peut distinguer quatre époques dans l'utilisation du goémon en Bretagne.
-
Le goémon était utilisé comme engrais.
-
Le goémon était utilisé pour la soude qu'il contient. En 1681, Colbert réglementa la récolte du goémon. La soude était utilisée dans la fabrication du verre.
-
Le goémon était utilisé pour l'iode qu'il contient. En 1811 on découvrit l'iode, produit rare et cher. On l'obtenait en séchant et en brûlant le goémon. L'iode était utilisé en pharmacie (teinture d'iode). Dans les années 1950, l'iode produit au Chili vint concurrencer celui extrait des algues et le remplaça car il coûtait moins cher.
-
Actuellement le goémon est recherché pour ses alginates (les sels de l'acide alginique). Ils servent comme épaississant et gélifiant. On les trouve dans les produits dentaires, les crèmes glacées, les pâtisseries, les parfums, les cosmétiques, les médicaments... On compte plusieurs centaines d'utilisations de ces alginates. Ces produits sont utilisés dans de nombreux domaines: alimentation, papeterie, textile, céramique, cosmétique...
De nos jours, les bateaux goémoniers sont équipés d'une vis hélicoïdale nommée « scoubidou » qui enroule les algues et les remonte. Le scoubidou hydraulique a été une véritable révolution dans le métier. Le problème majeur des goémoniers est longtemps resté le séchage : soumis aux caprices du temps, il mobilisait toutes les familles pour un travail non rétribué. Le naufrage de l'Amoco Cadiz a pesé lourd dans la décision des usines d'acheter à partir de 1978 le goémon non séché. En l'an 2000, ce sont 25 bateaux du port de Lanildut qui ont pratiqué la récolte.

Matière première dans la production d'iode
L’élément iode, présent dans les algues, est piégé dans les cellules ; pour l’atteindre (ainsi que les autres oligoéléments) il faut détruire la structure cellulaire ; la meilleure méthode est de transformer l’algue en cendres.

-
Préparation des cendres : Prélever une masse m d’environ 8 à 10 g d’algues séchées. Les placer sur une plaque métallique et chauffer fortement sous la hotte.
-
Lessivage / filtration : Les cendres obtenues seront rassemblées dans un mortier. Y verser un volume V de soude (à environ 0,1 mol/L) de l’ordre de 150 mL. Le filtrat est recueilli dans un bécher.

-
Concentration du filtrat : laisser bouillir pour réduire le volume d’un tiers environ.
-
Acidification du filtrat : verser, tout en agitant, quelques millilitres d’une solution d’acide sulfurique concentrée (à 2 à 3 mol/L) ; observer une effervescence ; vérifier que le pH final est acide – dans le cas contraire, rajouter un peu d’acide.
-
Régénération du diiode : Par oxydation, les ions iodure sont transformés en molécule I2, très faiblement soluble dans l’eau en l’absence d’ions iodure. L'oxydant choisi est l'eau oxygénée en milieu acide. Introduire une dizaine de mL d’eau oxygénée à 1 mol/L.

-
Extraction du diiode : on extrait le diiode en suspension dans la solution par le cyclohexane ; observer la coloration du cyclohexane.

Matière première dans la production d'alginate
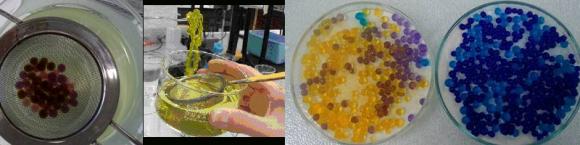
A l’interface entre une solution d’ions calcium et une solution d’alginate de sodium il se forme instantanément un film solide qui s’épaissit progressivement avec le temps.

-
Préparer 100 mL de solution colorée S (colorant alimentaire par exemple) d’alginate de sodium de concentration massique 10,0 g.L-1 ; la réserver dans un bécher.
-
Préparer environ 250 mL de solution S’ de chlorure de calcium à 3% massique ; la réserver dans un petit cristallisoir.
-
Préparer un cristallisoir d’eau distillée.
-
Prélever un à deux mL de la solution S du bécher avec la paille et les reverser goutte à goutte dans la passoire placée dans la solution S’ (dans le cristallisoir) : les gouttes se figent immédiatement, il ne reste qu’à les rincer en plongeant la passoire dans l’eau distillée puis de les égoutter avant de les stocker dans la soucoupe

Ressources en ligne
[1] Un travail historique et pédagogique mené avec des classes de seconde du lycée de Landerneau entre les années 1995 et 2000.






