Le contact entre l'eau et le plomb métallique donne inévitablement lieu à des phénomènes de corrosion dont l'ampleur dépend aussi bien des propriétés physico-chimiques du fluide que des caractéristiques du réseau. Dans le cas de tuyaux anciens entartrés, la contamination de l'eau par dissolution partielle des phases minérales déposées sera gouvernée par ces mêmes facteurs.
Impact de la qualité de l'eau
La corrosion interne des canalisations et des accessoires qui se caractérise par la solubilisation partielle des matériaux constitutifs des installations, entraîne une détérioration de la qualité chimique et microbiologique de l'eau. La vitesse à laquelle celle-ci se produit dépend de nombreux facteurs chimiques et physiques, notamment de la concentration en calcium, bicarbonate (hydrogénocarbonate HCO3-), carbonate (CO32-) (bilan calco-carbonique), orthophosphate (PO43-), sulfate, chlorure, oxygène dissous, de la température ainsi que du pH. De celui-ci dépendent la solubilité, la vitesse de réaction et, dans une certaine mesure, la réactivité chimique superficielle de la plupart des métaux participant aux réactions de corrosion. Le pH joue un rôle particulièrement important dans la formation d'une pellicule protectrice à la surface du métal. Les propriétés des produits stables résultant de la corrosion sont d'une grande importance. Si l'un d'eux est soluble dans l'eau, la corrosion aura tendance à progresser rapidement. Lorsque les produits de corrosion sont insolubles, il peut se former une couche protectrice au contact de l'eau et la corrosion sera très lente. Les produits de corrosion insolubles n'ont un effet protecteur que s'ils forment une couche imperméable. S'ils forment une masse spongieuse ou floconneuse, la corrosion se poursuivra en entraînant une détérioration de la qualité de l'eau, une réduction du débit de la canalisation et une croissance des microorganismes qui risquent d'être protégés de l'action du chlore résiduel.
A des valeurs du pH inférieures à 6,5 aucun dépôt ne peut se former et la teneur en plomb dans l'eau peut atteindre plusieurs milligrammes par litre. En milieu faiblement basique, le plomb est stable dans l'eau sous différentes formes qui dépendent du pH. La formation de carbonate (cérusite : Pb(CO3)), d'hydroxycarbonate (hydrocérusite : Pb3(CO3)2(OH)2) et au-delà de pH 12,5 d'hydroxyde de plomb, tous insolubles, détermine dans une large mesure la concentration en métal dissous. Ces sels deviennent nettement plus solubles lorsque le pH est inférieur à 8 en raison de la diminution importante de la concentration de carbonate à l'équilibre. Ainsi, des couches constamment renouvelées d'hydrocérusite, d'hydroxypyromorphite (Pb5(PO4)3OH) lorsque l'eau contient des orthophosphates (PO43-) et plus rarement de cérusite et de plombonacrite (Pb10(CO3)6(OH)6O) adhèrent aux parois. Bien que celles-ci se dissolvent en permanence au contact de l'eau en écoulement ou en stagnation, elles forment néanmoins un écran entre le fluide et la surface du métal qui ralentit la vitesse de diffusion de l'oxygène dissous et donc de la corrosion. La solubilité théorique peut être estimée à l'aide de modèles thermodynamiques grâce à la simulation numérique des diagrammes de prédominance des différentes espèces chimiques impliquées dans le processus de corrosion.
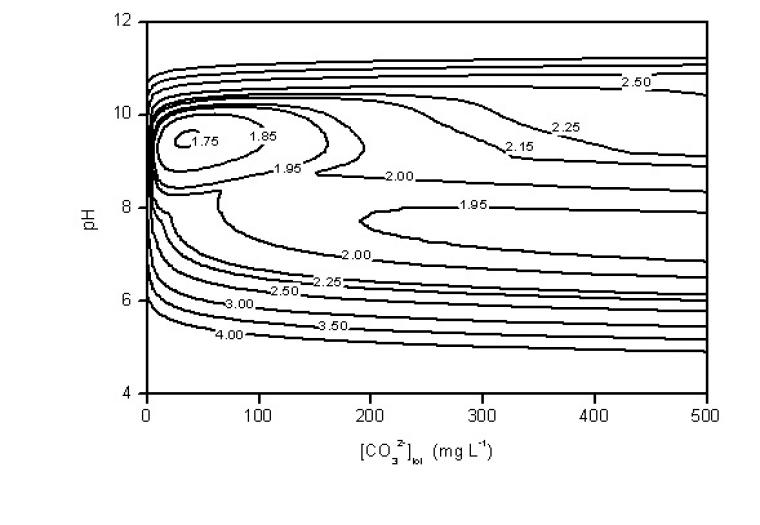
La figure 1 représente une cartographie de la concentration totale en plomb soluble en fonction du pH et de la concentration totale en ions carbonate ainsi calculée à partir de la solubilité de la cérusite et de l'hydrocérusite (simulation du degré de contamination de l'eau en stagnation dans une canalisation ancienne entartrée). La pollution de l'eau résulte de la dissolution de la cérusite en deçà de pH ~ 8,6 et de l'hydrocérusite en milieu plus alcalin. Le minimum de solubilité est atteint vers pH 9,7 pour une concentration en carbonate d'environ 50 mg.L-1 et correspond à une concentration en plomb dissous de 55 µg.L-1.
Contrairement à une idée largement répandue, les dépôts calciques qui se forment à la surface des canalisations en métal ferreux et qui les protègent n'apparaissent pas au contact de plomb. L'analyse des incrustations trouvées dans les tuyaux transportant des eaux calcifiantes révèle une teneur en calcium qui n'excède guère 2 à 5 %. En fait, la précipitation du carbonate de calcium n'a lieu que sur les zones cathodiques et conduit à un dépôt discontinu, peu adhérent à la paroi, qui est facilement entraîné dès sa formation [1,2]. Ainsi, les conduits n'étant pas isolés naturellement de l'eau véhiculée par une couche protectrice de calcaire, leur corrosion ainsi que la libération concomitante d'ions Pb2+ dans le milieu se poursuit inexorablement. Paradoxalement, des études de corrosions ont montré que la présence de calcium tend à accroître la solubilité du plomb, probablement en raison de la formation d'une paire d'ions de formule Ca(HCO3)+ qui réduit la teneur globale en carbonate [2,3].
Impact du réseau
Comme pour la plupart des sels, la solubilité des carbonates dans l'eau croît à mesure que la température augmente. La quantité de plomb massif qui se dissout dans une solution d'hydrogénocarbonate de sodium ou de calcium est multipliée par un facteur deux lorsque la température s'élève de 12 à 25 °C [2]. Ainsi, une forte augmentation des teneurs en plomb peut être observée si le tuyau se situe dans un appartement ou passe à proximité d'une conduite mal isolée d'un chauffage central.
L'architecture du réseau et le mode d'utilisation de l'eau (fréquence et volume des soutirages...) constituent également des facteurs importants dont dépendent les taux de plomb détectables à la sortie du robinet [4,5]. La rapidité de la corrosion dépend principalement de la vitesse à laquelle les réactifs en solution sont transportés jusqu'à la surface du métal et de celle à laquelle les produits solubles qui se forment sont entraînés. Le taux de corrosion augmente donc directement avec la concentration des ions dans l'eau ainsi qu'avec le degré d'agitation. Lorsque la vitesse d'écoulement est très élevée, le taux de corrosion peut augmenter de façon spectaculaire en raison du phénomène d'érosion.
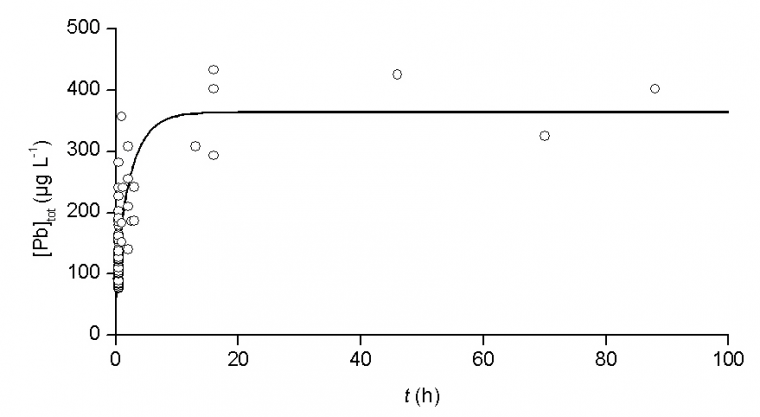
Inversement, la durée de stagnation joue également un rôle essentiel. Les travaux de Wagner ont permis de rationaliser l'incidence du diamètre des conduites et de la durée de stagnation sur la teneur en métal dissous [6]. La vitesse de corrosion dans les premiers instants de stagnation est d'autant plus rapide que le diamètre interne du tube est faible. A température ambiante, la concentration maximale ([Pb]infinie) correspondant à un état d'équilibre thermodynamique est atteinte après un temps de séjour d'une dizaine d'heures environ dans un tuyau neuf d'une longueur de 25 mm et d'un diamètre interne de 15 mm (Figure 2). Ce laps de temps est d'autant plus long que la canalisation est ancienne et entartrée. Cependant, la concentration moyenne en plomb atteint déjà près de 40 % de la teneur limite, soit ~140 µg.L-1 après 30 min seulement de stagnation !
La corrosion est aussi fortement influencée par les propriétés électriques des métaux en contact avec l'eau. Chaque métal a une tendance différente à acquérir une charge électrique ; cette différence est illustrée par la série des potentiels galvaniques. Lorsque le plomb est en contact avec d'autres matériaux conducteurs de l'électricité, tels qu'un tube de cuivre, de laiton ou d'acier galvanisé, il se forme une pile galvanique dans laquelle le métal se dissout dans les zones anodiques. Il n'est pas nécessaire que les deux métaux en cause soient situés au même endroit, mais seulement qu'ils soient en contact électrique. La formation de piles galvaniques peut aussi résulter de l'utilisation éventuelle du réseau pour la mise à la terre d'appareils électriques.
Contamination due à la libération de particules
Des pics de concentration aléatoires qui dépassent très largement les normes, sont fréquemment constatés au robinet des usagers. Dans ce cas, l'eau contient en plus du plomb dit "soluble" des particules solides en suspension d'une taille approximativement comprise entre 1 et 10 µm [2,3,7]. Constituées principalement de carbonate ou d'hydroxycarbonate de plomb, ces particules résultent de la précipitation des sels correspondants. En effet, des surconcentrations peuvent apparaître au voisinage de singularités dans le réseau, telles qu'une vanne, un raccord ou une soudure, qui créent localement une pile galvanique et favorisent ainsi l'émission de ces particules dans les eaux de premier jet. Par ailleurs, le plomb peut aussi être présent sous forme colloïdale ou être associé à d'autres types de colloïdes ou de particules (hydroxydes de fer, calcite, sédiments...) par complexation de surface, adsorption ou échange d'ions. L'érosion amplifiée par des chocs et des vibrations des éléments de plomberie et en particulier des brasures plomb-étain constitue une autre source de contamination responsable des pics de concentration [7].
Prevention of Corrosion and Scaling in Water Supply Systems. Ellis Horwood, Londre. 1990.
[2] P. Leroy, J. Water Supply, AQUA 1993, 42, 233.
[3] P. Leroy, TSM. Tech. Sci. Méthodes, Génie Urbain Génie Rural 1994, 122.
[4] A. Montiel, P.Bousset, J.P. Duguet, B. Welté, TSM. Tech. Sci. Méthodes, Génie Urbain Génie Rural 2001, 35.
[5] G. Nicolas, TSM. Tech. Sci. Méthodes, Génie Urbain Génie Rural 2001, 69.
[6] A. Kuch, I. Wagner, Water Res. 1983, 17, 1303.
[7] D.A. Lytle, M.R. Schock, N.R. Dues, P.J. Clark, J.-Am. Water Works Assoc. 1993, 85, 104.
Autre source d'informations
Le site internet du Comité pour l'Europe Occidentale contre la Corrosion des Conduites Souterraines (CeoCor) fournit de nombreuses informations complémentaires, notamment les actes des colloques organisés sous son égide.