Ce premier article du dossier Le stockage de l’énergie électrochimique en technologie Lithium-ion présente quelques généralités autour du lithium et explique en quoi les propriétés du lithium ont conduit à l'élaboration de batteries aux performances extraordinaires.
Introduction
Le prix Nobel de chimie 2019 a été décerné aux trois inventeurs John B. Goodenough (Université du Texas, Etats-Unis), M. Stanley Whittingham (Université de Binghamton, Etats-Unis) et Akira Yoshino (Université de Meijo, Japon) pour la découverte et leur développement des batteries Li-ion. Ces dernières sont à la base de l’émergence de nombreuses technologies portatives et mobiles telles que les téléphones et ordinateurs portables, les transports électriques (voiture, scooter, vélo) à grandes autonomie, et sont aussi envisagées pour le stockage massif stationnaire de l’électricité sur le réseau électrique (le « grid »). Elles sont également pressenties pour jouer un rôle important dans la transition énergétique à venir.
Quelques chiffres autour du lithium
- Les batteries Li-ion LiFePO4/C (3.3 V) ont une densité d’énergie quatre fois supérieure à celle des batteries au plomb (130W.h.kg-1 / 35W.h.kg-1), une faible autodécharge, une puissance accessible et une durée de vie bien supérieure.
- 1kW.h (20 ampoules de 50W fonctionnant pendant 1 heure) correspond à 113 g de Lithium métallique soit 600 g de carbonate de lithium. Il faut environ 0,3 g de lithium métal pour produire 1 ampère pendant 1 heure.
- Une batterie de téléphone contient en moyenne 0,5 g de lithium, un ordinateur (90W.h) 10g et une batterie de voiture (24kW.h, 160km) 3 kg.
- L’empreinte carbone des batteries au lithium est loin d’être nulle : 150 kg de CO2 (530 kW.h) pour produire une batterie de 1 kW.h.
- 250 tonnes de roches (spodumènes) doivent être extraites pour produire 1 tonne de lithium. 77000 tonnes de lithium auraient été extraites en 2019, avec un impact certain sur l’environnement.
Quelques définitions et rappels
Accumulateur, batterie et pile
- L’accumulateur électrique utilisé pour le stockage électrochimique de l’énergie, est un générateur électrique constitué de deux conducteurs électriques, les électrodes, au contact d’un conducteur ionique, l’électrolyte, sous forme liquide, gel ou bien solide.
- La batterie d’accumulateur ou plus simplement la batterie correspond à l’assemblage d’accumulateurs individuels afin d’obtenir les tensions, et courants désirés.
- La pile n’est pas rechargeable, le terme « pile rechargeable » correspond donc à un abus de langage. On préfère alors parler pour les piles de batteries primaires, par contraste avec les batteries secondaires qui sont rechargeables. Les Anglo-Saxons ne font pas la différence batterie/pile, toutes deux regroupées sous le même terme « battery ».
Bien que l’usage préfère le terme « batterie », il est souhaitable dans le cadre d’un enseignement d’utiliser le terme « accumulateur électrique », la discussion devant principalement porter à la fois sur les notion d’accumulateur (« appareil qui emmagasine de l'énergie pour la restituer à mesure des besoins »), d’accumulateur électrique et sur la différence fondamentale entre pile et accumulateur électrique. Cette série d’articles destinée à un public varié prend la liberté d’utiliser le terme « batterie » à la place du terme « accumulateur électrique », le terme « batterie » étant plus communément rencontré, notamment dans les articles de vulgarisation et dans les communiqués de presse scientifique.
Batterie secondaire
Nicolas Gautherot constate lors d’expériences d’électrolyse de l’eau en 1802 que les électrodes en platine utilisées restent polarisées après l’expérience (par adsorption d’oxygène et d’hydrogène) et observe en court-circuitant ces deux électrodes un courant « secondaire ». Le terme de batterie secondaire qui tient son origine de ces courants secondaires, est associé aux batteries rechargeables.
Anode / cathode et électrodes (+) / (-)
L’attribution des termes anode et cathode aux électrodes d’une batterie change lors de la charge (réaction forcée : convention « électrolyseur ») et de la décharge (réaction spontanée : convention « générateur »). Il est donc plus aisé de parler d’électrodes positive et négative :
(-) réduction | Charge | oxydation (+)
(-) oxydation | Décharge | réduction (+)
La convention charge est donc souvent retenue pour nommer les matériaux d’électrode :
Anodes pour (-) : lithium, graphite, Li4Ti5O12 (LTO)…
Cathodes pour (+) : LiCoO2 (LCO), LiFePO4 (LFP), LiMn2O4 (LMO)…
Les choses se compliquent toutefois lors d’un test en demi-cellule ! Pour le couple lithium/graphite par exemple, où le graphite devient l’électrode positive …
La genèse de la révolution du « sans fil »
L’essor initial des batteries au lithium au début des années 1970 résulte d’une prise de conscience de problèmes environnementaux et sanitaires liés au développement des véhicules à moteur thermique utilisant les énergies fossiles, notamment dans les grandes villes, et de problèmes de ressources pétrolifères finies avec en toile de fond un premier choc pétrolier en 1973 (le deuxième suivra en 1979). Ce contexte a poussé des géants du pétrole comme Exxon (Etats-Unis) à investir dans le développement des batteries au lithiumaccumulateurs Nickel-Cadmium déjà largement utilisés.
- 1976 - Batterie de 2V - Whittingham, employé d’Exxon depuis 1972, propose un premier prototype de batterie secondaire (breveté en 1977) associant une électrode négative en lithium métallique, un électrolyte non-aqueux (constitué d’un solvant le carbonate de propylène PCet d’un sel LiPF6) et un matériau d’électrode positive TiS2 (LTS) dans lequel les ions lithium peuvent s’insérer (s’intercaler) de façon réversible (voir figure 1). C’est en travaillant sur l’étude des changements de conductivité électrique de matériaux chalcogénures comme TaS2 et TiS2, connus depuis 1965 pour leur capacité à intercaler des ions (W. Rüdorff), qu’il découvrit leur potentiel énergétique. Dès lors, les problèmes de court-circuit et d’explosion des batteries se manifestent. Le coupable est le lithium métallique, qui lors des cycles répétés d’électrodépôt et d’électrodissolution, forme des dendrites qui croissent en direction de la cathode, traversent le séparateur, jusqu’au contact « fatidique » qui donne lieu à un emballement thermique de la batterie (feu, explosion).
- 1979-1980 : Batterie de 4-5V - Le groupe de John Goodenough à l’université d’Oxford, au Royaume-Uni, propose un matériau à structure similaire à celle de TiS2, le dioxyde de cobalt CoO2, pour lequel l’électronégativité supérieure de l’oxygène par rapport au soufre (effet inductif) donne lieu à une tension de fonctionnement plus élevée tout en permettant une diffusion rapide du lithium. L’université d’Oxford refusa de breveter cette invention.
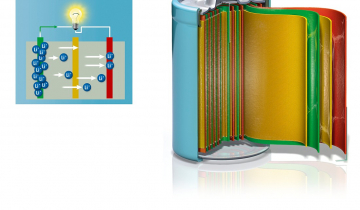
- 1985 : Alternative au lithium métallique - Le groupe d’Akira Yoshino au Japon (Asahi Kasei Corporation), propose d’utiliser un matériau carboné, le coke de pétrole, comme matériau d’anode en remplacement du lithium métallique. Au sein du coke, les ions lithium sont insérés de façon réversible au niveau des domaines graphitiques. Ces derniers sont entourés de domaines amorphes qui les protègent de l’insertion concomitante du solvant PC avec l’ion lithium. En effet, la co-intercalation de PC, est connue pour détruire la structure en feuillet du graphite (exfoliation). En substituant l’anode en lithium métallique par un composé carboné d’insertion des ions lithium, la technologie lithium-ion était née.
- 1991 : Premier modèle commercial de batterie Li-ion produit par Sony Corp. - Cette batterie de 4,1 V est constituée d’un matériau d’anode à base de coke, d’un matériau de cathode LixCoO2 (LCO) et d’un électrolyte à base de solvant PC et de sel LiPF6. Dès lors, les performances et la sécurité des batteries Li-ion n’ont cessé d’être améliorées tout en réduisant leur coût de production, par l’exploration et la découverte de nouveaux matériaux d’électrode ainsi que de nouvelles compositions d’électrolyte, par l’optimisation de la formulation des électrodes, par la mise au point de systèmes électroniques de protection des batteries (profondeur de charge et décharge, température) et l’ouverture progressive de nouveaux marchés (téléphonie, automobile, stationnaire…).
NB : La brève chronologie exposée ci-dessus, met en valeur uniquement les travaux des lauréats du Prix Nobel, il faut cependant comprendre que de nombreuses autres équipes de chercheurs à travers le monde ont contribué de façon simultanée et significative aux découvertes et développement des batteries Lithium-ion. On pourra ainsi notamment se référer aux travaux de Jürgen O. Besenhard (Université de Gratz), Samar Basu (Bell’s lab), Ned A. Godshall, Rachid Yazami (Université NTU), Jef Dahn (Université de Dalhousie), Yet-Ming Chiang (MIT), Michael M. Thackeray (Argonne National Lab), Peter Bruce (Université d’Oxford) et à ceux des chercheurs français mentionnés en fin d’article.
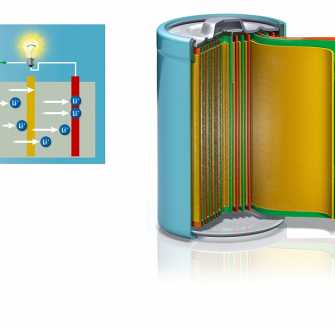
Principe de fonctionnement des premiers accumulateurs au lithium
Cette vidéo présente la première configuration d'accumulateur au lithium (2V) proposée par S. Whittingham et brevetée en 1977 (Exxon) associant du lithium métallique et un matériau d’intercalation, d’abord le disulfure de tantale puis le disulfure de titane. Au sein de ce matériau lamellaire (structure en feuillet), les ions lithium peuvent être insérés (stockés) de façon réversible. Pendant le fonctionnement de la batterie (décharge), les ions lithium sont transportés au sein de l’électrolyte depuis l’électrode négative où ils sont produits par oxydation dissolutive du lithium métallique (avec éjection d’un électron e-), vers l’électrode positive dans laquelle ils peuvent s’insérer (par injection simultanée d’un e-). Les électrons circulent de l’anode vers la cathode par le circuit dit « extérieur », produisant un courant.
Le développement de ces accumulateurs dits « Lithium-métal » a été mis entre parenthèse pendant quasiment 30 ans en raison de problèmes de sécurité (voir le paragraphe « formation de dendrites »). Ces accumulateurs sont à distinguer des accumulateurs « Lithium-ion » n’utilisant pas du lithium métallique comme électrode mais un matériau plus sûr dit « hôte » au sein duquel les ions lithium peuvent être insérés de façon réversible.
Illustration : © Johan Jarnestad, The Royal Swedish Academy of Sciences.
Formation de dendrites
Lors des cycles répétés de charge et décharge, du lithium métallique peut être électrodéposé et accumulé sous forme de dendrites à l’électrode négative (ici, sur le lithium en configuration demi-cellule). Ces dendrites, qui peuvent créer un court-circuit entre les deux électrodes négatives et positives, sont responsables de l’emballement thermique des batteries.
La vidéo ci-dessous permet de visualiser la formation de ces dendrites.
La réactivité du lithium à l'origine de performances électriques extraordinaires
La chimie du lithium
Le lithium a été découvert en 1817 sous sa forme ionique par Johan August Arfwedson au sein du laboratoire de Jöns Jacob Berzelius en Suède lors de l’étude de roches silicates (Pétalite ou Castorite). Le potentiel standard du couple Li+/Li très négatif (électroréducteur) de -3,04 V vs ESH, les faibles masses molaires et volumiques du lithium (qui valent respectivement 6,9 g.mol-1 et 0,54 g.cm-3, faisant du lithium le métal le plus léger) et sa disponibilité importante (5,4 millions de tonnes dans les salars boliviens, 7,5 millions de tonnes au Chili, 230 milliards de tonnes dans les océans) expliquent son caractère très attractif pour les applications énergétiques, notamment mobiles, pour lesquelles la masse embarquée est critique.
Un morceau de lithium métallique est placé dans une boîte de Petri remplie d'eau. On observe la formation de bulles de dihydrogène selon la réaction d'équation : Li(s) + H2O(l) → Li+(aq) + OH-(aq) + 1/2 H2(g).
Le potentiel très électronégatif du lithium est associé à une grande réactivité, notamment avec l’eau. La réaction de ce métal alcalin avec l’eau est exothermique, produit du dihydrogène H2(g) et alcalinise le milieu (Li+ OH-, NH3 à partir de N2 dissous) mais est peu explosive à température ambiante.
Les autres métaux alcalins comme le sodium, montrent une cinétique de réaction bien plus rapide (explosive) avec l’eau qui peut être expliquée par la liquéfaction du sodium (Tf (Na) = 97,79°C < Tf(Li) = 180,50°C) et la grande surface de réactivité du métal sous forme liquide (formation de dendrites liquides).
Le lithium métallique réagit également avec le dioxygène et est le seul métal alcalin à réagir avec le diazote, nécessitant des précautions particulières lors de sa manipulation.
Réactivité du lithium métallique
Le lithium réagit spontanément avec l'eau lors d'une réaction faiblement exothermique, relativement lente, libérant du dihydrogène et alcalinisant le milieu... mais aussi avec le diazote et le dioxygène!
Li(s) + H2O(l) → Li+(aq) + OH-(aq) + ½ H2(g)
6 Li(s) + N2(g) → 2 Li3N(s) (nitrures)
Li3N(s) + 3 H2O(l) → 3 LiOH(s) + NH3(aq)
4 Li(s) + O2(g) → 2 Li2O(s)
Alors que le lithium métallique est brillant, ductile et conducteur, le nitrure de lithium (Li3N) est noir, friable et isolant. Le métal lithium doit donc être stocké sous atmosphère inerte, par exemple en boîte à gants pressurisée remplie d’argon ou d’hélium pour des applications en stockage de l’énergie.
Stabilité du lithium métallique en milieu organique
Dès 1958, il a été observé par W. S. Harris (UC Berkeley) que le lithium pouvait être électrodéposé (donc stabilisé) sous forme métallique à partir d'une solution composée de perchlorate de lithium (LiClO4) dissous dans un solvant organique, le carbonate de propylène (PC), suscitant un intérêt immédiat. Ce composé cyclique de constante diélectrique élevée permet en effet de solubiliser une grande variété de sels de lithium en quantité importante ; par ailleurs le carbonate de propylène se trouve à l’état liquide sur une large plage de température (-48,8°C - 242°C). Cette composition d’électrolyte à base de carbonate organique cyclique et de sel de lithium a largement contribué au développement des batteries au lithium et a peu évolué depuis. En effet, en dépit de la fenêtre de stabilité limitée de PC en potentiels cathodiques, le lithium formé est stable de par la formation d’une couche passive à sa surface. Cette couche, qui résulte de la réduction de l’électrolyte concomitante de la réduction des ions lithium, explique les rendements faradiques d’électrodéposition/électrodissolution du lithium de l’ordre de 85% alors observés.
Le miracle de l'interphase
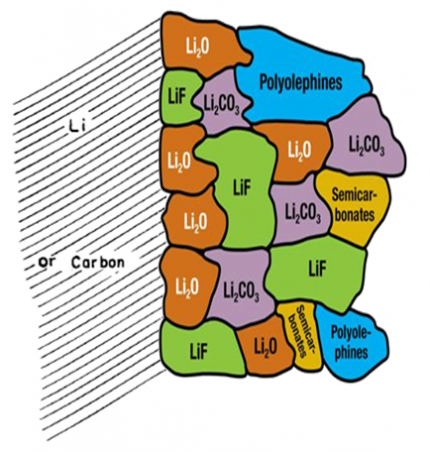
La couche passive qui se développe entre l’électrode négative et l’électrolyte pendant la charge aux valeurs basses de potentiel est appelée interphase d’électrolyte solide (Solid Electrolyte Interphase : SEI). La SEI explique le fonctionnement des batteries au lithium en dehors de la fenêtre de stabilité de l’électrolyte car elle empêche la réduction de l’électrolyte à chaque charge tout en permettant la diffusion des ions lithium vers l’électrode (couche semi-passive).
Cette couche organique/inorganique bloque le transfert d’électron à l’électrolyte mais permet la diffusion du lithium vers l’électrode.
Figure adaptée de J. Electrochem. Soc. 144 (1997) L208.
Cette SEI, décrite pour la première fois par E. Peled (Israël) en 1979 et largement étudiée notamment par D. Aurbach (Israël), est constituée de composés organiques et inorganiques qui sont des produits de réductions de l’électrolyte. La nature, à la fois de l’électrode négative et de l’électrolyte, détermine les propriétés de la SEI, parmi lesquelles : sa composition, sa structure, sa stabilité, son caractère résistif au transport électronique mais aussi ionique et la quantité de charge consommée de façon irréversible pour assurer sa formation. Depuis peu, la formation d’une telle interphase est également suspectée sur certains matériaux d’électrode positive (CEI pour « Cathode Electrolyte Interphase » ou SPI pour « Solid permeable interphase »).
Les propriétés de ces SEI et CEI au cours des cycles de charge/décharge successifs sont souvent à l’origine de la dégradation en performances de la batterie : elles font donc toujours l’objet d’une grande d’attention. Le recours à des électrolytes tout solide sous forme de polymère gélifié (ex : Poly(oxyde d’éthylène) PEO) permet de minimiser les problèmes relatifs à l’interface.
Premières piles au lithium
Les piles au lithium (métal) sont des batteries primaires (1,5-3,6V), non rechargeables, qui ont été introduites dès 1970 notamment sous la forme de piles boutons. Ces systèmes sont constitués d’une anode en lithium métallique, d’une cathode composée de carbone enduit d’un film électroactif (LiMnO2, LiFeS2, LiV2O5) et d’un électrolyte organique à base de carbonate de propylène et diméthoxyéthane (DME) et de sels de lithium (LiClO4, LiBF4…). Dans le cas des piles Li-SOCl2 (1973), dites à cathode liquide, le chlorure de thionyle (SOCl2), qui est le solvant, est réduit irréversiblement à la cathode en carbone pendant la décharge de la pile tandis que l’anode en lithium métal est dissoute (sel : LiAlCl4) selon la réaction non-renversable 2SOCl2 + 4 Li → S + SO2 + 4 Li+ + 4Cl- .
Un peu de thermo(électro)chimie
Potentiel de Nernst - Le potentiel de Nernst (1889) du couple Li+/LiMétal correspond à la force électromotrice (fem) aux bornes de la pile « factice » suivante Pt | H2(g), H+ || Li+ , LiMétal | Pt avec la demi-pile de gauche constituée de l’électrode standard à hydrogène H+/H2 (ESH).
$E_{H^+/H_2}=E^0_{H^+/H_2}=0$ par convention : le couple H+/H2 est dit « silencieux ».
$$\Delta E=E_{Li^+/Li_{métal}}-E_{H^+/H_2}=E_{Li^+/Li_{métal}}$$
Energie de réaction et fem - La réaction associée à la pile considérée a pour équation : Li+(aq) + ½ H2(g) = Li(s) + H+(aq)
L’énergie de la réaction à température et pression constantes correspond à l’enthalpie libre de réaction ΔrG et est liée au potentiel d’électrode par la relation qui suit, avec ℱ la constante de Faraday et n le nombre d’électrons échangés dans la réaction :
$$\Delta_{r}G=-nℱ \Delta E=-nℱ E_{Li^+/Li_{métal}}$$
Plus généralement, la mesure d’une fem aux bornes d’une pile renseigne sur l’énergie de la réaction associée.
Enthalpie, entropie, enthalpie libre standard de réaction et potentiel standard
Enthalpie standard de formation et entropie standard :
|
|
Li+(aq) |
Li(s) |
H+(aq) |
H2(g) |
|
ΔfH° (kJ.mol-1) |
-278,5 |
0 |
0* |
0 |
|
S° (J.mol-1.K-1) |
13,4 |
29,1 |
0* |
130,7 |
*par convention !
$\Delta_{r}H^0=\Delta_{f}H^0_{Li(s)}+\Delta_{f}H^0_{H^+(aq)}-\Delta_{f}H^0_{Li^+(aq)}-\frac{1}{2}\Delta_{f}H^0_{H_2(g)}$
$\Delta_{r}H^0$ = 278,5 kJ.mol-1
$\Delta_{r}S^0=S^0_{Li(s)}+S^0_{H^+(aq)}-S^0_{Li^+(aq)}-1/2 S^0_{H_2(g)}$
$\Delta_{r}S^0$ = - 49,65 J.K-1.mol-1
$\Delta_{r}G^0=\Delta_{r}H^0-T\Delta_{r}S^0$ = 293,3 kJ.mol-1
$E^0_{Li^+/Li}=-\frac{\Delta_{r}G^0}{nℱ }$ = - 3,04 V / ESH
De par son caractère très réducteur, le lithium est capable de réagir avec beaucoup d’espèces au travers de réactions très exothermiques. L’énergie de la réaction, principalement thermique, est récupérée sous forme d’énergie électrique dans la pile et les batteries au lithium.
Une liste des acronymes utilisés dans tout le dossier, ainsi qu'une version au format PDF de cet article et du préambule du dossier sont fournies ci-après.
Documents à télécharger