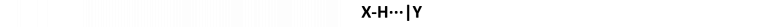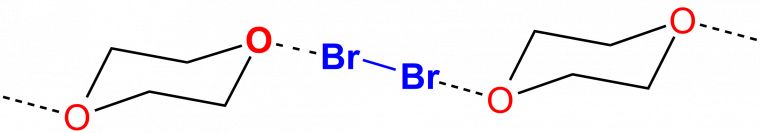Les premiers articles du dossier intitulé Les interactions non covalentes au service du traitement des canalopathies présentent les divers types d'interactions non-covalentes. L'article ci-dessous dresse un portrait complet de l'interaction électrostatique et explicite la liaison hydrogène et la liaison halogène.
Définition
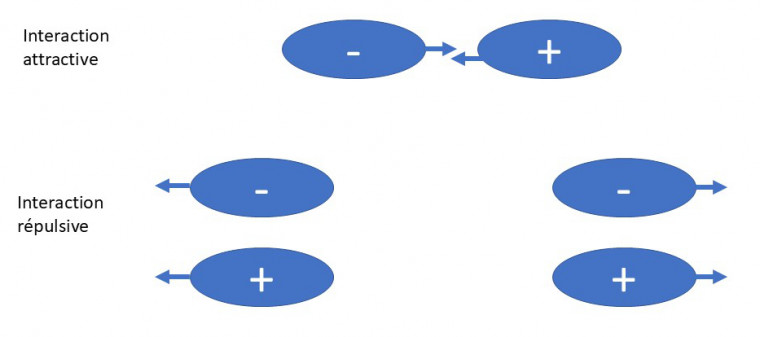
Une interaction électrostatique est une interaction s’établissant entre deux corps chargés (atomes ou molécules). Elle peut être attractive (- +) ou répulsive (-- ou ++, voir Figure 1).
Dans la suite de cet article, la majorité des interactions présentées sont attractives.
La liaison hydrogène
La liaison hydrogène est un cas particulier d’interaction électrostatique ayant une force intermédiaire entre l’interaction covalente et l’interaction de Van der Waals. Celle-ci est généralement de l’ordre de 10-25 kJ.mol-1 (5-6 kcal.mol-1). [5,6] Elle a été décrite pour la première fois par Hantzsch en 1915. [7,8]
Cette interaction a été définie en 2011 par l’International Union of Pure and Applied Chemistry (IUPAC) selon les termes suivants : « la liaison hydrogène est une interaction attractive entre un atome d’hydrogène d’une molécule ou d’un fragment moléculaire X-H où X est plus électronégatif que H, et un atome ou un groupe d’atomes [hautement électronégatif(s)] dans la même molécule ou une molécule différente, où il y a la preuve de la formation d’une liaison [non-covalente] ». [8,9]
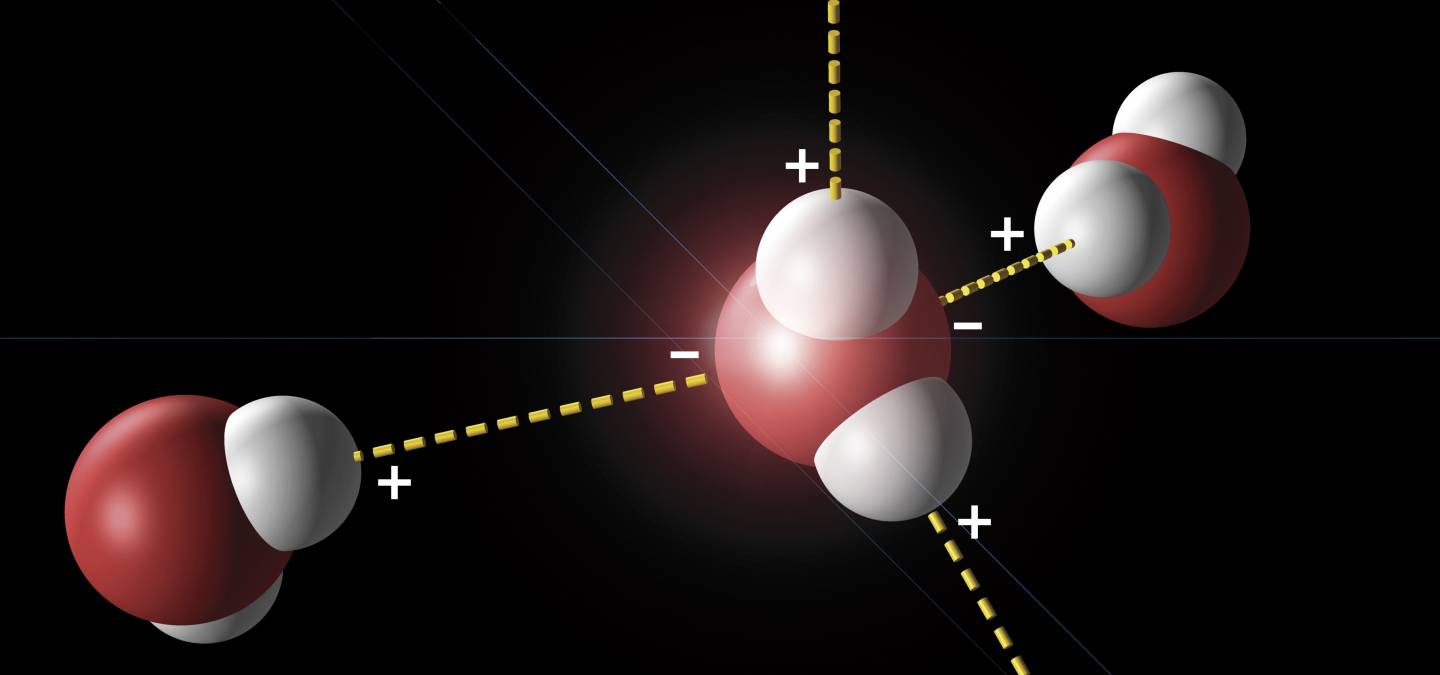
Cette liaison met donc en jeu une interaction entre un dipôle donneur formé d’un atome d’hydrogène porté par un atome électronégatif (X-H), et un dipôle accepteur porteur d’un atome électronégatif comme l’oxygène, l’azote ou encore les halogènes (Y, Figure 2). [10]
Seul le doublet non liant de Y participant à la liaison hydrogène est représenté explicitement.
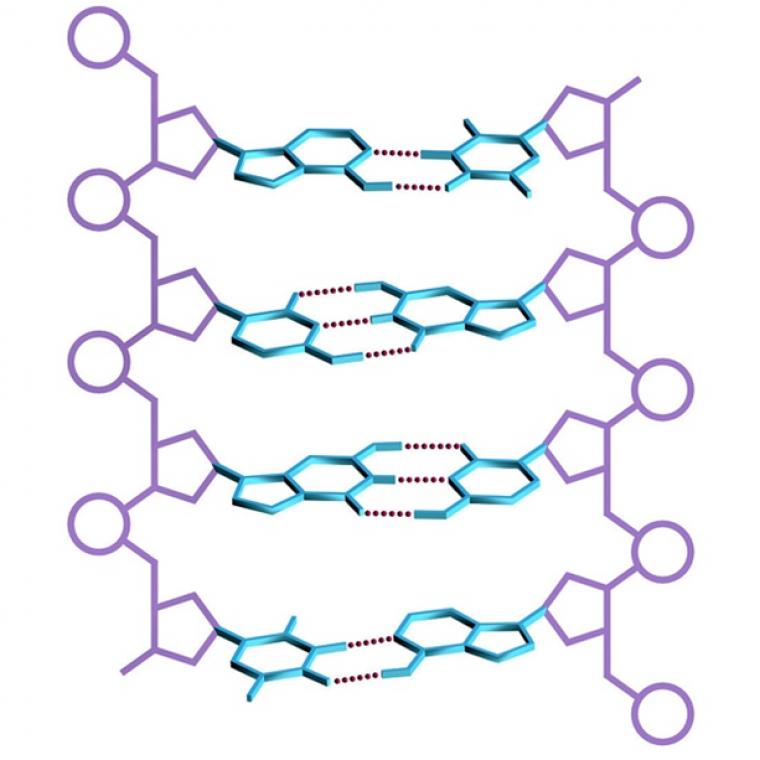
La liaison hydrogène régit plusieurs propriétés physiques de l’eau telles que sa tension de surface ou ses températures d’ébullition et de fusion élevées. De plus, elle est une composante primordiale de nombreuses structures supramoléculaires. Elle assure également la cohésion de structures vivantes telles que le bois ou la soie des araignées. [10] On la retrouve dans les sciences du vivant, dans lesquelles elle joue un rôle majeur dans le maintien de la structure tridimensionnelle des protéines ou de l’ADN (Figure 3).
Les entités sucre-phosphate sont représentées en violet, les bases thymine, adénine, guanine, cytosine en bleu et les liaisons hydrogène assurant la formation des paires de bases sont représentées en pointillés rouges.
Les atomes de carbone sont représentés en gris, ceux d’azote en bleu, ceux d’oxygène en rouge, celui de phosphore en orange et ceux d’hydrogène en blanc.
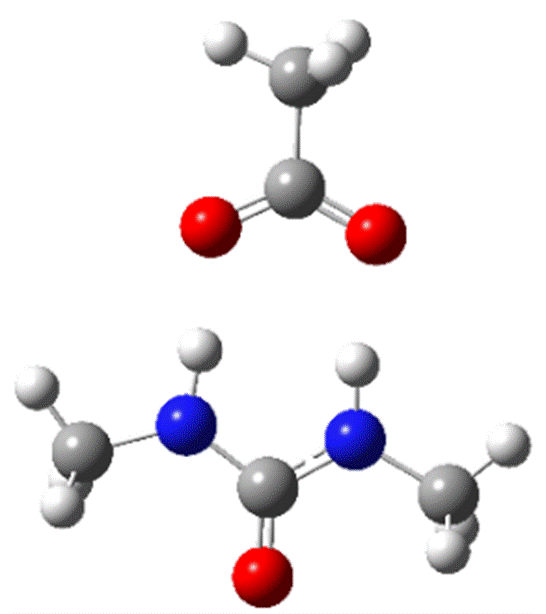
Depuis les années 1990, la liaison hydrogène est utilisée en chimie supramoléculaire pour la reconnaissance des anions. Ici, les premiers exemples de reconnaissance moléculaire des anions décrits par Wilcox et Hamilton ont été modélisés (Figures 4 et 5). [11,12]
Les atomes de carbone sont représentés en gris, ceux d’azote en bleu, ceux d’oxygène en rouge, celui de phosphore en orange et ceux d’hydrogène en blanc.
La liaison halogène
Les halogènes sont les éléments de la 17e colonne du tableau périodique : le fluor (F), le chlore (Cl), le brome (Br), l’iode (I), et de manière plus anecdotique, l’astate (At) et le tennesse (Ts). Au début du 19e siècle, un article proposé par J.J. Colin fait mention de complexes colorés entre une molécule de diiode (I2) et différentes substances contenant de l’ammoniaque (NH3). [14a]Par analogie avec la liaison hydrogène, la liaison halogène prend réellement son essor à partir des années 1950. Ainsi, en 1954, Hassel et coll. utilisent la diffraction aux rayons X pour résoudre la structure à l’état solide du complexe formé entre le 1,4-dioxane et le dibrome (Figure 6). [14b]
Les liaisons halogènes sont représentées en pointillés.
La liaison halogène est analogue à la liaison hydrogène en termes d’énergie d’interaction (10-30 kJ.mol-1). [15]
En 2013, cette interaction a été définie par l’IUPAC comme suit : « Une liaison halogène apparaît lorsqu’il y a une preuve d’une interaction attractive nette entre une région électrophile associée à un atome d’halogène dans une entité moléculaire et une région nucléophile sur une autre entité moléculaire, ou sur la même entité moléculaire ». [16]
Basée sur cette définition, une liaison halogène est donc décrite comme une interaction s’établissant entre un donneur de liaison halogène (R-Hal) où Hal est un atome d’halogène relié de manière covalente à un groupement R et Y est un accepteur de liaison halogène présentant une région nucléophile (Figure 7). Y peut donc être un anion ou une molécule portant au moins un site nucléophile. [17]
La force d’une liaison halogène dépend de la polarisabilité1 de l’atome d’halogène donneur. Lorsque la polarisabilité de l’halogène augmente (F < Cl < Br < I), la force de la liaison halogène augmente.
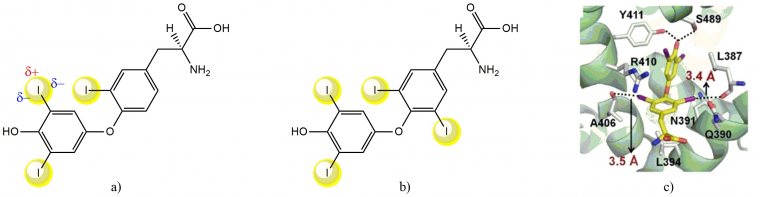
La présence et l’importance des liaisons halogènes dans les systèmes biologiques n'ont été mises en évidence que très récemment, car elles sont rares. Ainsi, on peut noter par exemple le rôle de ces interactions dans les hormones thyroïdiennes T3 (3,5,3’-triiodothyronine) et T4 (thyroxine, 3,5,3’,5’-tétraiodothyronine), contenant respectivement 3 et 4 atomes d’iode (Figures 8a et 8b). [17] Ainsi, les quatre atomes d’iode de l’hormone T4 (en jaune) peuvent interagir avec quatre sites récepteurs de la sérum-albumine humaine. [18a] L’hormone T4 est ainsi véhiculée dans l’organisme afin d’être convertie en T3, hormone régulant la majorité des processus physiologiques de l’organisme tels que la croissance biologique ou la température corporelle.
Les sites donneurs de liaisons halogènes sont matérialisés par des sphères jaunes. La position des charges partielles est illustrée sur un atome d’iode.
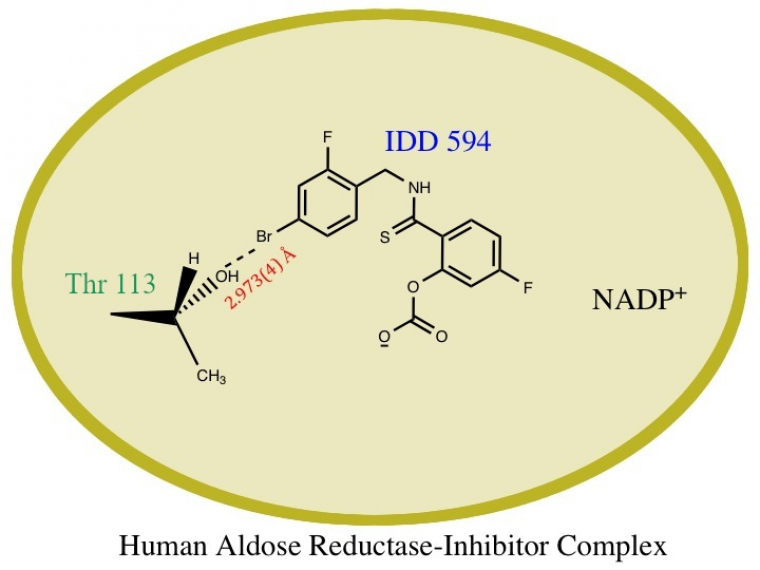
La liaison halogène est également responsable de l’inhibition de l’enzyme aldose réductase humaine en milieu biologique. [18b] Cette enzyme est impliquée dans la réduction des aldéhydes, des aldoses et des corticostéroïdes et met en jeu le couple NADP+/NADPH. La structure à l’état solide du complexe aldose réductase humaine-inhibiteur (IDD594), obtenue par diffraction des rayons X, montre la formation d’une liaison halogène entre l’atome de brome de l’inhibiteur et l’atome d’oxygène du résidu Thréonine 113 de l’enzyme (Figure 9).
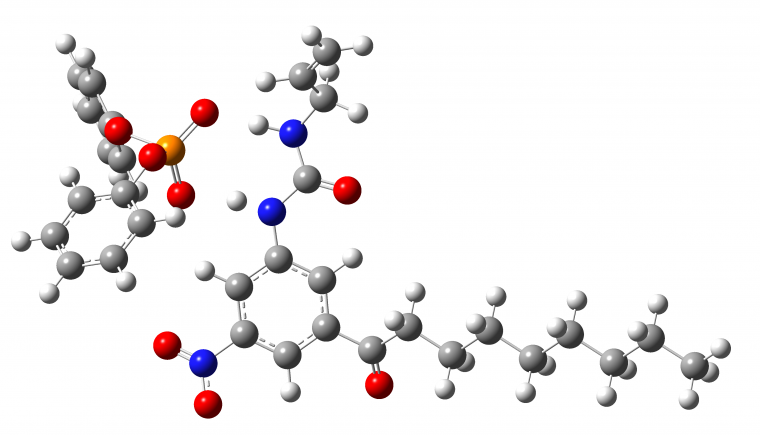
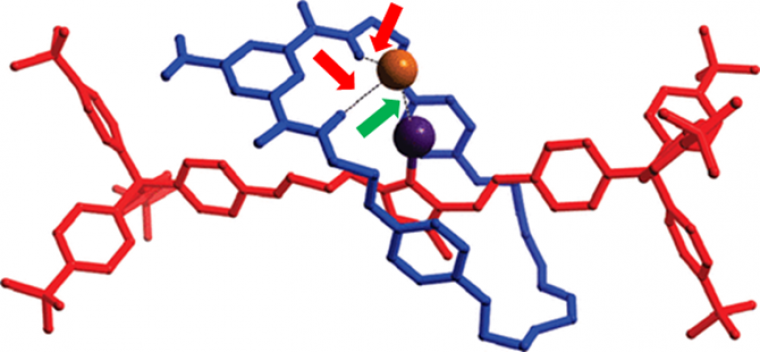
La liaison halogène est également utilisée en reconnaissance moléculaire des anions. Dans cet exemple, Beer et coll. s’intéressent à la reconnaissance moléculaire d’un anion chlorure à l’aide d’un rotaxane1 en combinant une liaison halogène C-Br…Cl- avec des liaisons hydrogène N-H…Cl-.
L'anion chlorure est représenté par une boule orange et l'atome de brome par une boule violette. La liaison halogène est indiquée par la flèche verte tandis que les liaisons hydrogène sont indiquées par des flèches rouges.
Bibliographie
[1] G. Cavallo, P. Metrangolo, T. Pilati, G. Resnati, G. Terraneo, Cryst. Growth Des. 2014, 14, 2697–2702.
[2] K. T. Mahmudov, M. N. Kopylovich, M. F. C. Guedes da Silva, A. J. L. Pombeiro, Coord. Chem. Rev. 2017, 345, 54–72.
[3] J. Beutier, “Les forces de Van der Waals et le Gecko,” peut être trouvé à l’adresse : https://culturesciences.chimie.ens.fr/thematiques/chimie-du-vivant/les-forces-de-van-der-waals-et-le-gecko, 2014.
[4] H. Li, H. Valkenier, A. G. Thorne, C. M. Dias, J. A. Cooper, M. Kieffer, N. Busschaert, P. A. Gale, D. N. Sheppard, A. P. Davis, Chem. Sci. 2019, 10, 9663–9672.
[5] P. Muller, Pure Appl. Chem. 1994, 66, 1077–1184.
[6] A. D. Mc Naught, A. Wilkinson, IUPAC 2012, 1670.
[7] A. Hantzsch, Berichte der Dtsch. Chem. Gesellschaft 1915, 48, 797–816.
[8] E. Arunan, G. R. Desiraju, R. A. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D. C. Clary, R. H. Crabtree, J. J. Dannenberg, P. Hobza, H. G. Kjaergaard, A. C. Legon, B. Mennucci, D. J. Nesbitt, Pure Appl. Chem. 2011, 83, 1619–1636.
[9] E. Arunan, G. R. Desiraju, R. A. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D. C. Clary, R. H. Crabtree, J. J. Dannenber, P. Hobza, H. G. Kjaergaard, A. C. Legon, B. Mennucci, D. J. Nesbitt, Pure Appl. Chem. 2011, 83, 1637–1641.
[10] R. H. Crabtree, in Encycl. Inorg. Chem., John Wiley & Sons, Ltd, Chichester, UK, 2006.
[11] P. J. Smith, M. V. Reddington, C. S. Wilcox, Tetrahedron Lett. 1992, 33, 6085–6088.
[12] E. Fan, S. A. Van Arman, S. Kincaid, A. D. Hamilton, J. Am. Chem. Soc. 1993, 115, 369–370.
[13] R. Plais, Interactions Pi-Anion et Liaisons Hydrogène: Un Outil Au Service de La Reconnaissance Moléculaire et de La Catalyse [Thèse de Doctorat], Université Paris Saclay, 2021.
[14] (a) J.-J. Colin, H. G. Gaultier de Claubry. Ann. Chim. 1814, 90, 87-100. (b) O. Hassel, J. Hvoslef, E. H. Vihovde, N. A. Sörensen, Acta Chem. Scand. 1954, 8, 873–873.
[15] R. Weiss, Étude En Solution Des Interactions Basées Sur Un Trou-Σ : Conception, Synthèse et Applications de Nouveaux Donneurs de Liaison Halogène et Chalcogène, Université de Strasbourg, 2021.
[16] G. R. Desiraju, P. Shing Ho, L. Kloo, A. C. Legon, R. Marquardt, P. Metrangolo, P. Politzer, G. Resnati, K. Rissanen, Pure Appl. Chem. 2013, 85, 1711–1713.
[17] G. Cavallo, P. Metrangolo, R. Milani, T. Pilati, A. Priimagi, G. Resnati, G. Terraneo, Chem. Rev. 2016, 116, 2478–2601.
[18] (a) S. Mondal, D. Giri, G. Mugesh, J. Indian Inst. Sci. 2020, 100, 231-247. (b) E. Parisini, P. Metrangolo, T. Pilati, G. Resnati, G. Terraneo, Chem. Soc. Rev., 2011, 40, 2267-2278.
[19] N. L. Kilah, M. D. Wise, C. J. Serpell, A. L. Thompson, N. G. White, K. E. Christensen, P. D. Beer, J. Am. Chem. Soc. 2010, 132, 11893–11895.
[20] C. B. Aakeroy, D. L. Bryce, G. R. Desiraju, A. Frontera, A. C. Legon, F. Nicotra, K. Rissanen, S. Scheiner, G. Terraneo, P. Metrangolo, G. Resnati, Pure Appl. Chem. 2019, 91, 1889–1892.
[21] G. Gouarin, Développement et Caractérisation de Récepteurs d’Anions et Leurs Applications Thérapeutiques Dans Les Canalopathies [Thèse d’exercice de Pharmacie], Université de Rouen Normandie, 2019.
[22] K. T. Mahmudov, M. N. Kopylovich, M. F. Guedes da Silva, A. J. L. Pombeiro, Dalton Trans. 2017, 46, 10121-10138.
[23] N. A. Semenov, A. V. Lonchakov, N. A. Pushkarevsky, E. A. Suturina, V. V. Korolev, E. Lork, V. G. Vasiliev, S. N. Konchenko, J. Beckmann, N. P. Gritsan, A. V. Zibarev, Organometallics 2014, 33, 4302–4314.
[24] A. Varadwaj, P. R. Varadwaj, H. M. Marques, K. Yamashita, Inorganics 2022, 10, 149.
[25] L. M. Lee, M. Tsemperouli, A. I. Poblador-Bahamonde, S. Benz, N. Sakai, K. Sugihara, S. Matile, J. Am. Chem. Soc. 2019, 141, 810–814.
[26] S. Moaven, J. Yu, M. Vega, D. K. Unruh, A. F. Cozzolino, Chem. Commun. 2018, 54, 8849–8852.
[27] S. Scheiner, Phys. Chem. Chem. Phys. 2021, 23, 5702–5717.
[28] D. Mani, E. Arunan, Phys. Chem. Chem. Phys. 2013, 15, 14377–14383.
[29] V. R. Mundlapati, D. K. Sahoo, S. Bhaumik, S. Jena, A. Chandrakar, H. S. Biswal, Angew. Chemie Int. Ed. 2018, 57, 16496–16500.
[30] X. García-Llinás, A. Bauzá, S. K. Seth, A. Frontera, J. Phys. Chem. A 2017, 121, 5371–5376.
[31] A. Bauzá, A. Frontera, Angew. Chemie Int. Ed. 2015, 54, 7340–7343.
[32] A. S. Novikov, D. S. Bolotin, J. Org. Chem. 2023, 88, 1936–1944.
[33] S. J. Grabowski, Coord. Chem. Rev. 2020, 407, 213171.
[34] A. Bauzá, I. Alkorta, J. Elguero, T. J. Mooibroek, A. Frontera, Angew. Chemie Int. Ed. 2020, 59, 17482–17487.
[35] G. Ciancaleoni, L. Rocchigiani, 2021, DOI 10.26434/chemrxiv.12936230.V5.
[36] P. Gamez, Inorg. Chem. Front. 2014, 1, 35–43.
[37] R. Plais, G. Clavier, J.-Y. Salpin, A. Gaucher, D. Prim, European J. Org. Chem. 2022, DOI 10.1002/ejoc.202201281.
[38] K. Hiraoka, S. Mizuse, S. Yamabe, J. Phys. Chem. 1987, 91, 5294–5297.
[39] S. Yamada, Chem. Rev. 2018, 118, 11353–11432.
[40] T. Chen, M. Li, J. Liu, Cryst. Growth Des. 2018, 18, 2765–2783.
[41] R. Plais, G. Gouarin, A. Bournier, O. Zayene, V. Mussard, F. Bourdreux, J. Marrot, A. Brosseau, A. Gaucher, G. Clavier, J.-Y. Salpin, D. Prim, ChemPhysChem 2022, e202200524.