Ce deuxième article du dossier intitulé Les interactions non covalentes au service du traitement des canalopathies fait suite au premier article, qui présentait la liaison hydrogène et la liaison halogène. Il dresse un portrait des interactions avec d'autres familles d'atomes
Le développement de l'étude des liaisons halogène a permis la découverte de plusieurs autres catégories d’interactions non covalentes entre des atomes électrodéficients et une base de Lewis, présentées ci-après.
La liaison chalcogène
La première est l’interaction chalcogène. Les chalcogènes sont les éléments chimiques de la 16e colonne du tableau périodique : l’oxygène (O), le soufre (S), le sélénium (Se), le tellure (Te), et, de manière plus anecdotique, le polonium (Po) et le Livermorium (Lv).
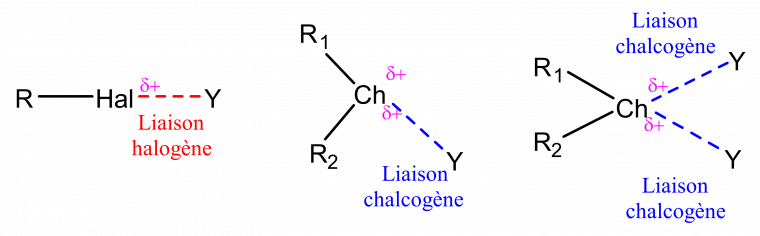
La liaison chalcogène est définie comme suit par l’IUPAC : « Une liaison chalcogène typique est symbolisée par trois points dans R-Ch…Y, où :
- Ch est un donneur de liaison chalcogène, pouvant être n’importe quel atome de chalcogène (possiblement hypervalent) ayant une région électrodéficiente ;
- R est le reste de l’entité moléculaire contenant le donneur de liaison chalcogène ;
- et Y est l’accepteur de liaison chalcogène et est typiquement une entité moléculaire possédant au moins une région électroniquement enrichie. »[20]
La liaison chalcogène est analogue à la liaison halogène, dans laquelle un chalcogène électrodéficient joue le rôle d’un acide de Lewis pour complexer un anion (Figure 1).[21] La formation d’une liaison chalcogène peut être souvent expliquée par la présence d’une ou plusieurs régions de potentiel électrostatique chargé positivement à la surface de l’atome de chalcogène. En effet, cette région de potentiel électrostatique positif est appelée « σ-hole ». La taille de ce « σ-hole » est liée à la taille du chalcogène considéré (O < S < Se < Te). En effet, plus la polarisabilité de l’atome de chalcogène augmente et plus l’électronégativité de cet atome diminue, plus l’établissement d’une liaison chalcogène est favorisé.[22]
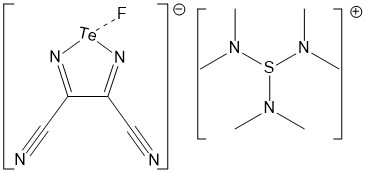
La liaison chalcogène est couramment utilisée en reconnaissance moléculaire. Ainsi, l’équipe de Bechmann, Gritsan et Zibarev a réussi à obtenir des cristaux mettant en évidence la liaison chalcogène entre différents anions et leurs donneurs de liaisons chalcogènes (Figure 3). [23]
L’utilisation d’une ESP pour ElectroStatic Potential Maps (« carte de potentiel électrostatique » en français) permet de visualiser la distribution de charges au sein d’une molécule. Ainsi, les parties bleutées sont chargées positivement tandis que les parties rougeâtres sont chargées négativement. Dans l’exemple ci-contre, l’atome de Tellure est chargé positivement au sein de la molécule. Par ailleurs, les atomes d’azote du nitrile et du diazole sont, de leur côté, chargés négativement (voir Figure 3b).
Sur la base de calculs de chimie quantique, on a montré que la force de la liaison chalcogène augmente avec [23] :
- la masse croissante du chalcogène (Te > Se > S) : en effet, plus la masse de l’atome de chalcogène augmente, plus cet atome sera chargé positivement
- la densité de charge croissante de l’anion (F- > Cl- > Br- > I-) : en effet, plus la densité de charge de l’anion augmente, plus celui-ci sera chargé négativement.
Les atomes de carbone sont représentés en noir, ceux d’azote en bleu foncé, celui de fluor en bleu clair, celui de tellure en orange et ceux d’hydrogène en blanc.
La liaison pnictogène
La seconde est la liaison pnictogène. Les atomes dits "pnictogènes" sont situés dans la 15e colonne du tableau périodique et regroupent l’azote (N), le phosphore (P), l’arsenic (As), l’antimoine (Sb), le bismuth (Bi), et, de manière plus anecdotique, le moscovium (Mc). Il est à noter que le terme pnictogène n'est à ce jour pas reconnu par l'IUPAC. Cependant, il est couramment employé dans la littérature scientifique.
La liaison pnictogène, similaire aux interactions précédemment décrites, est une liaison s’établissant entre une région électrodéficiente d’un atome de pnictogène et une espèce électrodonneuse ou chargée négativement (par exemple, un autre atome de pnictogène, un halogène, un chalcogène, une molécule aromatique…). Une définition de cette liaison a été proposée en 2022 comme suit : « Une liaison pnictogène apparaît lorsqu’il y a une preuve d’une interaction attractive nette entre une région électrophile associée à un atome pnictogène dans une entité moléculaire et une région nucléophile sur une autre, ou sur la même entité moléculaire ». [2,24]
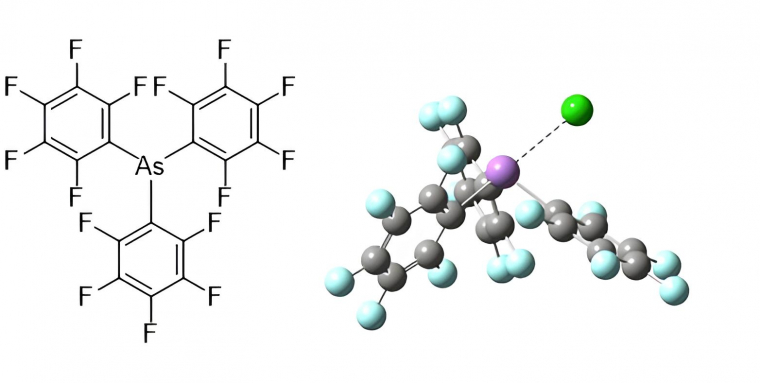
À l'instar des liaisons halogènes et chalcogènes, la liaison pnictogène a pu être mise à profit dans la reconnaissance d'anions. Ainsi l'équipe de Sugihara et Matile a synthétisé des transporteurs d'anions contenant un atome d'arsenic et plusieurs atomes d'antimoine, pouvant se lier à des ions chlorure ou nitrate (Figure 4). [25]
L’atome d’arsenic est représenté en violet, les atomes de carbone en gris, les atomes de fluor en bleu clair et l’ion chlorure en vert.
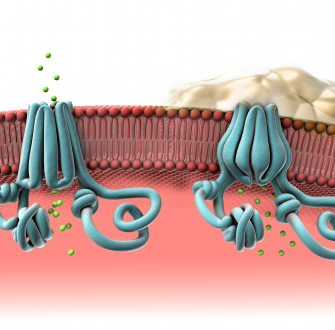
Un autre exemple d'application a été développé par l'équipe de Cozzolino, qui a mis à profit les liaisons pnictogène pour former des vésicules artificielles, dans l'objectif de mieux comprendre les membranes cellulaires. [26]
La liaison tétrel
La troisième interaction est la liaison tétrel, initialement appelée « liaison carbone ». Les éléments impliqués dans ce type de liaison sont ceux de la 14e colonne du tableau périodique : le carbone (C), le silicium (Si), le germanium (Ge), l'étain (Sn) et le plomb (Pb).
La liaison tétrel se définit comme une interaction attractive entre un atome tétrel accepteur d'électrons et une base de Lewis donneuse d'électrons. [27]
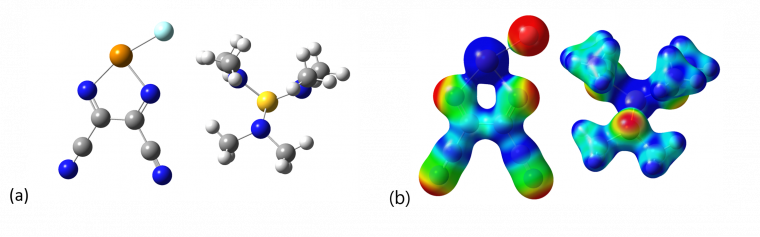
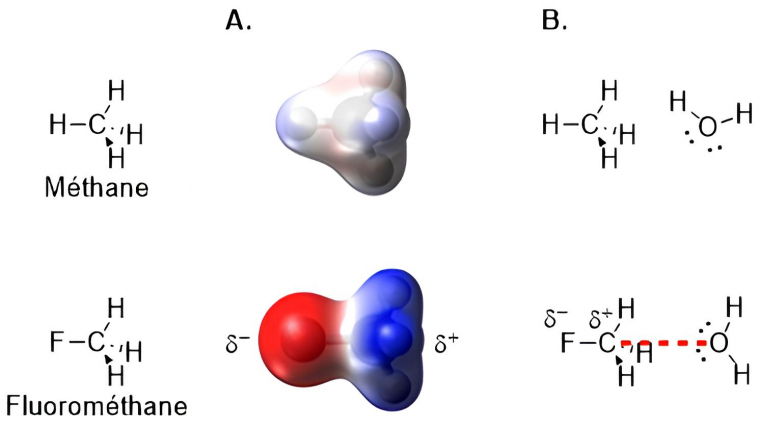
L'existence de cette interaction a été révélée très récemment, en 2013. [28] Le remplacement d'un atome d'hydrogène du méthane par un groupement électroattracteur (F ou OH) a permis de mettre en évidence l'existence d'une face chargée positivement dans la molécule de fluorométhane (Figure 5.A). Celle-ci peut alors interagir avec différents nucléophiles comme l'eau (Figure 5.B).
Depuis 10 ans, cette liaison a fait l'objet de nombreuses études, dont certaines ont permis de montrer son rôle dans les systèmes biologiques [29] et son utilisation potentielle dans le développement de nouveaux médicaments. [30]
Les liaisons aérogènes, icosagènes/triels et spodium
La découverte récente de cette diversité d’interactions a conduit à une grande activité de la communauté des chercheurs étudiant les interactions non covalentes. Au-delà des liaisons précédemment décrites, un certain nombre d'autres liaisons similaires ont été proposées, impliquant différents groupes du tableau périodique.
On peut citer :
- La liaison aérogène, concernant les gaz nobles et plus particulièrement le xénon (Xe) ; [31,32]
- La liaison icosagène/triel, qui implique les éléments de la 13e colonne du tableau périodique et inclut notamment le bore (B) ; [ 33]
- La liaison spodium, qui implique les éléments de la 12e colonne du tableau périodique, comme le zinc (Zn) ou le mercure (Hg). [ 34,35]
Si la plupart de ces modes de liaison ont été étudiés de manière théorique à l'aide notamment de la chimie computationnelle, relativement peu de résultats expérimentaux ont été publiés.
De plus, devant la multiplication des concepts, la communauté des chimistes doit aujourd'hui s'intéresser à des problématiques de nomenclatures et de classification. En effet, la plupart des noms mentionnés dans cet article font l'objet de débats et n'ont pas encore été validés par l'IUPAC. Une proposition de rassembler l'ensemble de ces interactions non-covalentes en une seule catégorie appelée « σ-hole interactions » a notamment été émise.
Bibliographie
[1] G. Cavallo, P. Metrangolo, T. Pilati, G. Resnati, G. Terraneo, Cryst. Growth Des. 2014, 14, 2697–2702.
[2] K. T. Mahmudov, M. N. Kopylovich, M. F. C. Guedes da Silva, A. J. L. Pombeiro, Coord. Chem. Rev. 2017, 345, 54–72.
[3] J. Beutier, “Les forces de Van der Waals et le Gecko,” peut être trouvé à l’adresse : https://culturesciences.chimie.ens.fr/thematiques/chimie-du-vivant/les-forces-de-van-der-waals-et-le-gecko, 2014.
[4] H. Li, H. Valkenier, A. G. Thorne, C. M. Dias, J. A. Cooper, M. Kieffer, N. Busschaert, P. A. Gale, D. N. Sheppard, A. P. Davis, Chem. Sci. 2019, 10, 9663–9672.
[5] P. Muller, Pure Appl. Chem. 1994, 66, 1077–1184.
[6] A. D. Mc Naught, A. Wilkinson, IUPAC 2012, 1670.
[7] A. Hantzsch, Berichte der Dtsch. Chem. Gesellschaft 1915, 48, 797–816.
[8] E. Arunan, G. R. Desiraju, R. A. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D. C. Clary, R. H. Crabtree, J. J. Dannenberg, P. Hobza, H. G. Kjaergaard, A. C. Legon, B. Mennucci, D. J. Nesbitt, Pure Appl. Chem. 2011, 83, 1619–1636.
[9] E. Arunan, G. R. Desiraju, R. A. Klein, J. Sadlej, S. Scheiner, I. Alkorta, D. C. Clary, R. H. Crabtree, J. J. Dannenber, P. Hobza, H. G. Kjaergaard, A. C. Legon, B. Mennucci, D. J. Nesbitt, Pure Appl. Chem. 2011, 83, 1637–1641.
[10] R. H. Crabtree, in Encycl. Inorg. Chem., John Wiley & Sons, Ltd, Chichester, UK, 2006.
[11] P. J. Smith, M. V. Reddington, C. S. Wilcox, Tetrahedron Lett. 1992, 33, 6085–6088.
[12] E. Fan, S. A. Van Arman, S. Kincaid, A. D. Hamilton, J. Am. Chem. Soc. 1993, 115, 369–370.
[13] R. Plais, Interactions Pi-Anion et Liaisons Hydrogène: Un Outil Au Service de La Reconnaissance Moléculaire et de La Catalyse [Thèse de Doctorat], Université Paris Saclay, 2021.
[14] (a) J.-J. Colin, H. G. Gaultier de Claubry. Ann. Chim. 1814, 90, 87-100. (b) O. Hassel, J. Hvoslef, E. H. Vihovde, N. A. Sörensen, Acta Chem. Scand. 1954, 8, 873–873.
[15] R. Weiss, Étude En Solution Des Interactions Basées Sur Un Trou-Σ : Conception, Synthèse et Applications de Nouveaux Donneurs de Liaison Halogène et Chalcogène, Université de Strasbourg, 2021.
[16] G. R. Desiraju, P. Shing Ho, L. Kloo, A. C. Legon, R. Marquardt, P. Metrangolo, P. Politzer, G. Resnati, K. Rissanen, Pure Appl. Chem. 2013, 85, 1711–1713.
[17] G. Cavallo, P. Metrangolo, R. Milani, T. Pilati, A. Priimagi, G. Resnati, G. Terraneo, Chem. Rev. 2016, 116, 2478–2601.
[18] (a) S. Mondal, D. Giri, G. Mugesh, J. Indian Inst. Sci. 2020, 100, 231-247. (b) E. Parisini, P. Metrangolo, T. Pilati, G. Resnati, G. Terraneo, Chem. Soc. Rev., 2011, 40, 2267-2278.
[19] N. L. Kilah, M. D. Wise, C. J. Serpell, A. L. Thompson, N. G. White, K. E. Christensen, P. D. Beer, J. Am. Chem. Soc. 2010, 132, 11893–11895.
[20] C. B. Aakeroy, D. L. Bryce, G. R. Desiraju, A. Frontera, A. C. Legon, F. Nicotra, K. Rissanen, S. Scheiner, G. Terraneo, P. Metrangolo, G. Resnati, Pure Appl. Chem. 2019, 91, 1889–1892.
[21] G. Gouarin, Développement et Caractérisation de Récepteurs d’Anions et Leurs Applications Thérapeutiques Dans Les Canalopathies [Thèse d’exercice de Pharmacie], Université de Rouen Normandie, 2019.
[22] K. T. Mahmudov, M. N. Kopylovich, M. F. Guedes da Silva, A. J. L. Pombeiro, Dalton Trans. 2017, 46, 10121-10138.
[23] N. A. Semenov, A. V. Lonchakov, N. A. Pushkarevsky, E. A. Suturina, V. V. Korolev, E. Lork, V. G. Vasiliev, S. N. Konchenko, J. Beckmann, N. P. Gritsan, A. V. Zibarev, Organometallics 2014, 33, 4302–4314.
[24] A. Varadwaj, P. R. Varadwaj, H. M. Marques, K. Yamashita, Inorganics 2022, 10, 149.
[25] L. M. Lee, M. Tsemperouli, A. I. Poblador-Bahamonde, S. Benz, N. Sakai, K. Sugihara, S. Matile, J. Am. Chem. Soc. 2019, 141, 810–814.
[26] S. Moaven, J. Yu, M. Vega, D. K. Unruh, A. F. Cozzolino, Chem. Commun. 2018, 54, 8849–8852.
[27] S. Scheiner, Phys. Chem. Chem. Phys. 2021, 23, 5702–5717.
[28] D. Mani, E. Arunan, Phys. Chem. Chem. Phys. 2013, 15, 14377–14383.
[29] V. R. Mundlapati, D. K. Sahoo, S. Bhaumik, S. Jena, A. Chandrakar, H. S. Biswal, Angew. Chemie Int. Ed. 2018, 57, 16496–16500.
[30] X. García-Llinás, A. Bauzá, S. K. Seth, A. Frontera, J. Phys. Chem. A 2017, 121, 5371–5376.
[31] A. Bauzá, A. Frontera, Angew. Chemie Int. Ed. 2015, 54, 7340–7343.
[32] A. S. Novikov, D. S. Bolotin, J. Org. Chem. 2023, 88, 1936–1944.
[33] S. J. Grabowski, Coord. Chem. Rev. 2020, 407, 213171.
[34] A. Bauzá, I. Alkorta, J. Elguero, T. J. Mooibroek, A. Frontera, Angew. Chemie Int. Ed. 2020, 59, 17482–17487.
[35] G. Ciancaleoni, L. Rocchigiani, 2021, DOI 10.26434/chemrxiv.12936230.V5.
[36] P. Gamez, Inorg. Chem. Front. 2014, 1, 35–43.
[37] R. Plais, G. Clavier, J.-Y. Salpin, A. Gaucher, D. Prim, European J. Org. Chem. 2022, DOI 10.1002/ejoc.202201281.
[38] K. Hiraoka, S. Mizuse, S. Yamabe, J. Phys. Chem. 1987, 91, 5294–5297.
[39] S. Yamada, Chem. Rev. 2018, 118, 11353–11432.
[40] T. Chen, M. Li, J. Liu, Cryst. Growth Des. 2018, 18, 2765–2783.
[41] R. Plais, G. Gouarin, A. Bournier, O. Zayene, V. Mussard, F. Bourdreux, J. Marrot, A. Brosseau, A. Gaucher, G. Clavier, J.-Y. Salpin, D. Prim, ChemPhysChem 2022, e202200524.