Cet article de didactique fait partie d'un dossier relatif au registre symbolique de la chimie. Cet article fait suite à celui présentant les spécificités du langage de la chimie et présente les difficultés d'apprentissage de celui-ci.
Le langage symbolique de la chimie peut sembler complètement « naturel » et d’une « apparente simplicité » (Bensaude-Vincent & Stengers, 1993). Pourtant de nombreux travaux en didactique ont révélé les difficultés rencontrées par les élèves dans son utilisation et son interprétation. Nous présentons dans ce paragraphe ce qui rend le langage de la chimie si particulier pour son apprentissage et les difficultés repérées chez les élèves au cours de cet apprentissage.
Les spécificités du langage symbolique pour son apprentissage
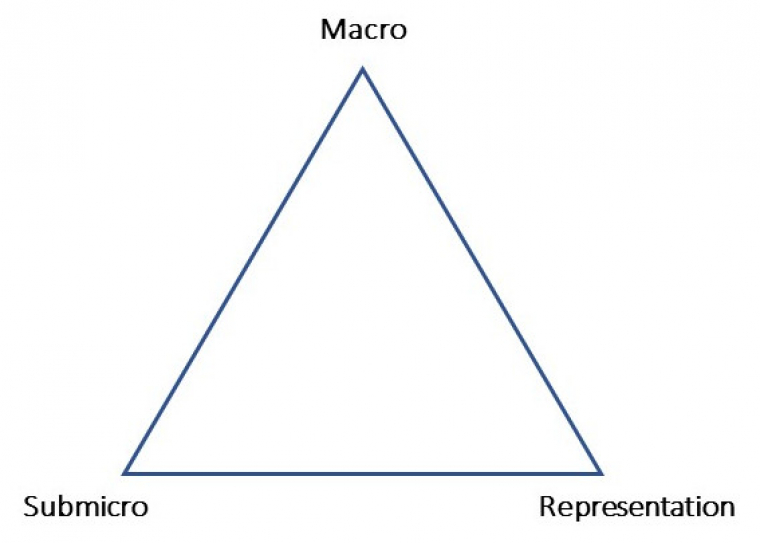
En didactique de la chimie, Johnstone (1993), en adoptant une approche qui se réfère à la psychologie cognitive, a été l’un des premiers à s’intéresser aux difficultés rencontrées par les étudiants en chimie face à un enseignant se déplaçant constamment entre le registre symbolique, les faits expérimentaux et leur interprétation en termes d'entités submicroscopiques. Ces trois aspects du savoir en chimie ont été portés aux sommets d’un triangle (Figure 1), dont Talanquer (2011) a souligné le rôle heuristique pour la recherche en didactique et l’enseignement durant les vingt-cinq dernières années. Les sommets « Macro » et « Submicro1 » (Figure 1) ne sont pas associés aux modèles mais à l’échelle du monde dans laquelle on se situe pour décrire le monde.
Source : Johnstone, A. H. (1993). The development of chemistry teaching: A changing response to changing demand. Journal of Chemical Education, 70(9), 701-705.
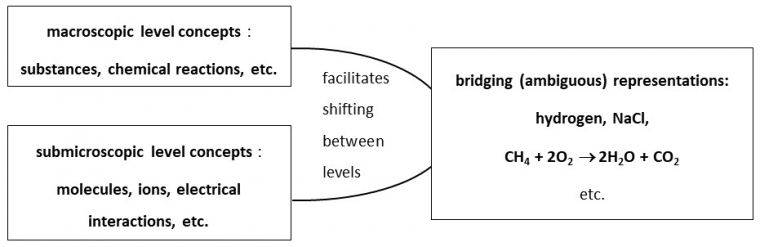
Taber (2013) considère que le domaine symbolique ne doit pas être vu comme un niveau discret des connaissances chimiques au même titre que les domaines macroscopiques et submicroscopiques. Dans le cas de la réaction chimique, il considère le langage du chimiste comme une passerelle qui facilite le déplacement entre le macroscopique (les espèces chimiques) et le submicroscopique (les entités) (Figure 2).
Source : Taber, K. S. (2013). Revisiting the chemistry triplet : drawing upon the nature of chemical knowledge and the psychology of learning to inform chemistry education. Chemistry Education Research and Practice, 14(2), 156‑168.
L’espèce chimique possède deux niveaux d’interprétation essentiels dans le travail autour de la réaction chimique : un macroscopique issu des « données manipulatoires et qui se résume à la carte d'identité d'une substance » et l’autre microscopique à partir des concepts d’atomes, de molécules et d’ions (Solomonidou & Stavridou, 1994, p. 86). Le langage symbolique utilisé dans l’écriture d’une équation de réaction permet cette double interprétation. Ce système de représentation unique favorise le travail du chimiste en lui permettant de travailler simultanément dans le niveau macroscopique et le niveau microscopique. Ce qui aurait pu être considéré comme une imprécision (un même registre de représentation pour plusieurs interprétations) est en fait une richesse. Mais cela peut très vite devenir une difficulté pour les élèves.
Difficultés des élèves repérées dans les recherches en didactique
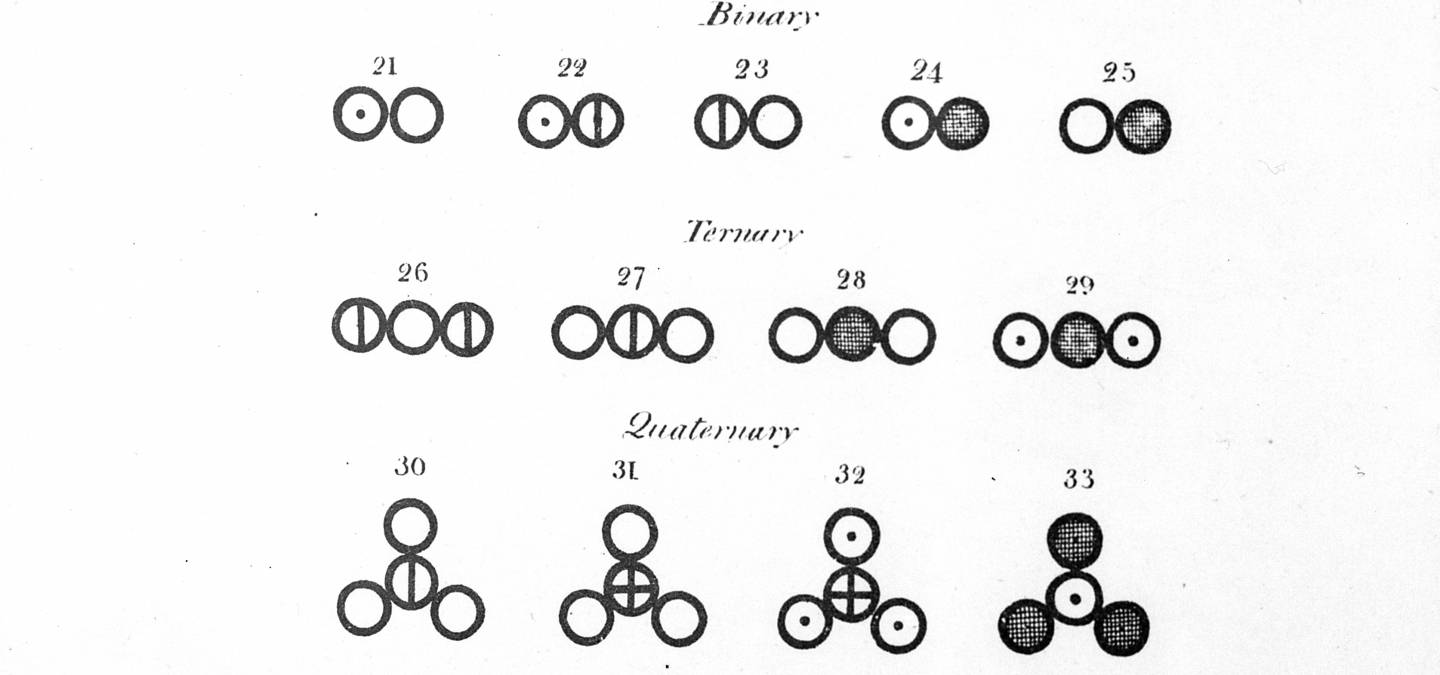
Marais et Jordaan (2000) montrent qu’avant de pouvoir répondre aux questions d’un problème portant sur la synthèse de l’ammoniac par le procédé Haber, il faudrait aux étudiants de première année au moins treize étapes d’interprétation de l’ensemble des symboles de l’équation donnée dans l’énoncé (Figure 3)1.
Source : Marais, P., & Jordaan, F. (2000). Are we taking symbolic language for granted? Journal of Chemical Education, 77(10), 1355.
« ils doivent :
- identifier les éléments (azote et hydrogène) et le composé (ammoniac) à partir des symboles donnés (formules) ;
- interpréter NH3 non pas comme une combinaison de N et H3, mais comme représentant le rapport dans lequel les atomes d'azote et les atomes d'hydrogène se combinent pour former l'ammoniac ;
- comprendre que les coefficients signifient qu'une molécule d'azote réagit avec trois molécules d'hydrogène pour former deux molécules d'ammoniac... ;
- comprendre qu'une mole (ou volume) d'azote réagit avec 3 moles (ou volumes) d'hydrogène pour former 2 moles (ou volumes) d'ammoniac ;
- interpréter le « + » dans l'équation comme signifiant « réagit avec »et non « s'ajoute à », comme en mathématiques ;
- interpréter une flèche comme signifiant « forment » ou « produisent » ;
- interpréter la double flèche comme signifiant que la réaction est réversible, c'est-à-dire que deux réactions (une réaction directe et une réaction inverse) ont lieu simultanément
- réaliser que les réactifs et les produits de cette réaction sont tous en phase gazeuse, c'est-à-dire qu'il s'agit d'un système d'équilibre homogène ;
- savoir que la flèche la plus longue à gauche indique qu'à l'équilibre, il y aura plus de réactifs que de produits, ce qui suggère une faible valeur pour Kc ;
- ne pas considérer les flèches de longueur inégale comme signifiant que la vitesse de la réaction inverse dépasse la vitesse de la réaction directe, c'est-à-dire que les flèches n'ont pas à être de longueur égale pour représenter l'équilibre ;
- savoir que ∆H fait référence au changement de la chaleur de la réaction, ou enthalpie ;
- interpréter la signification de ∆H < 0 comme signifiant une diminution de l'enthalpie du système ;
- savoir que ∆H < 0 fait référence à la réaction directe et que la réaction inverse est donc endothermique. » (Marais & Jordaan, 2000, p. 1355)
En chimie organique, Fensham (2002), reprenant les travaux de Johnstone et Kellett, indique que bon nombre d’élèves essaient de lire les formules de gauche à droite comme ils liraient habituellement. Mais les conventions symboliques en chimie organique présentent généralement le groupe fonctionnel, la plus importante partie de la formule, à l’extrémité droite de la formule. Avant d’arriver à la lecture de cette partie, l’élève est déjà en surcharge d’informations. L’enseignement de la chimie ne peut se passer de l’enseignement de son langage et cet apprentissage ne sera pas aisé pour les élèves. Pour illustrer ce propos, nous présentons dans ce paragraphe différents travaux en didactique montrant les difficultés rencontrées par les élèves dans la compréhension et l’utilisation des formules chimiques. Ces résultats sont issus de travaux provenant de pays anglo-saxons (Taskin et Bernholt (2014) ont réalisé une synthèse de ces recherches menées au cours des trente dernières années), de pays francophones, et d’une recherche que nous venons de mener récemment en France auprès de six cents élèves et étudiants, de la classe de quatrième à la première année de licence de chimie (Canac & Kermen, 2016 ; Canac, 2017).
Difficultés d’ordre syntaxique en lien avec des concepts mal maîtrisés
Les symboles chimiques dans la formule peuvent être compris comme une simple abréviation du nom de la substance (Al-Kunifed, Good, & Wandersee, 1993). Les élèves éprouvent des difficultés syntaxiques pour coder ou décoder les différents types de représentation. En raisonnant à partir des dessins des entités particulaires (Sanger, 2000 ; Stains & Talanquer, 2007) ou des formules chimiques (Fillon, 1997; Roletto & Piacenza, 1994) ou de la syntaxe des noms (Canac & Kermen, 2016), les élèves confondent corps composé et mélange. Jusqu’au niveau licence, ils peuvent considérer comme non identiques des formules telles que H2O, OH2 et HOH (Canac, 2017). Certaines formules chimiques amènent les élèves à avoir une interprétation autre qu’un assemblage d’atomes pour la molécule ; CH2O est par exemple considéré comme un carbone lié à de l’eau (Keig & Rubba, 1993). En cohérence avec ces difficultés syntaxiques, certaines équations peuvent amener les élèves à penser qu’un corps composé est un mélange de corps simples conservant leurs propriétés (Fillon, 1997; Furio, Bullejos, & de Manuel, 1994; Talanquer, 2007) comme dans « C+O2 » et « S+O2 ». Ils peuvent considérer que deux formules dont le nombre d’atomes est proportionnel, telles que SiO2 et Si2O4 (Keig & Rubba, 1993), sont équivalentes, et cela jusqu’à un niveau licence en France même dans des cas où les règles de valence ne sont plus respectées, comme par exemple CH4 et « C2H8 »1 (Canac & Kermen, 2016). L’interprétation des formules par les élèves ne correspond donc pas toujours au concept de molécule en tant que combinaison fixe et constante d’atomes, ce qu’ont déjà montré d’autres résultats (Al-Kunifed, Good & Wandersee, 1993 ; Ben-Zvi et al., 1987 ; Sanger, 2005).
Dans le cadre des réactions chimiques, les élèves éprouvent des difficultés pour appliquer les règles et conventions dans l’utilisation des formules brutes (Carretto & Viovy, 1994; Mzoughi-Khadhraoui & Dumon, 2012). Fillon (1997) montre que les élèves recherchent des effets de permutation par symétrie dans les formules pour interpréter la transformation chimique entre l’oxyde de cuivre et le carbone et propose l’équation : CuO + C → CO + Cu. Le symbolisme des équations peut amener une confusion avec l'équation mathématique (Barlet & Plouin, 1994). L’utilisation des formules brutes peut alors se rapporter à une simple manipulation arithmétique dans les équations chimiques (Nakhleh & Mitchell, 1993; Sanger, 2005), avec le risque de confusion entre les indices et les nombres stœchiométriques (Dehon & Snauwaert, 2015). Cela peut amener les élèves à choisir comme correctes des équations avec des formules incorrectes, telles que : H2 + O = H2O plutôt que 2H2 + O2 = 2H2O ou CH4 + 2O2 = CO2 + H4O2 plutôt que CH4 + 2O2 = CO2 + 2H2O (Canac & Kermen, 2016).
Difficultés pour changer de niveau d'interprétation
Dehon et Snauwaert (2015, p.229) proposent
« l’existence de trois niveaux de signification pour une visualisation donnée : un niveau de signification macroscopique dans lequel l’élève fait référence à l’observable via des observations empiriques ou via des concepts macroscopiques, un niveau de signification microscopique dans lequel l’élève fait référence aux entités constitutives de la matière et un niveau de signification symbolique dans lequel l’élève se limite par exemple à une lecture du signe en tant que signifiant ou en tant que signifié hors du cadre de la chimie ».
Pour illustrer ces propos, l’élève a au moins quatre interprétations possibles à partir du signifiant Si :
- macroscopique avec le silicium solide ;
- (sub)microscopique avec l’atome de silicium;
- la conjonction signifiant un conditionnel ;
- les deux initiales S et i.
Dehon et Snauwaert observent que les élèves ne semblent pas parvenir à passer d’un niveau de signification à l’autre.
En France, dans le cadre d’un questionnaire passé auprès de 603 élèves et étudiants, quand on demande à des élèves d’associer à des noms ou à des formules des critères macroscopiques, tels que corps pur ou mélange, ou microscopiques, tels que molécule ou atome (voir la question posée et les réponses correctes attendues en Annexe 1), très peu sont capables de donner des réponses correctes (Tableau 1) (Canac, 2017, p.124).
|
Formules proposées aux élèves
Groupe d’élèves ou d’étudiants |
C |
H2O |
O2 |
CO2 |
Fe |
C2H6O |
|---|---|---|---|---|---|---|
|
Collège (N = 233) |
13% |
6% |
15% |
5% |
7% |
2% |
|
Seconde (N = 178) |
29% |
8% |
15% |
3% |
25% |
2% |
|
Première et Terminale scientifique (N = 147) |
22% |
12% |
16% |
6% |
22% |
4% |
|
Licence (N = 45) |
49% |
16% |
33% |
4% |
36% |
7% |
Moins d’un tiers des élèves associent à la fois un critère macroscopique et un critère microscopique aux formules chimiques. Les élèves choisissent majoritairement uniquement des critères microscopiques (atome ou molécule). Il n’y a aucune évolution significative avec le niveau scolaire. Cette vision microscopique du nom ou de la formule chimique augmente avec le nombre d’années d’étude en chimie pour arriver à plus de 60 % en terminale scientifique (Canac & Kermen, 2016).
Nécessité d’un enseignement spécifique
Nous venons de présenter certaines difficultés repérées chez les élèves et les étudiants dans l’utilisation et l’interprétation du langage symbolique. Pour améliorer l’enseignement de la chimie, Barlet et Plouin (1994, p. 50) proposaient déjà de travailler autour de ses représentations « de façon à réduire les zones d'ombres et d'imprécisions et à permettre une meilleure appropriation des concepts utilisés ».
[…] dans cette discipline peut-être plus qu'ailleurs, le langage interagit fortement avec le concept, la moindre représentation de symboles renvoie à une représentation spatiale ou conceptuelle souvent décalée entre apprenants et enseignants. Le langage chimique véhicule un "déjà-là" conceptuel très fort par où peuvent pénétrer les ambiguïtés et se renforcer les conceptions.
En effet, peut-on maîtriser les concepts si le langage n’est pas présent ? Duval (1993, p. 39) a montré pour les mathématiques que les représentations sémiotiques sont essentielles « pour l’activité cognitive de la pensée ». L’appréhension conceptuelle d’un objet, la « noésis », est intimement liée à l’appréhension de sa représentation sémiotique, la « sémiosis » (Duval, 1993).
Le paradoxe cognitif de la pensée mathématique, et les difficultés qui en résultent pour son apprentissage tiennent au fait qu’il n’y a pas de noésis sans sémiosis alors qu’on veut enseigner les mathématiques comme si la sémiosis était une opération négligeable par rapport à la noésis.
Mais maîtriser le langage n’implique pas toujours de maîtriser les concepts. Un élève peut devenir assez compétent pour manipuler une équation chimique sans véritablement comprendre les concepts sous-jacents et les modèles associés (Talanquer, 2011). Que peut-il en effet comprendre de cette équation chimique s’il n'a pas une compréhension appropriée du concept scientifique d’espèce chimique et si l'imagerie mentale appropriée du modèle microscopique n’est pas disponible (Taber & Bricheno, 2009) ? Maîtriser le langage symbolique de la chimie passe donc aussi par l’apprentissage des concepts. Le novice ne maîtrise pas le langage parce que, outre qu’il ne connaît pas le symbolisme, il ne possède ni les connaissances théoriques implicites véhiculées par le symbolisme, ni le répertoire empirique suffisant qui sert de référent aux représentations symboliques (Taber, 2009).
Au plan psychologique, le développement des concepts s’effectue conjointement avec celui de la signification des mots (Vygotski, 1997) et, dans l’histoire de la chimie, langage symbolique, connaissances empiriques et modèles (macroscopiques et microscopiques) se sont développés de façon conjointe. Ne pas comprendre les subtilités du langage symbolique rend difficile l’apprentissage des idées. Ne pas comprendre les idées entraîne des interprétations erronées de ce qui est représenté à travers le langage.
The symbols are not just labels for words, but closely linked to concepts, which may themselves offer considerable challenge to learners.
« Les symboles ne sont pas seulement des étiquettes pour les mots, mais sont étroitement liés à des concepts qui peuvent eux-mêmes représenter un défi considérable pour les apprenants. »
Un schéma pour l’enseignement de la chimie
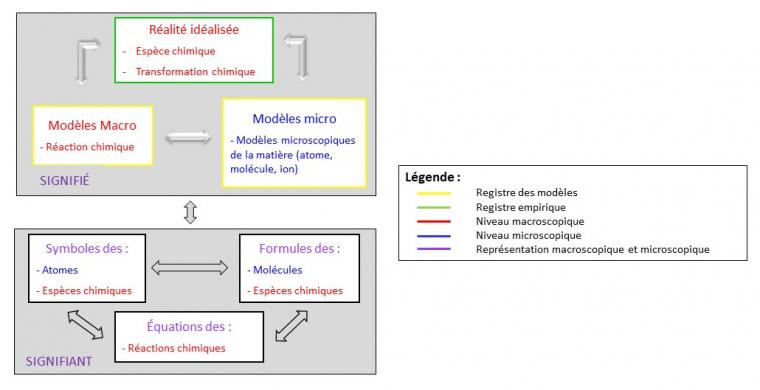
Nous avons essayé de représenter les allers retours nécessaires entre concepts et langage dans le cadre de l’apprentissage du modèle de la réaction chimique dans l’enseignement secondaire. Les concepts se définissent les uns par rapport aux autres (Fabre, 2005). Apprendre le concept de réaction chimique doit se faire en réseau avec ceux d’espèces chimiques, de transformation chimique, d’atomes, de molécules et d’ions. L’ensemble de ces concepts constitue le plan du « signifié » (Figure 4). Certains relèvent du registre empirique (cadre vert figure 4) – espèce chimique et transformation chimique –et d’autres du registre des modèles (cadre jaune figure 4) – réaction chimique, atome, ion, molécule. Il faut aussi distinguer les concepts macroscopiques (en bleu figure 4) – transformation chimique, espèce chimique et réaction chimique, des concepts microscopiques (en rouge figure 4) – atome, ion et molécule. Le registre empirique ne met en jeu que des concepts macroscopiques, Kermen considérant que l’on ne dispose pas de « faits empiriques atomico-moléculaires en milieu scolaire » (2018, p. 63). Ce n’est cependant pas le cas dans les modèles où il est nécessaire de distinguer ce qui relève du microscopique – les particules –, et du macroscopique – la réaction chimique – (Kermen & Méheut, 2009, 2011).
L’enseignement du langage symbolique – nom, symbole et formule – dans le plan du signifiant (Figure 4) nécessite de créer les liens avec les concepts du plan du signifié (Figure 6).Comme nous l’avons déjà signalé, le même langage représente à la fois des concepts du niveau macroscopique – espèce chimique, transformation chimique, réaction chimique (en rouge Figure 4) – et du niveau microscopique – atome, ion et molécule (en bleu Figure 4). Cette double signification du langage symbolique – niveaux macroscopique et microscopique – est illustrée en mauve (Figure 4).
Comme tout schéma, ce dernier est certainement incomplet et perfectible. Nous essayons avant tout de rendre compte de la complexité de l’apprentissage de la chimie qui se fait tout à la fois dans le registre empirique et dans le registre des modèles, à un niveau macroscopique et à un niveau microscopique. L’enseignement de la chimie ne peut-être que « multifactoriel » et doit se mener dans une « approche holistique et systémique fondée sur la diversité des interactions » (Barlet, 1999, p. 1433). Il doit proposer un apprentissage conjoint des concepts et du langage symbolique pour aider les élèves à se déplacer dans cette complexité. Pour cela, le développement de ressources didactiques permettant d’embrasser cette complexité nous semble nécessaire, et ce dès l’introduction du langage symbolique en cycle 4.
Bibliographie
- Al-Kunifed, A., Good, R., & Wandersee, J. (1993). Investigation of High School Chemistry Students’ Concepts of Chemical Symbol, Formula, and Equation: Students’ Prescientific Conceptions. Consulté à l’adresse http://www.eric.ed.gov/ERICWebPortal/recordDetail?accno=ED376020
- Bachelard, G. (2010). Le matérialisme rationnel (Édition : 4e édition). Paris : Presses Universitaires de France - PUF.
- Barlet, R. (1999). L’espace épistemologique et didactique de la chimie. Actualité Chimique, (223), 1423–1433.
- Barlet, R., & Plouin, D. (1994). L’équation-bilan en chimie un concept intégrateur source de difficultés persistantes. Aster, (18), 25-55.
- Ben-Zvi, R., Eylon, B., & Silberstein, J. (1987). Students’ visualization of a chemical reaction. Education in chemistry, 24(4), 117–120.
- Canac, S. (2017). Le langage symbolique de la chimie en tant que méta-niveau entre registre empirique et registre des modèles : une problématique de l’enseignement-apprentissage de chimie (Thèse de doctorat). Université Sorbonne Paris Cité.
- Canac, S., & Kermen, I. (2016). Exploring the mastery of French students in using basic notions of the language of chemistry. Chemistry Education Research and Practice, 17(3), 452‑473.
- Carretto, J., & Viovy, R. (1994). Relevé de quelques obstacles épistémologiques dans l’apprentissage du concept de réaction chimique. Aster, (18), 12-26.
- Dagognet, F. (2002). Tableaux et langages de la chimie : essai sur la représentation. Seyssel, France: Champ Vallon.
- Dehon, J., & Snauwaert, P. (2015). L’équation de réaction : une équation à plusieurs inconnues. Étude de productions d’élèves de 16-17 ans (grade 11) en Belgique francophone. RDST. Recherches en didactique des sciences et des technologies, (12), 209–235.
- Dumon, A., & Luft, R. (2008). Naissance de la chimie structurale. Les Ulis, France : EDP sciences.
- Duval, R. (1993). Registres de représentation sémiotique et fonctionnement cognitif de la pensée. Annales de didactique et de sciences cognitives, 5, 37–65.
- Edeline, F. (2009). Les fonctions sémiotique et heuristique des symboles chimiques : Ou de l’icône au symbole et retour. Protée, 37(3), 45‑56.
- Fabre, M. (2005). Deux sources de l’épistémologie des problèmes : Dewey et Bachelard. Les Sciences de l’éducation-Pour l’Ère nouvelle, 38(3), 53–67.
- Fensham, P. J. (2002). Implications, large and small, from chemical education research for the teaching of chemistry. Química nova, 25(2), 335–339.
- Fillon, P. (1997). Des élèves dans un labyrinthe d’obstacles. Aster, (25), 113‑141.
- Furio, C. J., Bullejos, J., & de Manuel, E. (1994). L’apprentissage de la réaction chimique comme activité de recherche. Aster, (18), 141-164.
- Jacob, C. (2001). Analysis and synthesis. Hyle: An International Journal for the Philosophy of Chemistry, 7, 31–50.
- Johnstone, A. H. (1993). The development of chemistry teaching: A changing response to changing demand. Journal of Chemical Education, 70(9), 701‑705.
- Kaya, E., & Erduran, S. (2013). Integrating Epistemological Perspectives on Chemistry in Chemical Education: The Cases of Concept Duality, Chemical Language, and Structural Explanations. Science & Education, 22(7), 1741‑1755.
- Keig, P. F., & Rubba, P. A. (1993). Translation of representations of the structure of matter and its relationship to reasoning, gender, spatial reasoning, and specific prior knowledge. Journal of Research in Science Teaching, 30(8), 883–903.
- Kermen, I. (2018). Enseigner l’évolution des systèmes chimiques au lycée Savoirs et modèles, raisonnements d’élèves, pratiques enseignantes. Rennes: Presses Universitaires de Rennes.
- Kermen, I., & Méheut, M. (2009). Different models used to interpret chemical changes: analysis of a curriculum and its impact on French students’ reasoning. Chemistry Education Research and Practice, 10(1), 24‑34.
- Kermen, I., & Méheut, M. (2011). Grade 12 French students’ use of a thermodynamic model for predicting the direction of incomplete chemical changes. International Journal of Science Education, 33(13), 1745–1773.
- Klein, U. (2001a). Berzelian Formulas as Paper Tools in Early Nineteenth-Century Chemistry. Foundations of Chemistry, 3(1), 7‑32.
- Klein, U. (2001b). Paper tools in experimental cultures. Studies in History and Philosophy of Science Part A, 32(2), 265‑302.
- Kluge, F. F., & Larder, D. F. (1971). AM Butlerov. On the chemical structure of substances. Journal of Chemical Education, 48(5), 289‑291.
- Laszlo, P. (1993). La Parole des choses ou le langage de la chimie. Paris: Editions Hermann.
- Laszlo, P. (2011). Towards Teaching Chemistry as a Language. Science & Education, 22(7), 1669‑1706.
- Laugier, A. (1998). Représentation de la réaction chimique dans les registres macroscopique et microscopique : contribution au repérage des obstacles épistémologiques. Une étude en classe de seconde. (Thèse de doctorat). Université de Pau.
- Le Maréchal, J.-F., & Cross, D. (2010). Difficultés d’apprentissage liées aux représentations en chimie. Le BUP physique chimie, 928, 1025–1035.
- Lecourt, D. (2002). L’épistémologie historique de Gaston Bachelard. Paris : Vrin.
- Marais, P., & Jordaan, F. (2000). Are we taking symbolic language for granted? Journal of Chemical Education, 77(10), 1355.
- Mounin, G. (1981). A Semiology of the Sign System Chemistry. Diogenes, 29(113‑114), 216‑228.
- Mzoughi-Khadhraoui, I., & Dumon, A. (2012). L’appropriation par des élèves tunisiens débutants du langage permettant de représenter la réaction chimique. Recherches en didactique des sciences et des technologies, (6), 89‑118.
- Nakhleh, M. B., & Mitchell, R. C. (1993). Concept learning versus problem solving: There is a difference. Journal of Chemical Education, 70(3), 190‑192.
- Roletto, E., & Piacenza, B. (1994). Faut-il construire le concept de substance? Aster, (18), 63‑74.
- Sanger, M. J. (2000). Using particulate drawings to determine and improve students’ conceptions of pure substance and mixtures. Journal of Chemical Education, 77(6), 762‑766.
- Sanger, M. J. (2005). Evaluating students’ conceptual understanding of balanced equations and stoichiometric ratios using a particulate drawing. Journal of Chemical Education, 82(1), 131‑134.
- Sliwka, H.-R. (2003). Reform of Chemical Language as a Model for Spelling Reform. Journal of the Simplified Spelling Society, (32), 24–28.
- Solomonidou, C., & Stavridou, H. (1994). Les transformations des substances, enjeu de l’enseignement de la réaction chimique. Aster, 75‑95.
- Stains, M., & Talanquer, V. (2007). Classification of chemical substances using particulate representations of matter: An analysis of student thinking. International Journal of Science Education, 29(5), 643–661.
- Taber, K. S. (2009). Learning at the Symbolic Level. In J. K. Gilbert & D. Treagust (Éd.), Multiple Representations in Chemical Education (Vol. 4, p. 75‑105). Dordrecht: Springer Netherlands.
- Taber, K. S. (2013). Revisiting the chemistry triplet: drawing upon the nature of chemical knowledge and the psychology of learning to inform chemistry education. Chemistry Education Research and Practice, 14(2), 156‑168.
- Taber, K. S., & Bricheno, P. (2009). Coordinating Procedural and Conceptual Knowledge to Make Sense of Word Equations: Understanding the complexity of a ‘simple’ completion task at the learner’s resolution. International Journal of Science Education, 31(15), 2021‑2055.
- Talanquer, V. (2007). Explanations and teleology in chemistry education. International Journal of Science Education, 29(7), 853–870.
- Talanquer, V. (2011). Macro, Submicro, and Symbolic: The many faces of the chemistry “triplet”. International Journal of Science Education, 33(2), 179‑195.
- Taskin, V., & Bernholt, S. (2014). Students’ Understanding of Chemical Formulae: A review of empirical research. International Journal of Science Education, 36(1), 157‑185.
- Vygotski, L. S. (1997). Pensée et langage/Suivi de Commentaire sur les remarques critiques de Vygotski/de Jean Piaget (F. Sève, Trans. 3e éd. trad. revue ed.). Paris: La dispute.
- Weininger, S. J. (1998). Contemplating the finger: Visuality and the Semiotics of Chemistry. HYLE–International Journal for Philosophy of Chemistry, 4(1), 3–27.
- Wunderli, P. (2016). Ferdinand de Saussure : le signe. In Louis Hébert (dir.), Signo [en ligne]. Rimouski (Québec). Consulté à l’adresse http://www.signosemio.com/saussure/signe.pdf