Le deuxième article du dossier « Nanomatériaux et leurs applications en thérapie cancéreuse » aborde le sujet des "organes sur puce" et "cancers sur puce". Des exemples concernant l'étude du cancer du poumon, cancer de la prostate et cancer du sein sont proposés.
Le lecteur est invité à consulter au préalable le premier article du dossier, intitulé « Nanomédicaments contre le cancer ».
Développement des cancers sur puce
Les modèles précliniques reproduisant fidèlement le micro-environnement tumoral sont une des clés qui permettraient de faire de grandes avancées dans la compréhension des événements physiopathologiques complexes qui s’y déroulent [12].
En effet, les modèles actuels en cancérologie dépendent largement de la culture cellulaire en deux dimensions (2D) [13]. Or, ceux-ci sont loin de refléter la complexité des tumeurs observées in vivo [14]. D’un autre côté, les modèles animaux, encore largement utilisés en cancérologie, sont également mis en cause en raison des problèmes translationnels et éthiques qu’ils soulèvent [15].
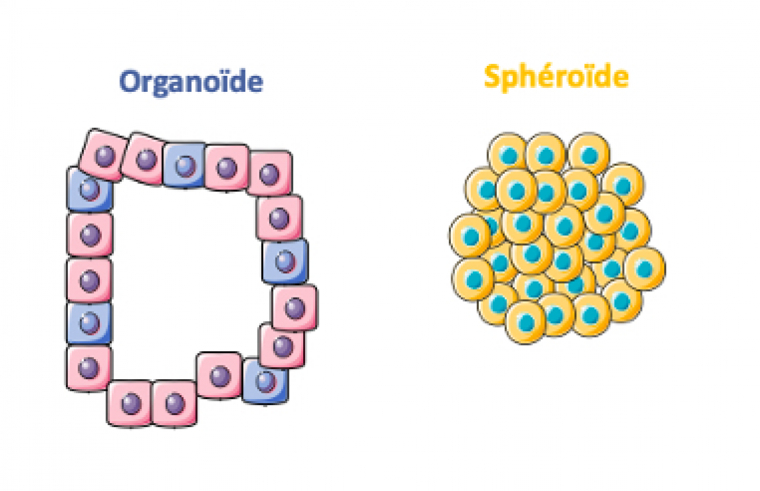
Pour contourner ces problèmes et obtenir des résultats plus fiables aux premiers stades du développement des médicaments, les chercheurs élaborent de nouveaux modèles précliniques capables de mieux simuler les processus physiologiques et physiopathologiques qui se déroulent dans le corps humain. Les approches de culture cellulaire tridimensionnelle (3D) sont des outils prometteurs pour atteindre cet objectif, en raison de leur capacité à mieux simuler les interactions cellule-cellule et cellule-matrice que les modèles 2D classiques [16]. Ainsi, de nombreux modèles basés sur la technologie 3D ont été rapportés [17] tels que les sphéroïdes et organoïdes [18] (Figure 1). Ces structures imitent les gradients d'oxygène et de nutriments rencontrés dans les tissus humains mais ne prennent pas en compte les conditions dynamiques in vivo telles que le flux sanguin ou les mouvements respiratoires.
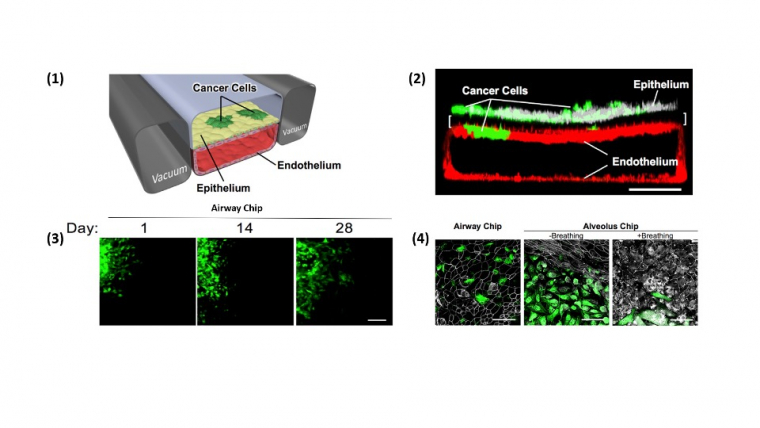
Une autre étape a été franchie avec l'adaptation de la technologie microfluidique [19] pour créer des systèmes microphysiologiques reproduisant les principaux phénomènes dynamiques du corps humain [20]. Les systèmes dits d'organes sur puce (OOC pour Organ On Chip) ont été adaptés pour simuler une grande variété d'organes et de maladies, y compris le cancer, ce qui a donné naissance au concept de « cancer sur puce » (COC pour Cancer On Chip) [21–25] (Figure 2). De nombreuses applications de ces technologies innovantes ont été décrites dans la littérature, mais plusieurs défis restent à relever avant que ces modèles ne soient utilisés en routine pour le développement de nouveaux médicaments.
Applications de la microfluidique pour l'étude du cancer : le concept de cancer sur puce
Le cancer est un processus très complexe qui évolue sur des années ou des décennies et qui fait intervenir divers facteurs exogènes et endogènes [26].
Par rapport à la culture cellulaire classique en 2D, l'introduction de la technologie microfluidique pour la modélisation du cancer a permis d'atteindre un niveau de complexité plus élevé en créant des systèmes in vitro qui imitent mieux la diversité du micro-environnement tumoral. Cette technologie permet d'associer différents types de cellules dans un dispositif unique avec une architecture contrôlée en 3D. Plus important encore, les systèmes microfluidiques peuvent être utilisés pour reproduire les signaux chimiques et mécaniques in vivo qui peuvent influencer le comportement de la tumeur.
Pour ces raisons, les systèmes microfluidiques sont de plus en plus utilisés dans la recherche en cancérologie [27] et leurs applications peuvent être catégorisées selon trois grand buts :
- Améliorer notre compréhension des processus physiopathologiques impliqués dans le cancer et de leurs implications thérapeutiques éventuelles (interactions des cellules cancéreuses avec les éléments du micro-environnement [28–38]) ;
- Évaluer l’efficacité des médicaments anticancéreux [39–41] ;
- Mettre en place ou améliorer les applications de diagnostic ou de pronostic [42–46].
Par la suite seront présentés des exemples d’applications de la microfluidique pour l’étude du cancer, notamment le cancer du poumon, de la prostate, et du sein.
Le cancer du poumon
En plus d’être le cancer le plus mortel [2], le cancer du poumon est probablement l'un des meilleurs exemples pour illustrer l'intérêt d'utiliser des dispositifs microfluidiques de tumeur sur puce. Les modèles de poumon microfluidique (poumon sur puce) ont permis d’étudier une variété d'aspects physiopathologiques du cancer du poumon (Figure 2). Par exemple, Hassel et al. ont utilisé des modèles microfluidiques de l'alvéole pulmonaire et des petites voies aériennes pour étudier la croissance et les réponses aux médicaments du cancer du poumon [47]. Cette étude a démontré que l'application de contraintes mécaniques à travers les canaux latéraux creux du modèle d'alvéole microfluidique affectait le comportement des cellules cancéreuses. Ces mouvements sont semblables à ceux d'une respiration. Ceci permet d’illustrer l’importance d’utiliser un modèle microfluidique dans ce genre d’études.
En outre, Xu et al. ont développé un dispositif microfluidique multi-organes pour simuler les métastases du cancer du poumon dans différents organes, notamment le cerveau, le foie et les os.
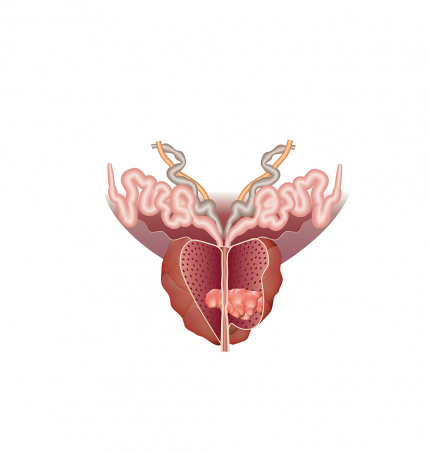
Le cancer de la prostate
La prostate est une glande de l’appareil génital masculin, qui joue un rôle dans la production du sperme.
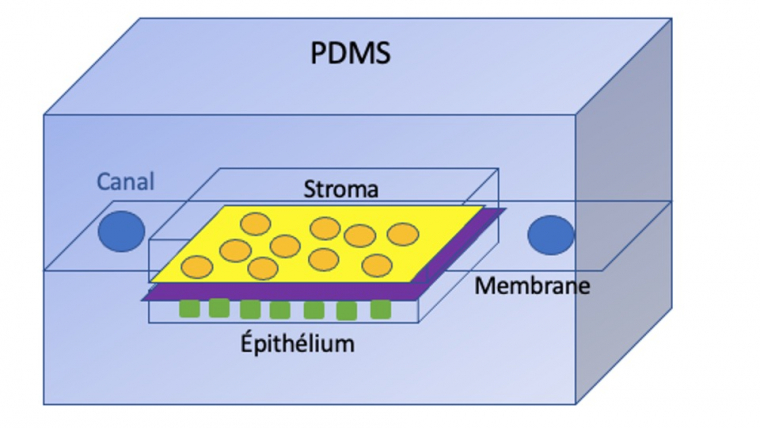
En 2019, Jiang et al. ont décrit un modèle simple de prostate sur puce qui reproduisait l'interface stroma-épithélial [49]. Ce dispositif (Figure 4) est constitué de deux canaux superposés en PDMS (pour polydiméthylsiloxane) séparés par une membrane microporeuse en polyester, ce qui a permis une communication paracrine1 entre les cellules cancéreuses et les cellules du stroma tout en empêchant un contact direct entre les deux types de cellules afin d'étudier les voies de signalisation biochimique dans l'interface stroma-épithélial2. La communication biochimique entre les cellules épithéliales, stromales et cancéreuses est un facteur clé de la physiopathologie du cancer de la prostate.
Le cancer du sein
Cliché de mammographie mis en couleur
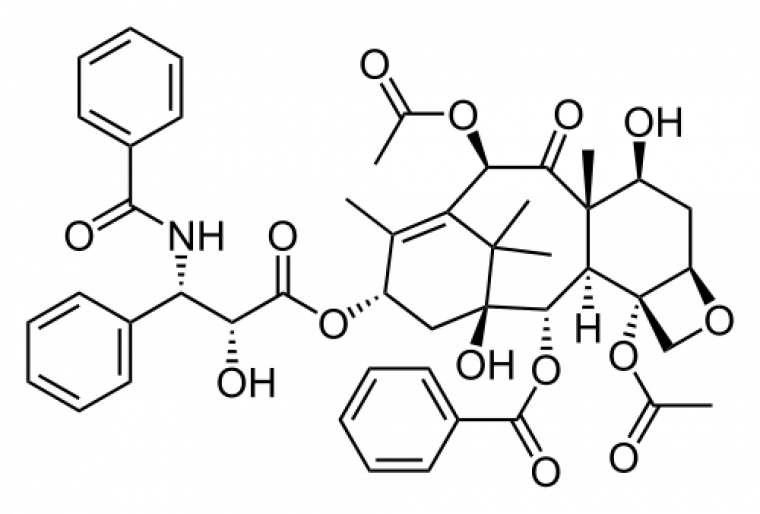
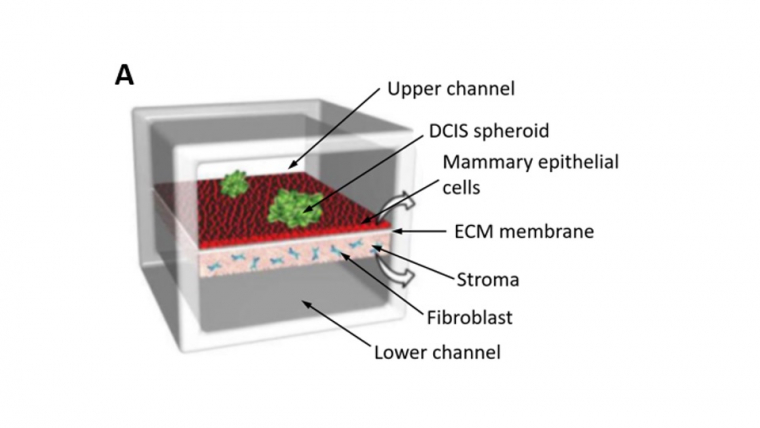
Le développement du cancer du sein est un processus à long terme et très complexe. En général, le développement de la lésion cancéreuse est précédé de la formation d’une lésion non invasive [50]. En fonction de plusieurs facteurs intrinsèques et extrinsèques, cette lésion non invasive peut évoluer vers une forme invasive [51-52]. Il est donc crucial de comprendre cette transition d'une forme localisée à une forme invasive. À cet égard, Choi et al. ont décrit un modèle microfluidique [50] composé de deux chambres de culture superposées (Figure 7) simulant la lumière du canal et le capillaire vasculaire stromal, séparés par une fine membrane. Ce modèle microfluidique a ensuite été utilisé pour évaluer l'efficacité et la toxicité d'un médicament anticancéreux (Paclitaxel) (Figure 6) qui a été injecté dans la chambre inférieure (capillaire) pour imiter l'administration intraveineuse.
Modèle de cancer du sein de stade précoce : la surface supérieure contient des cellules épithéliales et la surface inférieure un hydrogel de matrice extracellulaire contenant des fibroblastes. [54]
Défis et perspectives d'avenir des modèles précliniques microfluidiques
Bien que l'utilisation de la technologie microfluidique pour la modélisation du cancer ait considérablement progressé, des efforts supplémentaires doivent être entrepris, non seulement pour créer des modèles plus complets, mais aussi pour promouvoir son application dans la production industrielle. Trois grands domaines de recherche peuvent donc être indiqués :
- identifier et résoudre les problèmes liés à la fabrication et à la manipulation des dispositifs microfluidiques ;
- aborder les questions biologiques liées aux modèles de cancer sur puce ;
- et accélérer le passage de la recherche aux applications.
Des défis particuliers se présentent au niveau de la fabrication, où il s’agirait de développer des méthodes faciles à mettre en œuvre à grande échelle tout en conservant une bonne précision de fabrication. De plus, des avancées peuvent être envisagées concernant les matériaux ou encore le matériel de laboratoire à utiliser pour les perfusions sur les dispositifs microfluidiques [25].
Pour ce qui est des défis biologiques, le but serait le développement d’un dispositif "cancer sur puce" qui présente une complexité biologique en même temps qu’une flexibilité permettant de tester plusieurs molécules et concentrations thérapeutiques simultanément.
En outre, afin de permettre que les modèles basés sur la microfluidique trouvent des applications tangibles dans l’industrie, l’une des meilleures façons d'accélérer le développement de la technologie OOC est d'intensifier la collaboration entre les laboratoires de recherche et les entreprises pharmaceutiques. De plus, au-delà de l'industrie, la technologie OOC trouve également des applications intéressantes dans la pratique médicale quotidienne, notamment à des fins de médecine personnalisée dans le traitement du cancer. Les OOC constitués de cellules cancéreuses spécifiques du patient peuvent être utiles pour évaluer les protocoles thérapeutiques afin d'optimiser leur efficacité et de réduire leurs effets secondaires avant leur administration au patient [55].
Conclusion
Pour conclure, l’avènement de la nanomédecine a permis de développer des systèmes nanoparticulaires intelligents. Leur efficacité thérapeutique, qui ne cesse de progresser, est très prometteuse. Parallèlement à cela, les modèles précliniques innovants basés sur la culture cellulaire 3D et la technologie microfluidique apparaissent comme une alternative pertinente aux modèles cellulaires 2D dont la fiabilité a été remise en cause par le taux d'échec élevé des nouvelles molécules anticancéreuses. De nombreux efforts de recherche sont entrepris pour développer ces modèles, mais un travail plus collaboratif est nécessaire afin de surmonter les défis technologiques actuels et d'accélérer la mise en œuvre à plus grande échelle de ces nouveaux modèles précliniques in vitro. Ainsi, en combinant l’ensemble de ces technologies et en faisant collaborer chercheurs, médecins et pharmaciens, de grandes avancées seront possibles dans la lutte contre cette maladie encore trop difficile à combattre.
Références
[1] DeVita, V. T., Jr.; Chu, E. A History of Cancer Chemotherapy. Cancer Res. 2008, 68 (21), 8643–8653. https://doi.org/10.1158/0008-5472.CAN-07-6611.
[2] Sung, H.; Ferlay, J.; Siegel, R. L.; Laversanne, M.; Soerjomataram, I.; Jemal, A.; Bray, F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA. Cancer J. Clin. 2021, 71 (3), 209–249. https://doi.org/10.3322/caac.21660.
[3] WHO outlines steps to save 7 million lives from cancer. https://www.who.int/news/item/04-02-2020-who-outlines-steps-to-save-7-million-lives-from-cancer (accessed 2021-05-10).
[4] Katz, M. H. G.; Francescatti, A. B.; Hunt, K. K.; Cancer Surgery Standards Program of the American College of Surgeons. Technical Standards for Cancer Surgery: Commission on Cancer Standards 5.3–5.8. Ann. Surg. Oncol. 2022. https://doi.org/10.1245/s10434-022-11375-w.
[5] Mieog, J. S. D.; Achterberg, F. B.; Zlitni, A.; Hutteman, M.; Burggraaf, J.; Swijnenburg, R.-J.; Gioux, S.; Vahrmeijer, A. L. Fundamentals and Developments in Fluorescence-Guided Cancer Surgery. Nat. Rev. Clin. Oncol. 2022, 19 (1), 9–22. https://doi.org/10.1038/s41571-021-00548-3.
[6] Petroni, G.; Cantley, L. C.; Santambrogio, L.; Formenti, S. C.; Galluzzi, L. Radiotherapy as a Tool to Elicit Clinically Actionable Signalling Pathways in Cancer. Nat. Rev. Clin. Oncol. 2022, 19 (2), 114–131. https://doi.org/10.1038/s41571-021-00579-w.
[7] Gong, N.; Sheppard, N. C.; Billingsley, M. M.; June, C. H.; Mitchell, M. J. Nanomaterials for T-Cell Cancer Immunotherapy. Nat. Nanotechnol. 2021, 16 (1), 25–36. https://doi.org/10.1038/s41565-020-00822-y.
[8] Behranvand, N.; Nasri, F.; Zolfaghari Emameh, R.; Khani, P.; Hosseini, A.; Garssen, J.; Falak, R. Chemotherapy: A Double-Edged Sword in Cancer Treatment. Cancer Immunol. Immunother. 2022, 71 (3), 507–526. https://doi.org/10.1007/s00262-021-03013-3.
[9] Wolfram, J.; Ferrari, M. Clinical Cancer Nanomedicine. Nano Today 2019, 25, 85–98. https://doi.org/10.1016/j.nantod.2019.02.005.
[10] De la molécule au médicament. CultureSciences-Chimie. https://culturesciences.chimie.ens.fr/thematiques/chimie-organique/chimie-pharmaceutique/de-la-molecule-au-medicament (accessed 2022-10-14).
[11] Maeda, H.; Khatami, M. Analyses of Repeated Failures in Cancer Therapy for Solid Tumors: Poor Tumor-Selective Drug Delivery, Low Therapeutic Efficacy and Unsustainable Costs. Clin. Transl. Med. 2018, 7 (1), 11. https://doi.org/10.1186/s40169-018-0185-6.
[12] Xu, H.; Lyu, X.; Yi, M.; Zhao, W.; Song, Y.; Wu, K. Organoid Technology and Applications in Cancer Research. J. Hematol. Oncol.J Hematol Oncol 2018, 11. https://doi.org/10.1186/s13045-018-0662-9.
[13] Kapałczyńska, M.; Kolenda, T.; Przybyła, W.; Zajączkowska, M.; Teresiak, A.; Filas, V.; Ibbs, M.; Bliźniak, R.; Łuczewski, Ł.; Lamperska, K. 2D and 3D Cell Cultures – a Comparison of Different Types of Cancer Cell Cultures. Arch. Med. Sci. AMS 2018, 14 (4), 910–919. https://doi.org/10.5114/aoms.2016.63743.
[14] Vadivelu, R.; Kamble, H.; Shiddiky, M.; Nguyen, N.-T. Microfluidic Technology for the Generation of Cell Spheroids and Their Applications. Micromachines 2017, 8 (4), 94. https://doi.org/10.3390/mi8040094.
[15] Mak, I. W.; Evaniew, N.; Ghert, M. Lost in Translation: Animal Models and Clinical Trials in Cancer Treatment. Am. J. Transl. Res. 2014, 6 (2), 114–118.
[16] Nath, S.; Devi, G. R. Three-Dimensional Culture Systems in Cancer Research: Focus on Tumor Spheroid Model. Pharmacol. Ther. 2016, 163, 94–108. https://doi.org/10.1016/j.pharmthera.2016.03.013.
[17] Ravi, M.; Paramesh, V.; Kaviya, S. R.; Anuradha, E.; Solomon, F. D. P. 3D Cell Culture Systems: Advantages and Applications. J. Cell. Physiol. 2015, 230 (1), 16–26. https://doi.org/10.1002/jcp.24683.
[18] Hermida, M. A.; Kumar, J. D.; Schwarz, D.; Laverty, K. G.; Di Bartolo, A.; Ardron, M.; Bogomolnijs, M.; Clavreul, A.; Brennan, P. M.; Wiegand, U. K.; Melchels, F. PW.; Shu, W.; Leslie, N. R. Three Dimensional in Vitro Models of Cancer: Bioprinting Multilineage Glioblastoma Models. Adv. Biol. Regul. 2020, 75, 100658. https://doi.org/10.1016/j.jbior.2019.100658.
[19] Vidéo de Vulgarisation Sur La Microfluidique; 2022.
[20] Sontheimer-Phelps, A.; Hassell, B. A.; Ingber, D. E. Modelling Cancer in Microfluidic Human Organs-on-Chips. Nat. Rev. Cancer 2019, 19 (2), 65–81. https://doi.org/10.1038/s41568-018-0104-6.
[21] Suurmond, C.-A. E.; Lasli, S.; van den Dolder, F. W.; Ung, A.; Kim, H.-J.; Bandaru, P.; Lee, K.; Cho, H.-J.; Ahadian, S.; Ashammakhi, N.; Dokmeci, M. R.; Lee, J.; Khademhosseini, A. In Vitro Human Liver Model of Nonalcoholic Steatohepatitis by Coculturing Hepatocytes, Endothelial Cells, and Kupffer Cells. Adv. Healthc. Mater. 2019, 8 (24), 1901379. https://doi.org/10.1002/adhm.201901379.
[22] Ashammakhi, N.; Wesseling-Perry, K.; Hasan, A.; Elkhammas, E.; Zhang, Y. S. Kidney-on-a-Chip: Untapped Opportunities. Kidney Int. 2018, 94 (6), 1073–1086. https://doi.org/10.1016/j.kint.2018.06.034.
[23] Ashammakhi, N.; Elkhammas, E.; Hasan, A. Translating Advances in Organ-on-a-Chip Technology for Supporting Organs. J. Biomed. Mater. Res. B Appl. Biomater. 2019, 107 (6), 2006–2018. https://doi.org/10.1002/jbm.b.34292.
[24] Ashammakhi, N.; Nasiri, R.; Barros, N. R. de; Tebon, P.; Thakor, J.; Goudie, M.; Shamloo, A.; Martin, M. G.; Khademhosseini, A. Gut-on-a-Chip: Current Progress and Future Opportunities. Biomaterials 2020, 255, 120196. https://doi.org/10.1016/j.biomaterials.2020.120196.
[25] Kimura, H.; Sakai, Y.; Fujii, T. Organ/Body-on-a-Chip Based on Microfluidic Technology for Drug Discovery. Drug Metab. Pharmacokinet. 2018, 33 (1), 43–48. https://doi.org/10.1016/j.dmpk.2017.11.003.
[26] Migliore, L.; Coppedè, F. Genetic and Environmental Factors in Cancer and Neurodegenerative Diseases. Mutat. Res. Mutat. Res. 2002, 512 (2–3), 135–153. https://doi.org/10.1016/S1383-5742(02)00046-7.
[27] Silva, A. C. Q.; Vilela, C.; Santos, H. A.; Silvestre, A. J. D.; Freire, C. S. R. Recent Trends on the Development of Systems for Cancer Diagnosis and Treatment by Microfluidic Technology. Appl. Mater. Today 2020, 18, 100450. https://doi.org/10.1016/j.apmt.2019.100450.
[28] Liu, P.; Cao, Y.; Zhang, S.; Zhao, Y.; Liu, X.; Shi, H.; Hu, K.; Zhu, G.; Ma, B.; Niu, H. A Bladder Cancer Microenvironment Simulation System Based on a Microfluidic Co-Culture Model. Oncotarget 2015, 6 (35). https://doi.org/10.18632/oncotarget.6070.
[29] Truong, D. D.; Kratz, A.; Park, J. G.; Barrientos, E. S.; Saini, H.; Nguyen, T.; Pockaj, B.; Mouneimne, G.; LaBaer, J.; Nikkhah, M. A Human Organotypic Microfluidic Tumor Model Permits Investigation Of The Interplay Between Patient-Derived Fibroblasts And Breast Cancer Cells. Cancer Res. 2019, 79 (12), 3139–3151. https://doi.org/10.1158/0008-5472.CAN-18-2293.
[30] Aung, A.; Kumar, V.; Theprungsirikul, J.; Davey, S. K.; Varghese, S. An Engineered Tumor-on-a-Chip Device with Breast Cancer–Immune Cell Interactions for Assessing T-Cell Recruitment. Cancer Res. 2020, 80 (2), 263–275. https://doi.org/10.1158/0008-5472.CAN-19-0342.
[31] Ko, J.; Ahn, J.; Kim, S.; Lee, Y.; Lee, J.; Park, D.; Jeon, N. L. Tumor Spheroid-on-a-Chip: A Standardized Microfluidic Culture Platform for Investigating Tumor Angiogenesis. Lab. Chip 2019, 19 (17), 2822–2833. https://doi.org/10.1039/C9LC00140A.
[32] Miller, C. P.; Tsuchida, C.; Zheng, Y.; Himmelfarb, J.; Akilesh, S. A 3D Human Renal Cell Carcinoma-on-a-Chip for the Study of Tumor Angiogenesis. Neoplasia 2018, 20 (6), 610–620. https://doi.org/10.1016/j.neo.2018.02.011.
[33] Buchanan, C. F.; Verbridge, S. S.; Vlachos, P. P.; Rylander, M. N. Flow Shear Stress Regulates Endothelial Barrier Function and Expression of Angiogenic Factors in a 3D Microfluidic Tumor Vascular Model. Cell Adhes. Migr. 2014, 8 (5), 517–524. https://doi.org/10.4161/19336918.2014.970001.
[34] Wang, Y.; Wu, D.; Wu, G.; Wu, J.; Lu, S.; Lo, J.; He, Y.; Zhao, C.; Zhao, X.; Zhang, H.; Wang, S. Metastasis-on-a-Chip Mimicking the Progression of Kidney Cancer in the Liver for Predicting Treatment Efficacy. Theranostics 2020, 10 (1), 300–311. https://doi.org/10.7150/thno.38736.
[35] Aleman, J.; Skardal, A. A Multi-Site Metastasis-on-a-Chip Microphysiological System for Assessing Metastatic Preference of Cancer Cells. Biotechnol. Bioeng. 2019, 116 (4), 936–944. https://doi.org/10.1002/bit.26871.
[36] Yankaskas, C. L.; Thompson, K. N.; Paul, C. D.; Vitolo, M. I.; Mistriotis, P.; Mahendra, A.; Bajpai, V. K.; Shea, D. J.; Manto, K. M.; Chai, A. C.; Varadarajan, N.; Kontrogianni-Konstantopoulos, A.; Martin, S. S.; Konstantopoulos, K. A Microfluidic Assay for the Quantification of the Metastatic Propensity of Breast Cancer Specimens. Nat. Biomed. Eng. 2019, 3 (6), 452–465. https://doi.org/10.1038/s41551-019-0400-9.
[37] Hao, S.; Ha, L.; Cheng, G.; Wan, Y.; Xia, Y.; Sosnoski, D. M.; Mastro, A. M.; Zheng, S.-Y. A Spontaneous 3D Bone-On-a-Chip for Bone Metastasis Study of Breast Cancer Cells. Small 2018, 14 (12), 1702787. https://doi.org/10.1002/smll.201702787.
[38] Mi, S.; Liu, Z.; Du, Z.; Yi, X.; Sun, W. Three-Dimensional Microfluidic Tumor–Macrophage System for Breast Cancer Cell Invasion. Biotechnol. Bioeng. 2019, 116 (7), 1731–1741. https://doi.org/10.1002/bit.26961.
[39] Shen, S.; Zhang, X.; Zhang, F.; Wang, D.; Long, D.; Niu, Y. Three-Gradient Constructions in a Flow-Rate Insensitive Microfluidic System for Drug Screening towards Personalized Treatment. Talanta 2020, 208, 120477. https://doi.org/10.1016/j.talanta.2019.120477.
[40] Chang, H.-C.; Lin, C.-H.; Juang, D. S.; Wu, H.; Lee, C.-Y.; Chen, C.; Hsu, C.-H. Multilayer Architecture Microfluidic Network Array for Combinatorial Drug Testing on 3D-Cultured Cells. Biofabrication 2019. https://doi.org/10.1088/1758-5090/ab1f52.
[41] Weng, K.-C.; Kurokawa, Y. K.; Hajek, B. S.; Paladin, J. A.; Shirure, V. S.; George, S. C. Human Induced Pluripotent Stem-Cardiac-Endothelial-Tumor-on-a-Chip to Assess Anticancer Efficacy and Cardiotoxicity. Tissue Eng. Part C Methods 2020, 26 (1), 44–55. https://doi.org/10.1089/ten.tec.2019.0248.
[42] Chen, J.; Liu, C.-Y.; Wang, X.; Sweet, E.; Liu, N.; Gong, X.; Lin, L. 3D Printed Microfluidic Devices for Circulating Tumor Cells (CTCs) Isolation. Biosens. Bioelectron. 2020, 150, 111900. https://doi.org/10.1016/j.bios.2019.111900.
[43] Neves, M.; Azevedo, R.; Lima, L.; Oliveira, M. I.; Peixoto, A.; Ferreira, D.; Soares, J.; Fernandes, E.; Gaiteiro, C.; Palmeira, C.; Cotton, S.; Mereiter, S.; Campos, D.; Afonso, L. P.; Ribeiro, R.; Fraga, A.; Tavares, A.; Mansinho, H.; Monteiro, E.; Videira, P. A.; Freitas, P. P.; Reis, C. A.; Santos, L. L.; Dieguez, L.; Ferreira, J. A. Exploring Sialyl-Tn Expression in Microfluidic-Isolated Circulating Tumour Cells: A Novel Biomarker and an Analytical Tool for Precision Oncology Applications. New Biotechnol. 2019, 49, 77–87. https://doi.org/10.1016/j.nbt.2018.09.004.
[44] Varillas, J. I.; Zhang, J.; Chen, K.; Barnes, I. I.; Liu, C.; George, T. J.; Fan, Z. H. Microfluidic Isolation of Circulating Tumor Cells and Cancer Stem-Like Cells from Patients with Pancreatic Ductal Adenocarcinoma. Theranostics 2019, 9 (5), 1417–1425. https://doi.org/10.7150/thno.28745.
[45] Sierra, J.; Marrugo-Ramírez, J.; Rodriguez-Trujillo, R.; Mir, M.; Samitier, J. Sensor-Integrated Microfluidic Approaches for Liquid Biopsies Applications in Early Detection of Cancer. Sensors 2020, 20 (5). https://doi.org/10.3390/s20051317.
[46] Aimi, F.; Procopio, M.-G.; Alvarez Flores, M. T.; Brouland, J.-P.; Piazzon, N.; Brajkovic, S.; Dupouy, D. G.; Gijs, M.; de Leval, L. Microfluidic-Based Immunohistochemistry for Breast Cancer Diagnosis: A Comparative Clinical Study. Virchows Arch. 2019, 475 (3), 313–323. https://doi.org/10.1007/s00428-019-02616-7.
[47] Xu, Z.; Li, E.; Guo, Z.; Yu, R.; Hao, H.; Xu, Y.; Sun, Z.; Li, X.; Lyu, J.; Wang, Q. Design and Construction of a Multi-Organ Microfluidic Chip Mimicking the in Vivo Microenvironment of Lung Cancer Metastasis. ACS Appl. Mater. Interfaces 2016, 8 (39), 25840–25847. https://doi.org/10.1021/acsami.6b08746.
[48] Hassell, B. A.; Goyal, G.; Lee, E.; Sontheimer-Phelps, A.; Levy, O.; Chen, C. S.; Ingber, D. E. Human Organ Chip Models Recapitulate Orthotopic Lung Cancer Growth, Therapeutic Responses, and Tumor Dormancy In Vitro. Cell Rep. 2017, 21 (2), 508–516. https://doi.org/10.1016/j.celrep.2017.09.043.
[49] Jiang, L.; Ivich, F.; Tahsin, S.; Tran, M.; Frank, S. B.; Miranti, C. K.; Zohar, Y. Human Stroma and Epithelium Co-Culture in a Microfluidic Model of a Human Prostate Gland. Biomicrofluidics 2019, 13 (6), 064116. https://doi.org/10.1063/1.5126714.
[50] Choi, Y.; Hyun, E.; Seo, J.; Blundell, C.; Kim, H. C.; Lee, E.; Lee, S.; Moon, A.; Moon, W. K.; Huh, D. A Microengineered Pathophysiological Model of Early-Stage Breast Cancer. Lab. Chip 2015, 15 (16), 3350–3357. https://doi.org/10.1039/c5lc00514k.
[51] Vargo-Gogola, T.; Rosen, J. M. Modelling Breast Cancer: One Size Does Not Fit All. Nat. Rev. Cancer 2007, 7 (9), 659–672. https://doi.org/10.1038/nrc2193.
[52] Devadas, D.; Moore, T. A.; Walji, N.; Young, E. W. K. A Microfluidic Mammary Gland Coculture Model Using Parallel 3D Lumens for Studying Epithelial-Endothelial Migration in Breast Cancer. Biomicrofluidics 2019, 13 (6), 064122. https://doi.org/10.1063/1.5123912.
[53] PubChem. Paclitaxel. https://pubchem.ncbi.nlm.nih.gov/compound/36314 (accessed 2022-10-14).
[54] Imparato, G.; Urciuolo, F.; Netti, P. A. Organ on Chip Technology to Model Cancer Growth and Metastasis. Bioengineering 2022, 9 (1), 28. https://doi.org/10.3390/bioengineering9010028.
[55] Ashammakhi, N. A.; Elzagheid, A. Organ-on-a-Chip: New Tool for Personalized Medicine. J. Craniofac. Surg. 2018, 29 (4), 823–824. https://doi.org/10.1097/SCS.0000000000004604.