Le premier article du dossier « Nanomatériaux et leurs applications en thérapie cancéreuse » propose quelques rappels sur la chimiothérapie et présente les nanomédicaments développés pour traiter le cancer.
Introduction
Bien que des masses tumorales aient été observées sur les momies, les premières notions de cancérologie n’apparaissent qu’à la fin du VIe siècle avant Jésus-Christ (J.-C.). Nous le devons à Hippocrate qui décrit plusieurs tumeurs et associe leur forme à celle d’un crabe, « karkinos » en grec, qui donnera le terme de carcinome plus communément appelé « cancer ». L’existence de la maladie sera ensuite confirmée par Galien au IIe siècle après J.-C. dans son « Traité des Tumeurs » [1].
Cette maladie est donc connue depuis des milliers d’années et reste malgré tout un sujet d’inquiétude pour le monde entier.
Selon le Centre international de recherche sur le cancer (CIRC), plus de 19,3 millions de nouveaux cas ont été signalés en 2020 et environ 10 millions de personnes sont décédées du cancer cette année-là [2]. De plus, l'incidence du cancer devrait fortement augmenter au cours des prochaines années, notamment dans les pays en voie de développement [3]. Il est à noter qu’environ 50% des personnes malades pourront envisager une rémission totale (tous cancers confondus). Ce faible taux reste associé aux nombreux mystères qui entourent cette maladie : son apparition, la difficulté de son diagnostic précoce et son évolution constante (multi-drug résistance), auxquelles doivent s’adapter les chercheurs, médecins et industries pharmaceutiques pour le développement des traitements.
Il existe à l’heure actuelle de nombreux traitements, tels que la chirurgie (ablation de la tumeur) [4][5], la radiothérapie (utilisation de Rayons X) [6], l’immunothérapie (stimulation des défenses immunitaires contre les cellules cancéreuses) [7], la chimiothérapie (utilisation de médicaments) [1][8]. Ces thérapies peuvent être utilisées seules ou combinées.
Pour l’ensemble de ces thérapies, le lecteur est invité à consulter les articles cités en références. Dans cet article, après une brève introduction à la chimiothérapie, nous intéresserons à l’utilisation de nanomatériaux pour la thérapie cancéreuse. Nous évoquerons en conclusion les nouvelles technologies en vue de mieux comprendre les interactions entre nanomatériaux et environnement tumoral (cancer sur puce).
Nanomatériaux pour la thérapie cancéreuse
La chimiothérapie
La chimiothérapie est l’une des techniques les plus fréquemment utilisées : elle consiste en l’injection d’un médicament dans le système sanguin, en vue d’éliminer ou de réduire la masse tumorale. C’est une technique efficace mais malheureusement invasive. En effet, ce traitement impose l’utilisation de différentes familles de médicaments qui visent au blocage de la division du noyau des cellules en ciblant efficacement les cellules se divisant très rapidement. Les cellules cancéreuses en font partie, tout comme les cellules associées à la pousse des cheveux ou à la régénération de l'épithélium1 intestinal et les cellules sanguines. Cela conduit donc aux effets secondaires bien connus tels que l’alopécie (perte des cheveux), la diminution des globules blancs, l’anémie, les nausées, etc.
En dépit de ses effets secondaires, compte tenu de son rapport bénéfice/risque, la chimiothérapie reste à l’heure actuelle un traitement couramment utilisé.
Les premiers agents antinéoplasiques (ou anticancéreux2) développés dans les années 1940 étaient d’abord considérés comme des poisons du fait de leur mode d’action, qui consistait à bloquer la prolifération cellulaire. Comme indiqué précédemment, ce blocage touchait autant les cellules saines que tumorales. Le premier médicament synthétisé dans cette catégorie était le cyclophosphamide, qui induit une modification structurale de l’ADN par alkylation. Cela a pour conséquence une inhibition de la transcription et de la réplication de l'ADN aboutissant à la destruction cellulaire. La fin du XXIe siècle a vu le développement d’un ensemble de molécules aux modes d’action variés telles que des antimétabolites3, des inhibiteurs de la polymérisation de la tubuline4 ou des agents qui désorganisent le réseau microtubulaire5 lors de la mitose6.
Toutefois, l’ensemble des agents antitumoraux7 développés ont montré une limite de leurs propriétés pharmacocinétiques et de leur solubilité dans les bio-fluides (sang). De plus, les nombreux effets secondaires cités ci-dessus sont dus au fait que les traitements visent non seulement les cellules cancéreuses mais aussi les cellules saines.
C’est ainsi que, pour améliorer les propriétés des agents antitumoraux existants, le concept de nano-cages (ou nanocarriers en anglais) vectorisant8 les médicaments anticancéreux a été développé. Le principe consiste à enfermer le médicament dans une cage moléculaire (pour augmenter les propriétés pharmacocinétiques du médicament) et à greffer à la surface de cette nano-cage une molécule dite « ligand » qui permettrait de concentrer la nano-cage autour du site tumoral. Cela a ainsi ouvert l'ère des nanomédicaments plus communément appelé la « nanomédecine ».
Les nanomédicaments
La nanomédecine est une technologie de pointe permettant de concevoir des agents thérapeutiques multifonctionnels, qui pourrait devenir la technologie-clé dans le traitement du cancer. Elle consiste à encapsuler un ensemble de médicaments à l’intérieur d’une nanoparticule en les protégeant de la dégradation, pour permettre leur vectorisation (guidage vers le site cancéreux) tout en y ajoutant des éléments permettant l’imagerie.
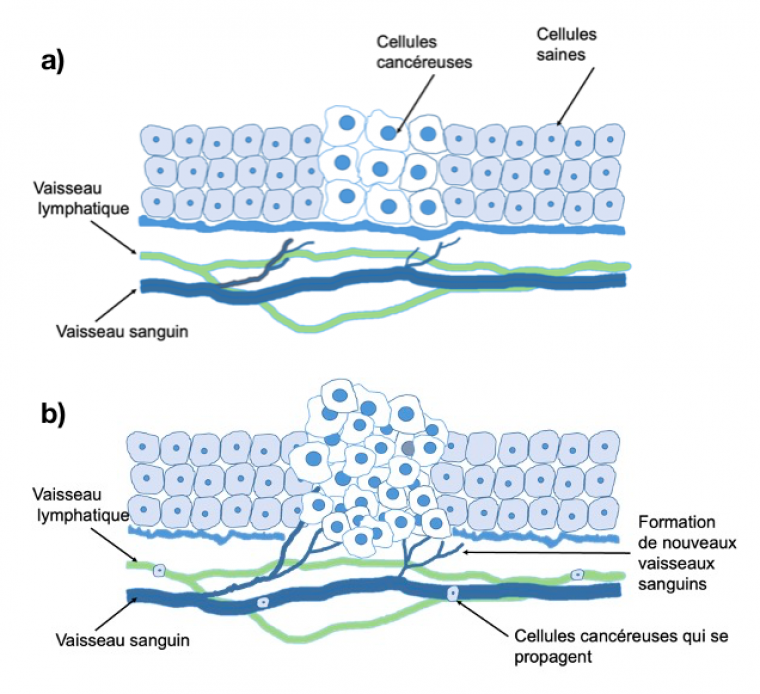
Un autre avantage de l’utilisation de nanoparticules pour le traitement du cancer est lié à l’angiogenèse tumorale 9 (Figures 1a et 1b). En effet, ce phénomène de formation de néovaisseaux non étanches autour de la tumeur facilite l’accès des nanoparticules à la tumeur ; par ailleurs, l’inefficacité du drainage lymphatique dans les tissus cancéreux « coince » la nanoparticule au sein de la tumeur. Ceci a posé les bases de l'effet EPR (Enhanced Permeability and Retention, en anglais), il y a environ 35 ans.
C’est ainsi qu’en 1995, le Doxil® (doxorubicine liposomale) a été le premier médicament à base de nanoparticules utilisé dans le cadre du traitement du cancer à recevoir une autorisation de mise sur le marché aux États-Unis. Cela a ensuite ouvert la voie à de nombreux nanomédicaments pour diverses maladies. Ces nanothérapies comprennent des particules organiques et inorganiques administrées par voie locale et systémique1.
Les structures des nanomédicaments qui bénéficient d’une approbation clinique se divisent en quatre catégories : les nanoparticules à base de lipides (ou nanoliposomes2), de polymères, de protéines ou encore de métaux (ici surtout l’oxyde de fer). Pour une liste détaillée, il est possible de se référer à la revue de Wolfram et al intitulée Clinical Cancer Nanomedicine [9].
Le tableau ci-dessous regroupe un ensemble de nanothérapies actuellement utilisées, il n’est bien sûr pas exhaustif, mais présente les différentes formes qu’il est possible de trouver. La plupart des formulations sont à base de liposomes, mais une formulation à base de nanoparticules d’oxydes de fer a été approuvée en Europe en 2011.
| Nom du médicament | Composition | Cancer visé |
|---|---|---|
| Doxil | Doxorubicine dans Liposome PEGylé | Sein, poumon, et pancréas |
| Onivyde | Irinotecan dans Liposome PEGylé | Cancer ovarien, myélome multiple, cancer du pancréas avancé |
| Myocet | Doxorubicine dans Liposome | Cancer du sein métastatique |
| MEPACT | Muramyl tripeptide phophatidyl-ethanolamine dans liposome |
Ostéosarcome |
| NanoTherm | Nanoparticules d’oxyde de fer | Tumeur cérébrale |
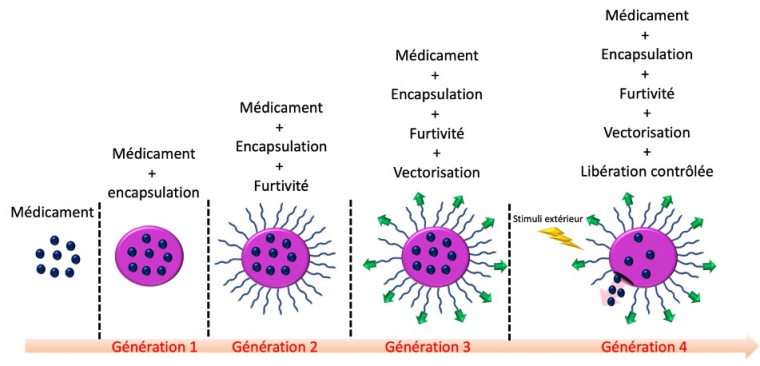
Avec l’évolution des technologies ainsi que des techniques de chimie, la structure des nanoparticules a évolué voyant quatre générations de nanoparticules se succéder. L’ingénierie s’est adaptée aux nombreux obstacles rencontrés in vitro/in vivo. Les générations sont décrites ci-dessous.
La première génération permettait l’encapsulation du médicament au sein d’une cage, par exemple un liposome (Figure 2). Cela permettait de résoudre les problèmes de solubilité du médicament, mais ces nano-objets souffraient d’une faible spécificité, d’une trop forte accumulation hépatosplénique3 et d’une durée de circulation réduite dans le sang. Il a été démontré que ces nano-objets étaient facilement capturés par les cellules phagocytaires du système réticulo-endothélial4 (SRE), ce qui limitait leur efficacité thérapeutique.
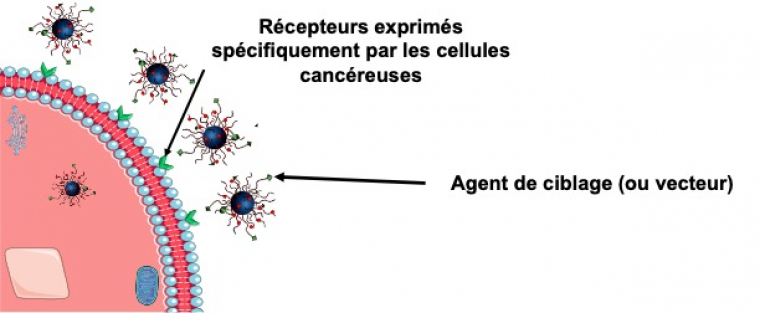
Pour limiter cette phagocytose, la fonctionnalisation des surfaces des nanoparticules par des polymères dit antiadhésifs a été développée. C’est ainsi que la seconde génération de nanoparticules utilisées dans le traitement du cancer a vu le jour. Cette nouvelle génération tire parti des propriétés d’encapsulation de la première génération, auxquelles sont greffées des chaînes de polymères hydrophiles neutres (très souvent le polyéthylène glycol, PEG). Ainsi les nano-cages deviennent « furtives », ce qui limite leur élimination par le système immunitaire et leur accumulation hépatosplénique. Pour améliorer l’efficacité thérapeutique, il est possible de jouer sur le fait que les cellules cancéreuses sur-expriment des récepteurs contrairement aux cellules saines (Figure 3). L’idée est donc de greffer un ligand associé au récepteur des cellules cancéreuses afin de concentrer préférentiellement les nanoparticules autour des cellules cancéreuses et de protéger les cellules saines.
On parle alors de « nano-vecteur ». Ainsi est née la troisième génération, où le concept de ciblage actif a été utilisé. Enfin, la quatrième et dernière génération a conduit au développement de nanomatériaux dit « intelligents ». Pour l’élaboration de ces nano-objets, l’ensemble des caractéristiques de chacune des générations précédemment présentées a été repris ; on y ajoute une réponse à un stimulus extérieur lors de la libération du médicament. Les stimuli étudiés peuvent être le pH, la lumière, la température, le champ magnétique, etc. Ainsi cela permet à la nano-cage de ne libérer le médicament qu’une fois le site cancéreux atteint, via l’utilisation d’un stimulus auquel le système est sensible. Cette ingénierie a pour avantage considérable de « garder » le médicament jusqu’à ce que le nano-vecteur ait atteint sa cible et de le libérer sur demande. Ainsi, les doses de médicament injectées au patient peuvent être réduites au minimum.
La Figure 4 ci-dessous présente schématiquement les différentes générations des nano-objets.
Le développement des générations et de l’ingénierie est en plein essor et les chercheurs ne cessent d’innover dans ce domaine tant les enjeux de la thérapie cancéreuse sont cruciaux.
Mais il faut rappeler que, pour beaucoup de nano-vecteurs, dont les études sur des cellules en culture étaient très prometteuses, de grands échecs se sont succédés une fois que des tests cliniques étaient opérés. Il est raisonnable de penser qu’à l’heure actuelle nous manquons encore de compréhension précise sur le chemin parcouru par les nano-objets depuis leur injection jusqu’à leur arrivée précise sur le site tumoral. Tous les événements auxquels sont confrontés les nano-objets dans le corps humain restent donc à découvrir. C’est ainsi que les notions d’organes sur puce ont vu le jour, que nous décrivons dans la suite de cet article.
Limite des tests actuels
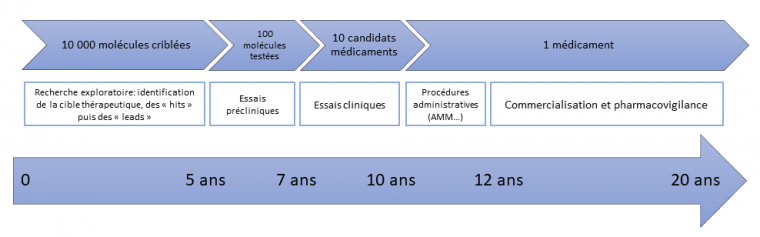
Le schéma classique de développement d’un médicament jusqu’à l’approbation de sa commercialisation par les autorités de santé est composé de cinq phases [10].
Les durées de chaque phase sont indicatives.
Pour l'instant, chaque phase est étudiée séparément et nécessite beaucoup de ressources financières et de temps. Bien sûr, la Phase clinique I ne peut pas être évitée, mais condenser la Phase préclinique (ou Phase 0) et la Phase clinique I en évitant les tests sur les animaux tout en fournissant des données fiables dans un seul laboratoire sur puce ex-vivo permettrait d’accélérer la translation du nanomédicament vers l’homme. Une directive européenne a été formulée : la règle des 3R (Directive 2010/63/EU) : Respect du Bien-être animal, Réduction du nombre d’animaux, Remplacement par des méthodes alternatives.
Comme décrit précédemment, l’un des défis majeurs de la nanomédecine est le développement de systèmes nanoparticulaires pouvant servir d'outils de diagnostic, d’outils thérapeutiques ou d’outils théranostiques (c’est-à-dire des outils à visée diagnostique et thérapeutique) efficaces contre les maladies graves, telles que les maladies infectieuses ou neurodégénératives. Dans le cadre de la thérapie anticancéreuse, des efforts sont actuellement concentrés autour du développement d'agents théranostiques capables de diagnostiquer et de traiter simultanément une tumeur. En dépit de l'efficacité prometteuse démontrée par certaines nanoparticules (NPs) dans les études précliniques, moins de 10% des nanomédicaments anticancéreux qui atteignent la Phase I des essais cliniques (Figure 5) obtiennent une approbation de l'Agence européenne des médicaments (EMA), ce qui fait de l'oncologie le domaine pharmaceutique avec le taux de réussite le plus faible.
La cause du taux d'échec de 90% des nano-médicaments anticancéreux entre la Phase I et la demande d'approbation des autorités est liée aux faibles efficacité et innocuité de ces dispositifs (responsables respectivement de 56 et 28% des échecs) [11]. Cela est essentiellement dû à la difficulté d'établir une corrélation entre l'efficacité et la toxicité des nano-systèmes à travers les espèces (les premiers tests sont faits sur des souris et les résultats obtenus ne sont pas forcément transposables à l’homme) et aussi entre les personnes [3]. Depuis 2022, le taux de mortalité dû au cancer avoisine celui dû aux maladies cardiovasculaires, ce qui fait du développement des traitements pour cette maladie un enjeu sociétal majeur. Le développement et l'évaluation efficaces des médicaments dérivés de nano-objets sont donc cruciaux.
L'une des principales limitations de l’efficacité thérapeutique des nanoparticules est due au fait que, lorsqu’elles sont injectées dans le corps, elles sont rapidement recouvertes par diverses protéines (créant ce que l'on appelle la couronne de protéines, notée PC) [4]. Les modifications observées de l'énergie de surface des particules, de la taille, de l'absorption cellulaire, de la biodistribution, de la toxicité, peuvent donc complètement contredire ou augmenter l'efficacité des NPs observée en culture in vitro 2D ou 3D au passage vers l’in vivo. De plus, ces changements peuvent être observés d'une espèce à l'autre et également au sein d’une même espèce, d'un individu à un autre ou entre types de cancer [4][5]. En effet, de nombreuses discussions affirment aujourd'hui que l'adsorption des protéines doit être empêchée (c'est la raison pour laquelle le polyéthylène glycol (PEG) est souvent greffé autour de nano-médicaments pour ses propriétés furtives [7]). Au contraire, d'autres travaux affirment que l'adsorption des protéines pourraient aider à vectoriser les NPs ce qui rendrait la formation d’une PC favorable [4][8-10].Cette grande divergence est principalement due au fait qu'il n'y a pas de développement de systèmes réels permettant des études ex vivo fiables et réalistes de ces phénomènes.
Afin de concevoir de façon optimale un nanomédicament (c’est-à-dire alliant efficacité thérapeutique et absence de toxicité), il est crucial de contrôler les propriétés physico-chimiques des nanoparticules et d’étudier in situ leur interaction avec les tumeurs. Comprendre les mécanismes impliqués lors de l’injection des nanoparticules dans le sang et ainsi éclairer la communauté scientifique sur les principales limites de l’efficacité des nano-objets est donc un enjeu majeur de la nanomédecine. Ceci ouvrirait la voie à la conception intelligente de futurs systèmes anticancéreux basés sur des nanoparticules. Pour cela, des modèles de laboratoires ex vivo sur puces basés sur la technologie des organes sur puces sont actuellement en plein essor.

Références
[1] DeVita, V. T., Jr.; Chu, E. A History of Cancer Chemotherapy. Cancer Res. 2008, 68 (21), 8643–8653. https://doi.org/10.1158/0008-5472.CAN-07-6611.
[2] Sung, H.; Ferlay, J.; Siegel, R. L.; Laversanne, M.; Soerjomataram, I.; Jemal, A.; Bray, F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA. Cancer J. Clin. 2021, 71 (3), 209–249. https://doi.org/10.3322/caac.21660.
[3] WHO outlines steps to save 7 million lives from cancer. https://www.who.int/news/item/04-02-2020-who-outlines-steps-to-save-7-million-lives-from-cancer (accessed 2021-05-10).
[4] Katz, M. H. G.; Francescatti, A. B.; Hunt, K. K.; Cancer Surgery Standards Program of the American College of Surgeons. Technical Standards for Cancer Surgery: Commission on Cancer Standards 5.3–5.8. Ann. Surg. Oncol. 2022. https://doi.org/10.1245/s10434-022-11375-w.
[5] Mieog, J. S. D.; Achterberg, F. B.; Zlitni, A.; Hutteman, M.; Burggraaf, J.; Swijnenburg, R.-J.; Gioux, S.; Vahrmeijer, A. L. Fundamentals and Developments in Fluorescence-Guided Cancer Surgery. Nat. Rev. Clin. Oncol. 2022, 19 (1), 9–22. https://doi.org/10.1038/s41571-021-00548-3.
[6] Petroni, G.; Cantley, L. C.; Santambrogio, L.; Formenti, S. C.; Galluzzi, L. Radiotherapy as a Tool to Elicit Clinically Actionable Signalling Pathways in Cancer. Nat. Rev. Clin. Oncol. 2022, 19 (2), 114–131. https://doi.org/10.1038/s41571-021-00579-w.
[7] Gong, N.; Sheppard, N. C.; Billingsley, M. M.; June, C. H.; Mitchell, M. J. Nanomaterials for T-Cell Cancer Immunotherapy. Nat. Nanotechnol. 2021, 16 (1), 25–36. https://doi.org/10.1038/s41565-020-00822-y.
[8] Behranvand, N.; Nasri, F.; Zolfaghari Emameh, R.; Khani, P.; Hosseini, A.; Garssen, J.; Falak, R. Chemotherapy: A Double-Edged Sword in Cancer Treatment. Cancer Immunol. Immunother. 2022, 71 (3), 507–526. https://doi.org/10.1007/s00262-021-03013-3.
[9] Wolfram, J.; Ferrari, M. Clinical Cancer Nanomedicine. Nano Today 2019, 25, 85–98. https://doi.org/10.1016/j.nantod.2019.02.005.
[10] De la molécule au médicament. CultureSciences-Chimie. https://culturesciences.chimie.ens.fr/thematiques/chimie-organique/chimie-pharmaceutique/de-la-molecule-au-medicament (accessed 2022-10-14).
[11] Maeda, H.; Khatami, M. Analyses of Repeated Failures in Cancer Therapy for Solid Tumors: Poor Tumor-Selective Drug Delivery, Low Therapeutic Efficacy and Unsustainable Costs. Clin. Transl. Med. 2018, 7 (1), 11. https://doi.org/10.1186/s40169-018-0185-6.
[12] Xu, H.; Lyu, X.; Yi, M.; Zhao, W.; Song, Y.; Wu, K. Organoid Technology and Applications in Cancer Research. J. Hematol. Oncol.J Hematol Oncol 2018, 11. https://doi.org/10.1186/s13045-018-0662-9.
[13] Kapałczyńska, M.; Kolenda, T.; Przybyła, W.; Zajączkowska, M.; Teresiak, A.; Filas, V.; Ibbs, M.; Bliźniak, R.; Łuczewski, Ł.; Lamperska, K. 2D and 3D Cell Cultures – a Comparison of Different Types of Cancer Cell Cultures. Arch. Med. Sci. AMS 2018, 14 (4), 910–919. https://doi.org/10.5114/aoms.2016.63743.
[14] Vadivelu, R.; Kamble, H.; Shiddiky, M.; Nguyen, N.-T. Microfluidic Technology for the Generation of Cell Spheroids and Their Applications. Micromachines 2017, 8 (4), 94. https://doi.org/10.3390/mi8040094.
[15] Mak, I. W.; Evaniew, N.; Ghert, M. Lost in Translation: Animal Models and Clinical Trials in Cancer Treatment. Am. J. Transl. Res. 2014, 6 (2), 114–118.
[16] Nath, S.; Devi, G. R. Three-Dimensional Culture Systems in Cancer Research: Focus on Tumor Spheroid Model. Pharmacol. Ther. 2016, 163, 94–108. https://doi.org/10.1016/j.pharmthera.2016.03.013.
[17] Ravi, M.; Paramesh, V.; Kaviya, S. R.; Anuradha, E.; Solomon, F. D. P. 3D Cell Culture Systems: Advantages and Applications. J. Cell. Physiol. 2015, 230 (1), 16–26. https://doi.org/10.1002/jcp.24683.
[18] Hermida, M. A.; Kumar, J. D.; Schwarz, D.; Laverty, K. G.; Di Bartolo, A.; Ardron, M.; Bogomolnijs, M.; Clavreul, A.; Brennan, P. M.; Wiegand, U. K.; Melchels, F. PW.; Shu, W.; Leslie, N. R. Three Dimensional in Vitro Models of Cancer: Bioprinting Multilineage Glioblastoma Models. Adv. Biol. Regul. 2020, 75, 100658. https://doi.org/10.1016/j.jbior.2019.100658.
[19] Vidéo de Vulgarisation Sur La Microfluidique; 2022.
[20] Sontheimer-Phelps, A.; Hassell, B. A.; Ingber, D. E. Modelling Cancer in Microfluidic Human Organs-on-Chips. Nat. Rev. Cancer 2019, 19 (2), 65–81. https://doi.org/10.1038/s41568-018-0104-6.
[21] Suurmond, C.-A. E.; Lasli, S.; van den Dolder, F. W.; Ung, A.; Kim, H.-J.; Bandaru, P.; Lee, K.; Cho, H.-J.; Ahadian, S.; Ashammakhi, N.; Dokmeci, M. R.; Lee, J.; Khademhosseini, A. In Vitro Human Liver Model of Nonalcoholic Steatohepatitis by Coculturing Hepatocytes, Endothelial Cells, and Kupffer Cells. Adv. Healthc. Mater. 2019, 8 (24), 1901379. https://doi.org/10.1002/adhm.201901379.
[22] Ashammakhi, N.; Wesseling-Perry, K.; Hasan, A.; Elkhammas, E.; Zhang, Y. S. Kidney-on-a-Chip: Untapped Opportunities. Kidney Int. 2018, 94 (6), 1073–1086. https://doi.org/10.1016/j.kint.2018.06.034.
[23] Ashammakhi, N.; Elkhammas, E.; Hasan, A. Translating Advances in Organ-on-a-Chip Technology for Supporting Organs. J. Biomed. Mater. Res. B Appl. Biomater. 2019, 107 (6), 2006–2018. https://doi.org/10.1002/jbm.b.34292.
[24] Ashammakhi, N.; Nasiri, R.; Barros, N. R. de; Tebon, P.; Thakor, J.; Goudie, M.; Shamloo, A.; Martin, M. G.; Khademhosseini, A. Gut-on-a-Chip: Current Progress and Future Opportunities. Biomaterials 2020, 255, 120196. https://doi.org/10.1016/j.biomaterials.2020.120196.
[25] Kimura, H.; Sakai, Y.; Fujii, T. Organ/Body-on-a-Chip Based on Microfluidic Technology for Drug Discovery. Drug Metab. Pharmacokinet. 2018, 33 (1), 43–48. https://doi.org/10.1016/j.dmpk.2017.11.003.
[26] Migliore, L.; Coppedè, F. Genetic and Environmental Factors in Cancer and Neurodegenerative Diseases. Mutat. Res. Mutat. Res. 2002, 512 (2–3), 135–153. https://doi.org/10.1016/S1383-5742(02)00046-7.
[27] Silva, A. C. Q.; Vilela, C.; Santos, H. A.; Silvestre, A. J. D.; Freire, C. S. R. Recent Trends on the Development of Systems for Cancer Diagnosis and Treatment by Microfluidic Technology. Appl. Mater. Today 2020, 18, 100450. https://doi.org/10.1016/j.apmt.2019.100450.
[28] Liu, P.; Cao, Y.; Zhang, S.; Zhao, Y.; Liu, X.; Shi, H.; Hu, K.; Zhu, G.; Ma, B.; Niu, H. A Bladder Cancer Microenvironment Simulation System Based on a Microfluidic Co-Culture Model. Oncotarget 2015, 6 (35). https://doi.org/10.18632/oncotarget.6070.
[29] Truong, D. D.; Kratz, A.; Park, J. G.; Barrientos, E. S.; Saini, H.; Nguyen, T.; Pockaj, B.; Mouneimne, G.; LaBaer, J.; Nikkhah, M. A Human Organotypic Microfluidic Tumor Model Permits Investigation Of The Interplay Between Patient-Derived Fibroblasts And Breast Cancer Cells. Cancer Res. 2019, 79 (12), 3139–3151. https://doi.org/10.1158/0008-5472.CAN-18-2293.
[30] Aung, A.; Kumar, V.; Theprungsirikul, J.; Davey, S. K.; Varghese, S. An Engineered Tumor-on-a-Chip Device with Breast Cancer–Immune Cell Interactions for Assessing T-Cell Recruitment. Cancer Res. 2020, 80 (2), 263–275. https://doi.org/10.1158/0008-5472.CAN-19-0342.
[31] Ko, J.; Ahn, J.; Kim, S.; Lee, Y.; Lee, J.; Park, D.; Jeon, N. L. Tumor Spheroid-on-a-Chip: A Standardized Microfluidic Culture Platform for Investigating Tumor Angiogenesis. Lab. Chip 2019, 19 (17), 2822–2833. https://doi.org/10.1039/C9LC00140A.
[32] Miller, C. P.; Tsuchida, C.; Zheng, Y.; Himmelfarb, J.; Akilesh, S. A 3D Human Renal Cell Carcinoma-on-a-Chip for the Study of Tumor Angiogenesis. Neoplasia 2018, 20 (6), 610–620. https://doi.org/10.1016/j.neo.2018.02.011.
[33] Buchanan, C. F.; Verbridge, S. S.; Vlachos, P. P.; Rylander, M. N. Flow Shear Stress Regulates Endothelial Barrier Function and Expression of Angiogenic Factors in a 3D Microfluidic Tumor Vascular Model. Cell Adhes. Migr. 2014, 8 (5), 517–524. https://doi.org/10.4161/19336918.2014.970001.
[34] Wang, Y.; Wu, D.; Wu, G.; Wu, J.; Lu, S.; Lo, J.; He, Y.; Zhao, C.; Zhao, X.; Zhang, H.; Wang, S. Metastasis-on-a-Chip Mimicking the Progression of Kidney Cancer in the Liver for Predicting Treatment Efficacy. Theranostics 2020, 10 (1), 300–311. https://doi.org/10.7150/thno.38736.
[35] Aleman, J.; Skardal, A. A Multi-Site Metastasis-on-a-Chip Microphysiological System for Assessing Metastatic Preference of Cancer Cells. Biotechnol. Bioeng. 2019, 116 (4), 936–944. https://doi.org/10.1002/bit.26871.
[36] Yankaskas, C. L.; Thompson, K. N.; Paul, C. D.; Vitolo, M. I.; Mistriotis, P.; Mahendra, A.; Bajpai, V. K.; Shea, D. J.; Manto, K. M.; Chai, A. C.; Varadarajan, N.; Kontrogianni-Konstantopoulos, A.; Martin, S. S.; Konstantopoulos, K. A Microfluidic Assay for the Quantification of the Metastatic Propensity of Breast Cancer Specimens. Nat. Biomed. Eng. 2019, 3 (6), 452–465. https://doi.org/10.1038/s41551-019-0400-9.
[37] Hao, S.; Ha, L.; Cheng, G.; Wan, Y.; Xia, Y.; Sosnoski, D. M.; Mastro, A. M.; Zheng, S.-Y. A Spontaneous 3D Bone-On-a-Chip for Bone Metastasis Study of Breast Cancer Cells. Small 2018, 14 (12), 1702787. https://doi.org/10.1002/smll.201702787.
[38] Mi, S.; Liu, Z.; Du, Z.; Yi, X.; Sun, W. Three-Dimensional Microfluidic Tumor–Macrophage System for Breast Cancer Cell Invasion. Biotechnol. Bioeng. 2019, 116 (7), 1731–1741. https://doi.org/10.1002/bit.26961.
[39] Shen, S.; Zhang, X.; Zhang, F.; Wang, D.; Long, D.; Niu, Y. Three-Gradient Constructions in a Flow-Rate Insensitive Microfluidic System for Drug Screening towards Personalized Treatment. Talanta 2020, 208, 120477. https://doi.org/10.1016/j.talanta.2019.120477.
[40] Chang, H.-C.; Lin, C.-H.; Juang, D. S.; Wu, H.; Lee, C.-Y.; Chen, C.; Hsu, C.-H. Multilayer Architecture Microfluidic Network Array for Combinatorial Drug Testing on 3D-Cultured Cells. Biofabrication 2019. https://doi.org/10.1088/1758-5090/ab1f52.
[41] Weng, K.-C.; Kurokawa, Y. K.; Hajek, B. S.; Paladin, J. A.; Shirure, V. S.; George, S. C. Human Induced Pluripotent Stem-Cardiac-Endothelial-Tumor-on-a-Chip to Assess Anticancer Efficacy and Cardiotoxicity. Tissue Eng. Part C Methods 2020, 26 (1), 44–55. https://doi.org/10.1089/ten.tec.2019.0248.
[42] Chen, J.; Liu, C.-Y.; Wang, X.; Sweet, E.; Liu, N.; Gong, X.; Lin, L. 3D Printed Microfluidic Devices for Circulating Tumor Cells (CTCs) Isolation. Biosens. Bioelectron. 2020, 150, 111900. https://doi.org/10.1016/j.bios.2019.111900.
[43] Neves, M.; Azevedo, R.; Lima, L.; Oliveira, M. I.; Peixoto, A.; Ferreira, D.; Soares, J.; Fernandes, E.; Gaiteiro, C.; Palmeira, C.; Cotton, S.; Mereiter, S.; Campos, D.; Afonso, L. P.; Ribeiro, R.; Fraga, A.; Tavares, A.; Mansinho, H.; Monteiro, E.; Videira, P. A.; Freitas, P. P.; Reis, C. A.; Santos, L. L.; Dieguez, L.; Ferreira, J. A. Exploring Sialyl-Tn Expression in Microfluidic-Isolated Circulating Tumour Cells: A Novel Biomarker and an Analytical Tool for Precision Oncology Applications. New Biotechnol. 2019, 49, 77–87. https://doi.org/10.1016/j.nbt.2018.09.004.
[44] Varillas, J. I.; Zhang, J.; Chen, K.; Barnes, I. I.; Liu, C.; George, T. J.; Fan, Z. H. Microfluidic Isolation of Circulating Tumor Cells and Cancer Stem-Like Cells from Patients with Pancreatic Ductal Adenocarcinoma. Theranostics 2019, 9 (5), 1417–1425. https://doi.org/10.7150/thno.28745.
[45] Sierra, J.; Marrugo-Ramírez, J.; Rodriguez-Trujillo, R.; Mir, M.; Samitier, J. Sensor-Integrated Microfluidic Approaches for Liquid Biopsies Applications in Early Detection of Cancer. Sensors 2020, 20 (5). https://doi.org/10.3390/s20051317.
[46] Aimi, F.; Procopio, M.-G.; Alvarez Flores, M. T.; Brouland, J.-P.; Piazzon, N.; Brajkovic, S.; Dupouy, D. G.; Gijs, M.; de Leval, L. Microfluidic-Based Immunohistochemistry for Breast Cancer Diagnosis: A Comparative Clinical Study. Virchows Arch. 2019, 475 (3), 313–323. https://doi.org/10.1007/s00428-019-02616-7.
[47] Xu, Z.; Li, E.; Guo, Z.; Yu, R.; Hao, H.; Xu, Y.; Sun, Z.; Li, X.; Lyu, J.; Wang, Q. Design and Construction of a Multi-Organ Microfluidic Chip Mimicking the in Vivo Microenvironment of Lung Cancer Metastasis. ACS Appl. Mater. Interfaces 2016, 8 (39), 25840–25847. https://doi.org/10.1021/acsami.6b08746.
[48] Hassell, B. A.; Goyal, G.; Lee, E.; Sontheimer-Phelps, A.; Levy, O.; Chen, C. S.; Ingber, D. E. Human Organ Chip Models Recapitulate Orthotopic Lung Cancer Growth, Therapeutic Responses, and Tumor Dormancy In Vitro. Cell Rep. 2017, 21 (2), 508–516. https://doi.org/10.1016/j.celrep.2017.09.043.
[49] Jiang, L.; Ivich, F.; Tahsin, S.; Tran, M.; Frank, S. B.; Miranti, C. K.; Zohar, Y. Human Stroma and Epithelium Co-Culture in a Microfluidic Model of a Human Prostate Gland. Biomicrofluidics 2019, 13 (6), 064116. https://doi.org/10.1063/1.5126714.
[50] Choi, Y.; Hyun, E.; Seo, J.; Blundell, C.; Kim, H. C.; Lee, E.; Lee, S.; Moon, A.; Moon, W. K.; Huh, D. A Microengineered Pathophysiological Model of Early-Stage Breast Cancer. Lab. Chip 2015, 15 (16), 3350–3357. https://doi.org/10.1039/c5lc00514k.
[51] Vargo-Gogola, T.; Rosen, J. M. Modelling Breast Cancer: One Size Does Not Fit All. Nat. Rev. Cancer 2007, 7 (9), 659–672. https://doi.org/10.1038/nrc2193.
[52] Devadas, D.; Moore, T. A.; Walji, N.; Young, E. W. K. A Microfluidic Mammary Gland Coculture Model Using Parallel 3D Lumens for Studying Epithelial-Endothelial Migration in Breast Cancer. Biomicrofluidics 2019, 13 (6), 064122. https://doi.org/10.1063/1.5123912.
[53] PubChem. Paclitaxel. https://pubchem.ncbi.nlm.nih.gov/compound/36314 (accessed 2022-10-14).
[54] Imparato, G.; Urciuolo, F.; Netti, P. A. Organ on Chip Technology to Model Cancer Growth and Metastasis. Bioengineering 2022, 9 (1), 28. https://doi.org/10.3390/bioengineering9010028.
[55] Ashammakhi, N. A.; Elzagheid, A. Organ-on-a-Chip: New Tool for Personalized Medicine. J. Craniofac. Surg. 2018, 29 (4), 823–824. https://doi.org/10.1097/SCS.0000000000004604.