Le Slime®, une pâte gluante composée de polymères et de borax que les enfants (et les plus grands aussi !) apprécient pour son aspect étonnant tout gélatineux.
Synthèse
Préparation des solutions
Solution aqueuse d'alcool polyvinylique
- Chauffer 100 mL d’eau à 80 °C (ne pas porter l’eau à ébullition) dans un erlenmeyer de 250 mL.
- Ajouter très lentement 4 g d’alcool polyvinylique (PVA) (M > 100 000 g/mol) à l’eau chaude tout en agitant vigoureusement la solution. La solution doit être homogène (Cela dure environ 30 minutes).
- Une fois homogène, faîtes refroidir la solution à température ambiante (en s'aidant éventuellement d’un bain d’eau froide).
Solution de tétraborate de sodium (appelé également borax)
- Préparer environ 10 mL d’une solution aqueuse contenant 400 mg de borax par dissolution. La solution obtenue est une solution dite saturée, c'est-à-dire que l’on ne peut pas solubiliser davantage de ce solide dans l’eau. Elle est conservée dans ce bécher.
- Ajouter éventuellement un colorant alimentaire à la solution aqueuse de borax. Cela donnera de la couleur à votre Slime !
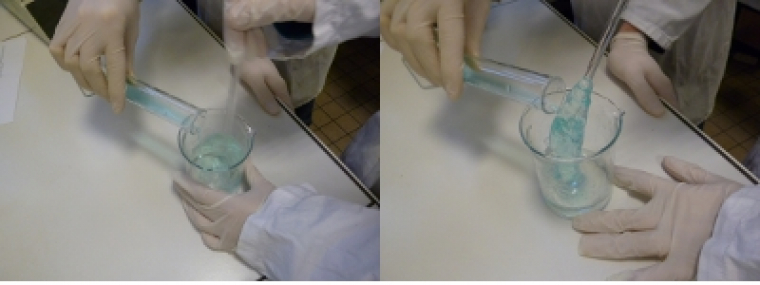
Préparation du Slime
- Ajouter lentement la solution de borax à la solution aqueuse de PVA tout en agitant à l’aide d’une baguette en verre ou d’une spatule. Cela prend en masse : c’est le Slime®
- Continuer à homogénéiser en tournant et en écrasant le gel contre les parois du bécher et mélanger vigoureusement jusqu'à obtention d'une pâte gluante mais non-collante.
- Sortir le Slime du bécher et le pétrir sur une table lisse et propre jusqu'à homogénéisation parfaite.
Remarques :
- Les proportions PVA/Borax sont très variables dans la littérature : de 4:1 jusque 30:1.
- Il est important d’avoir un PVA avec une masse molaire supérieure à 80 000 g/mol pour avoir un bon Slime®.
Quelques explications
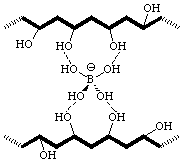
L'alcool polyvinylique ou PVA est un polymère formé de longues chaînes de carbone qui portent des groupements hydroxyle -OH. Par railleurs, le borax se transforme en B(OH)4- dans l'eau et va pouvoir établir des liaisons hydrogène avec l’alcool polyvinylique.
En effet, les liaisons O-H sont fortement polarisées et (comme dans l'architecture de l'eau) permettent la création d'un réseau de liaisons-H type O-H----O (voir figure ci-contre).
Les molécules de PVA sont donc reliées entre elles par l'intermédiaire du borax : on parle de réticulation. Ce gel réticulé possède des propriétés élastiques étonnantes :
- C'est un fluide non-newtonien rhéoépaississant : il devient plus visqueux avec l'agitation.
- Il coule sans se rompre si on l'étire doucement (ou sous l'action de son propre poids).
- Si on coupe ce gel, il suffit de rassembler les morceaux pour le reconstituer intégralement car la formation des liaisons-H est réversible.
- Il n'adhère pas aux parois lisses et laissé à lui même, il forme une flaque qui s’étale et donne un cercle quasiment parfait.
Ressource en ligne
Retrouvez Le Slime, sur scienceamusante.net et plein d'autres expériences de chimie!