Cet article en deux volets présente l'apport de la chimie dans l'agriculture moderne, en s'attachant plus particulièrement à décrire :
- la synthèse et l’impact des engrais azotés sur le rendement des cultures (1er volet, ci-dessous) ;
- la synthèse et l’impact des produits phytosanitaires sur le rendement des cultures (2ème volet).
Introduction
Les engrais sont des substances apportant aux plantes des nutriments qu’elles ne trouvent pas dans le sol en quantité suffisante ; ils sont utilisés dans le but de leur offrir une croissance optimale. Dans les engrais, les éléments fertilisants dits « majeurs » sont l’azote N, le phosphore P et le potassium K. Les éléments fertilisants dits « secondaires » sont le calcium, le magnésium, le sodium et le soufre.
On distingue :
- les engrais organiques, d’origine animale (comme le fumier) ou végétale (compost, algues…) ;
- les engrais minéraux, qui peuvent être issus de gisements naturels ou synthétisés par l’industrie chimique. Leur composition est variable : ils peuvent contenir un ou plusieurs éléments fertilisants.
On s’intéresse dans ce volet aux engrais azotés.
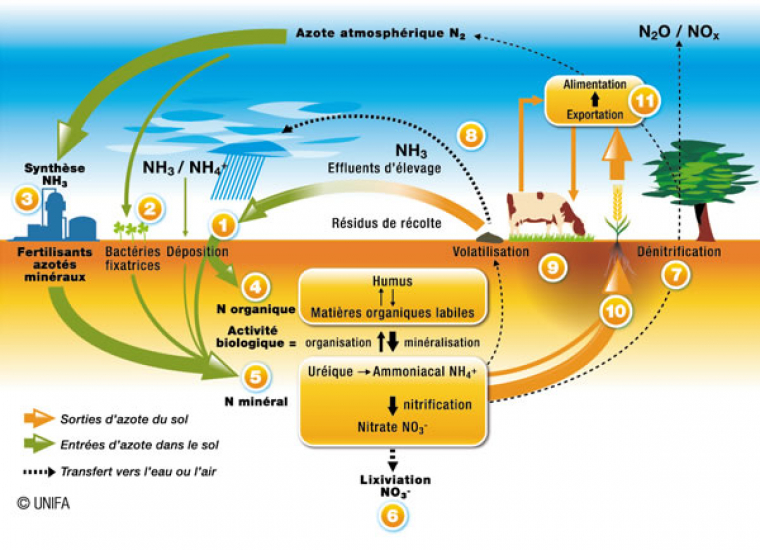
Cycle de l’azote
L’élément azote est nécessaire à la vie de nombreux organismes, car il est un composant essentiel des protéines. Si le diazote est extrêmement répandu, puisqu’il constitue 80 % de l’atmosphère, il est très peu réactif et peu d’êtres vivants peuvent l’assimiler directement : l’élément azote doit donc leur être fourni sous d’autres formes. Les hommes et les animaux l’intègrent à travers leur alimentation, sous la forme d’acides aminés ou de protéines.
À l’exception des légumineuses (haricot, pois, soja…) qui parviennent, grâce à un mécanisme de symbiose avec des micro-organismes, à fixer le diazote atmosphérique, la plupart des végétaux, bases de la chaîne alimentaire, ne peuvent l’absorber comme ils absorbent le CO2 atmosphérique : la majorité de l’azote nécessaire à la croissance de la plante est donc prélevée dans le sol par les racines. L’humus a une teneur de 5 % en azote organique mais celui-ci n’est malheureusement pas totalement assimilable par les plantes. Cet azote organique doit subir, sous l’action de micro-organismes :
- un processus de minéralisation, conduisant à des ions ammonium NH4+, difficilement assimilables par les plantes ;
- puis un processus de nitrification, conduisant via l’oxydation par le dioxygène de l’air, à des ions nitrates NO3–, qui sont facilement assimilables par les plantes.
Les ions nitrates, après pénétration dans la plante par les racines, constituent la source d’azote pour la synthèse de ses protéines.
Les processus de minéralisation et de nitrification dépendent de nombreux facteurs, notamment l’humidité et la température du sol, sa teneur en argile et en calcaire et son activité biologique. Cela conduit à des apports naturels en azote très variables selon l’année et le lieu.
On a alors cherché, à intégrer l’azote minéral aux engrais, afin de le fournir aux plantes en quantité suffisante. L’un des précurseurs nécessaires à la synthèse des engrais azotés est l’ammoniac, composé de formule NH3. On s’intéresse donc dans un premier temps à sa synthèse, dont la conception a donné lieu à l’attribution du Prix Nobel de Chimie en 1918.
Prix Nobel de chimie 1918 : synthèse de l'ammoniac
La première synthèse efficace de l’ammoniac a été initiée par le chimiste allemand Fritz Haber, via une réaction entre le dihydrogène et le diazote, d’équation :
N2(g) + 3 H2(g) ⇄ 2 NH3(g)
(réaction exothermique, ∆rH° = - 92,4 kJ.mol-1 à 25 °C)
Cette réaction présente un rendement assez faible. Elle possède en outre deux caractéristiques : elle est exothermique, et son avancement fait diminuer le nombre de moles de gaz (on passe de 4 à 2). Afin de déplacer l'équilibre dans le sens direct, on applique les lois de Van’t Hoff et de Le Châtelier :
- la relation de Van’t Hoff prévoit qu'une réaction exothermique est favorisée par un abaissement de la température. En effet, en notant K° la constante d’équilibre de la réaction, on a :
$$\frac{dln(K^0)}{dT}=\frac{Δ_{r}H^0}{RT^2}$$
de sorte que K° augmente lorsque T diminue, car ∆rH° < 0 pour une réaction exothermique ;
- la loi de Le Châtelier stipule qu'une augmentation de pression va dans le sens d'une diminution du nombre de moles en phase gazeuse.
Haber a donc amélioré le taux de transformation de la réaction en abaissant la température et en augmentant la pression.
De plus, le taux de transformation est encore augmenté en utilisant un catalyseur : il s’agit d’un oxyde de fer produit à partir de fer α, de structure cubique centrée. Celui-ci est formé par réduction de la magnétite (minerai constitué principalement de Fe3O4), d’abord en wüstite (constituée principalement de FeO), puis en fer α. Il est très finement divisé afin d'augmenter la surface de contact. À ce catalyseur à base de fer sont parfois adjoints d’autres catalyseurs - souvent des oxydes d’aluminium, de calcium, de magnésium et de potassium. Ces catalyseurs accélèrent la réaction, ce qui permet de réutiliser davantage de fois les réactifs sur un laps de temps équivalent : en effet, lors de la réaction, l'équilibre est déplacé dans le sens direct en soustrayant l’ammoniac formé du milieu réactionnel (en [2]), puis les réactifs restant à la fin de la réaction sont récupérés et réinjectés dans le réacteur [1].
Toutefois, la réaction s’effectue très lentement à trop basse température : il a donc fallu trouver un compromis, vers 450 °C, le catalyseur ne pouvant pas agir à basse température. Dans des conditions de pression entre 15 et 25 MPa et de température entre 300 et 550 °C, le taux de conversion est de 15 % à chaque cycle ; les réactifs restant en [2] étant réintroduits dans le réacteur [1], le taux de conversion final est de 98 %.
Haber dépose un brevet en 1908 et reçoit le Prix Nobel de chimie pour ce procédé de synthèse en 1918.
Principaux engrais azotés
L’ammoniac peut être utilisé comme engrais, sous la forme de gaz liquéfié sous pression injecté directement dans le sol. Si cette pratique est relativement fréquente aux Etats-Unis, elle n’est pas employée en France, où deux engrais azotés sont très couramment utilisés : le nitrate d’ammonium et l’urée. Ils sont tous deux synthétisés à partir d’ammoniac. Le choix de l’un ou l’autre (ou d’un mélange des deux) dépend de la nature de l’espèce végétale cultivée et de la composition du sol.
Nitrate d'ammonium
Le nitrate d’ammonium est un composé ionique de formule NH4NO3, formé du cation ammonium NH4+ et de l’anion nitrate NO3-. C’est un oxydant puissant. S’il se révèle utile pour fabriquer certains explosifs, son usage est surtout reconnu en tant qu’engrais : en effet, le développement de son utilisation a permis dès le début du XXème siècle une augmentation significative des rendements de culture.
Le nitrate d’ammonium est synthétisé à partir de l’ammoniac et de l’acide nitrique par une réaction acido-basique entre l’ammoniac gazeux et une solution concentrée d’acide nitrique :
NH3(g) + HNO3(aq) ⇄ NH4+(aq) + NO3–(aq)
On obtient dans un premier temps une solution aqueuse concentrée de nitrate d’ammonium. L’élimination de l’eau permet d’obtenir le nitrate d’ammonium sous forme de poudre ou de granulés.
L’acide nitrique lui-même est produit par oxydation de l’ammoniac en trois réactions successives (oxydation de l’ammoniac en oxyde d’azote, oxydation de l’oxyde d’azote en dioxyde d’azote et dismutation du dioxyde d’azote en présence d’eau) :
4 NH3(g) + 5 O2(g) ⇄ 4 NO(g) + 6 H2O(ℓ)
2 NO(g) + O2(g) ⇄ 2 NO2(g)
3 NO2(g) + H2O(ℓ) ⇄ 2 HNO3(ℓ) + NO(g)
Le terme ammonitrate est généralement employé pour désigner les engrais à base de nitrate d’ammonium : il s’agit de nitrate d’ammonium additionné à un composé neutre comme la craie ou le kieselguhr (roche sédimentaire siliceuse, très poreuse) afin de le fixer et de ralentir sa dégradation. La réglementation européenne indique que le terme ammonitrate est toutefois réservé aux mélanges dont la teneur massique totale en azote est d’au moins 20 %.
En fonction de la teneur en azote, on distingue :
- les ammonitrates à moyen dosage (teneur massique totale en azote comprise entre 20 et 28%) ;
- les ammonitrates à haut dosage (teneur massique totale en azote comprise entre 28 et 33,5%).
En France, l’ammonitrate représente 40 % des engrais utilisés. Cependant, s'il est utile dans une certaine mesure à la croissance des plantes, il se révèle toxique à haute dose, pour les animaux et pour les végétaux.
Le nitrate d’ammonium est un solide très soluble dans l’eau (sa solubilité vaut 1900 g.L-1 à 20°C), ce qui rend sa pénétration facile dans les sols. Il constitue une double source d’azote minéral, via l’ion ammonium et l’ion nitrate. Comme mentionné plus haut, l’ion nitrate NO3– présente l’avantage d’être directement assimilé par les plantes ; il est toutefois facilement entraîné en profondeur par les eaux de pluie en cas de fortes précipitations : on parle alors de lixiviation ou de lessivage. Cela génère une pollution des nappes phréatiques et des cours d’eau et rend une partie de l’azote de l’ammonitrate indisponible pour les plantes. Pour cette raison, l’ammonitrate n’est pas adapté aux zones sujettes à de fortes chutes de pluie, comme les pays tropicaux par exemple.
L’ion ammonium NH4+ est assimilé plus lentement par les plantes et doit généralement subir une oxydation préalable en ion NO3–. En revanche, il présente l’avantage d’être mieux retenu dans les argiles du sol, via des interactions électrostatiques ; il est donc moins sujet au lessivage.
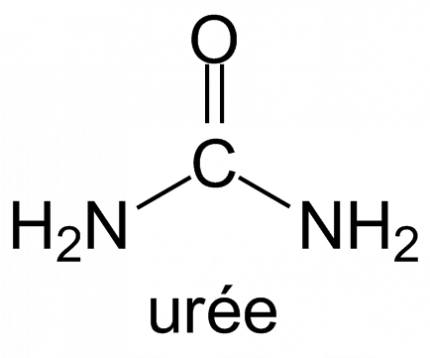
Urée
L’urée, de formule CO(NH2)2, est une molécule présente chez beaucoup d’êtres vivants, aujourd’hui synthétisée par réaction du dioxyde de carbone CO2 sur l’ammoniac sous haute pression. Le carbamate d’ammonium NH2CO2–, NH4+ formé dans une première étape est ensuite déshydraté en urée :
CO2(g) + 2 NH3(g) ⇄ NH2CO2–, NH4+
NH2CO2–, NH4+ ⇄ CO(NH2)2 + H2O(ℓ)
Historiquement, la première synthèse de l’urée a été réalisée en 1828 par le chimiste allemand Friedrich Wöhler en faisant réagir l’acide cyanique NCOH sur l’ammoniaque (solution aqueuse d’ammoniac). Le cyanate d’ammonium obtenu s’isomérise alors pour former l’urée :
NH3 + NCOH ⇄ NH4+ + CNO–
NH4+ + CNO– ⇄ CO(NH2)2
L’urée est particulièrement riche en azote, puisque celui-ci y est présent à 46 % en masse. Il s’avère donc être un composé particulièrement intéressant pour la formulation d’engrais : 90 % de l’urée de synthèse y est destiné. L’urée peut être utilisée sous la forme de granulés ou bien sous la forme d’une solution aqueuse d’urée et de nitrate d’ammonium.
L’assimilation par la plante nécessite au préalable une hydrolyse de l’urée en ion ammonium et dioxyde de carbone CO2, catalysée par l’uréase, enzyme présente dans des bactéries du sol, suivie du processus de nitrification conduisant aux ions nitrates. L’usage de l’urée a tendance à modifier le pH des sols ; il est donc important de le surveiller afin de conserver leur équilibre acido-basique.
Le marché des engrais azotés d’hier à aujourd'hui
La quantité totale d’engrais azotés utilisée a grandement augmenté au cours des quatre dernières décennies. On peut également constater que les engrais produits ont largement changé au fil du temps : la suprématie de l’ammoniac synthétique est difficilement contestable, aux dépends d’autres substances.
|
Années |
Nitrate du Chili |
Guano |
Sulfate d'ammonium (NH4)2SO4 |
Cyanamide calcique CaNCN |
Ammoniac synthétique |
Total |
|---|---|---|---|---|---|---|
|
1850 |
5 |
- |
0 |
0 |
0 |
5 |
|
1860 |
10 |
70 |
0 |
0 |
0 |
80 |
|
1880 |
50 |
30 |
0 |
0 |
0 |
80 |
|
1900 |
220 |
20 |
120 |
0 |
0 |
360 |
|
1920 |
410 |
10 |
290 |
70 |
150 |
950 |
|
1940 |
200 |
10 |
450 |
290 |
2150 |
3100 |
|
1960 |
200 |
- |
950 |
300 |
9540 |
10990 |
|
1980 |
90 |
- |
970 |
250 |
59290 |
60600 |
|
2000 |
120 |
- |
370 |
80 |
85130 |
85700 |
Le nitrate du Chili désigne le nitrate de sodium NaNO3. Il a été extrait au milieu du XIXème siècle des sous-sols des plateaux chiliens, et était utilisé pour la synthèse d’engrais azotés ou directement en tant que tel avant l’invention du procédé Haber.
Le guano est le nom donné aux excréments des oiseaux marins, très riches en composés azotés. Récolté au XIXème siècle au Pérou, il fut à cette période une immense source de revenus pour certains exploitants, et rapporta énormément d’argent au Pérou qui détenait le monopole pour le marché de cet engrais. Il contient 16 % d'azote en masse.
Le cyanamide calcique CaNCN génère de l’ammoniac, via une réaction d’hydrolyse d’équation : CaCN2 + 3 H2O ⇄ 2 NH3 + CaCO3. Le processus de nitrification conduit ensuite aux ions nitrates.
En France, la consommation actuelle d’azote est de 84,6 kg par hectare et par an (valeur de 2013). Sur le plan mondial, les consommations d’engrais en 2013, en milliers de tonnes d'azote, sont regroupés dans le tableau ci-dessous en fonction des différents engrais azotés et des différents pays :
|
Engrais |
Monde |
Chine 2013 |
Inde |
États-Unis 2013 |
Union Européenne 2010 |
France 2013 |
|
|---|---|---|---|---|---|---|---|
| 1973-1974 | 2013 | ||||||
|
Urée |
8 330 |
63 174 |
24 300 |
14 076 |
2 511 |
2 168 |
341 |
|
Ammonitrate |
7 300 |
6 733 |
0 |
0 |
254 |
2 084 |
637 |
|
Phosphates d’ammonium |
1 023 |
7 930 |
3 200 |
1 324 |
645 |
208 |
59 |
|
Ammoniac |
3 580 |
4 202 |
0 |
0 |
3 349 |
5 |
0 |
|
Solutions d’urée et de nitrate d’ammonium |
2 120 |
5 600 |
0 |
0 |
3 201 |
1 280 |
708 |
|
Sulfate d’ammonium |
2 760 |
3 462 |
290 |
101 |
277 |
319 |
18 |
| TOTAL | 39220 | 110 503 | 35 010 | 16 750 | 11 690 | 10 894 | 2 207 |
Le sulfate d’ammonium (NH4)2SO4 est un sous-produit de la fabrication de plusieurs composés d'usage industriel, comme l'acrylonitrile, mais il peut également être synthétisé à partir d'ammoniac et d'acide sulfurique H2SO4.
Les phosphates d’ammonium sont obtenus par réaction de l’acide phosphorique H3PO4 sur l’ammoniac NH3 :
3 NH3(aq) + H3PO4(aq) ⇄ (NH4)3PO4(s)
On les trouve également sous forme diammonnique (NH4)2HPO4 et sous forme monoammonique (NH4)H2PO4, la conversion entre les deux formes étant possible par ajout d’ammoniac ou d’acide phosphorique selon le besoin.
Les chiffres concernant la production et l’exportation, en 2013, par pays et en milliers de tonnes d'azote, sont consignés dans le tableau ci-dessous :
|
|
Chine |
Inde |
Etats-Unis |
Russie |
Canada |
Indonésie |
Monde |
|---|---|---|---|---|---|---|---|
|
Production |
36 621 |
12 409 |
10 370 |
6 919 |
3 225 |
3 173 |
112 377 |
|
Exportation |
5 527 |
0 |
1 652 |
5 144 |
1 351 |
596 |
35 252 |
Les principaux pays importateurs sont, en 2013, les États-Unis, l’Inde, le Brésil, la France, la Thaïlande et l’Allemagne.
Amélioration réfléchie des rendements de culture
Dans sa période de croissance maximale, un hectare de blé consomme chaque jour 2 kg d’azote, 6 kg de potassium sous la forme K2O et 1 kg de phosphore sous la forme P2O5. On voit donc clairement l’importance de l’apport de ces nutriments sous forme d’engrais. Ce complément permet de répondre à une demande de rendement de plus en plus élevée ; toutefois apporter les nutriments nécessaires ne suffit pas à assurer la bonne croissance de la plante : les apporter au bon moment permet d’avoir une meilleure efficacité et donc de diminuer les apports inutiles. En effet, la dynamique d’absorption se modifie tout au long de la vie de la plante. Il est donc important d’utiliser les engrais en complément des apports naturels (offre du sol) au moment où les prélèvements par la plante sont les plus efficaces. Le graphe ci-dessous montre un exemple d’apport fractionné pour un champ de blé.
Perpectives
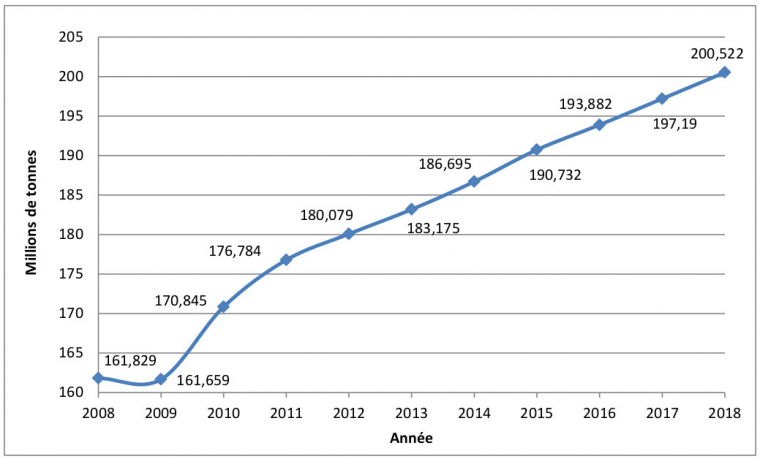
Selon une étude de la FAO (Food and Agriculture Organization of the United Nations) publiée en 2015, la consommation d’engrais devrait croître dans les prochaines années, du fait de l’augmentation de la population mondiale et du besoin de produire suffisamment de produits agricoles pour la nourrir.
les valeurs des années 2008 à 2015 correspondent à la consommation réelle ; les valeurs des années 2016 à 2018 correspondent à des prévisions
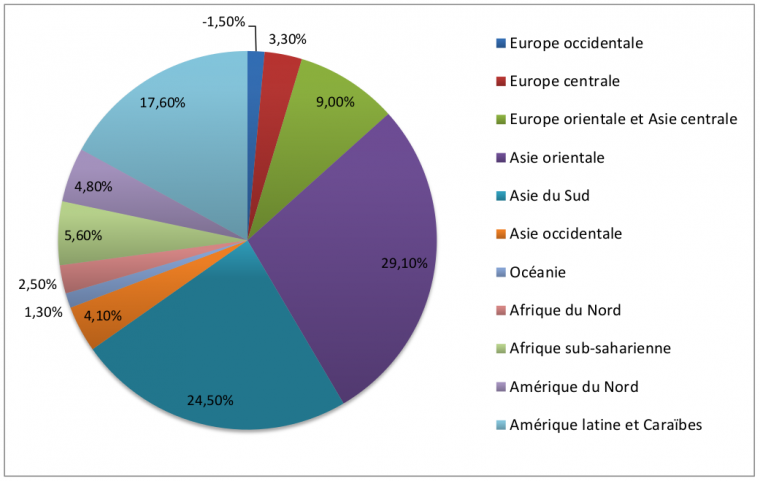
Si l’on s’intéresse plus particulièrement aux engrais azotés, la FAO prévoit, en 2015, une augmentation de la consommation mondiale de 1,4 % par an, sur la période 2014-2018. Sur cette période, la FAO prévoit que la consommation baissera en Europe Occidentale (du fait de la volonté de s’orienter vers un mode d’agriculture plus durable) mais augmentera dans toutes les autres régions du monde.
L’apport de l’industrie chimique pour la production d’engrais en quantité suffisante est donc crucial.
Toutefois, une réflexion doit être menée sur les quantités d’engrais utilisées, du fait de la contamination des eaux douces par les ions nitrates en aval des bassins agricoles, et du risque d’eutrophisation des milieux aquatiques, pollution par excès de nutriments – qui modifie l’abondance et la diversité des espèces, entraîne la prolifération d’algues et l’apparition de zones mortes privées d’oxygène.
Bibliographie
- RAPPORT D’ÉTUDE N° 65281 du 02/05/2005 de l’INERIS, intitulé Les engrais solides à base de nitrate d’ammonium.
- Albert DAUJAT, Jean HEBERT, Jean-Claude IGNAZI, Philippe ÉVEILLARD, « ENGRAIS ». In Universalis éducation [en ligne]. Encyclopædia Universalis, consulté le 13 mars 2017.
- La synthèse de l’ammoniac : une arme à deux tranchants, magazine de l'OMPI
- La chimie et l'alimentation, éditions EDP Sciences, octobre 2010.
- Fundamentals of environmental and toxicological chemistry, Stanley E. Manahan.
- Urée, Société chimique de France
- Ecological agriculture project
- Unifa
- Avec l’Unifa, parlons Fertilisation
- World fertilizer trends and outlook to 2018, FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS, 2015.