Cet article en deux volets présente la bioélectrochimie ainsi que son application à l'étude de phénomènes cellulaires.
Le premier volet (ci-dessous) présente la bioélectrochimie et ses outils essentiels pour sonder le vivant.
Le deuxième volet présente deux exemples de l'utilisation de ces outils à l'étude des phénomènes cellulaires.
Bioélectrochimie et Ultramicroélectrodes
Bioélectrochimie : éléments de définition
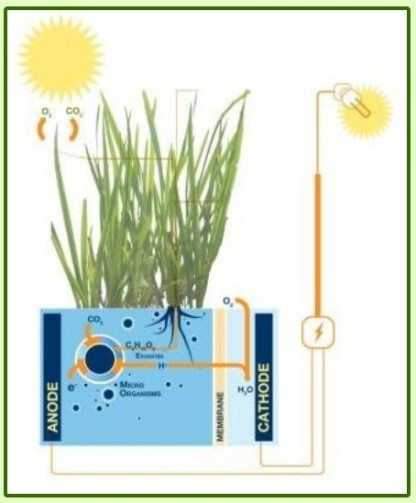
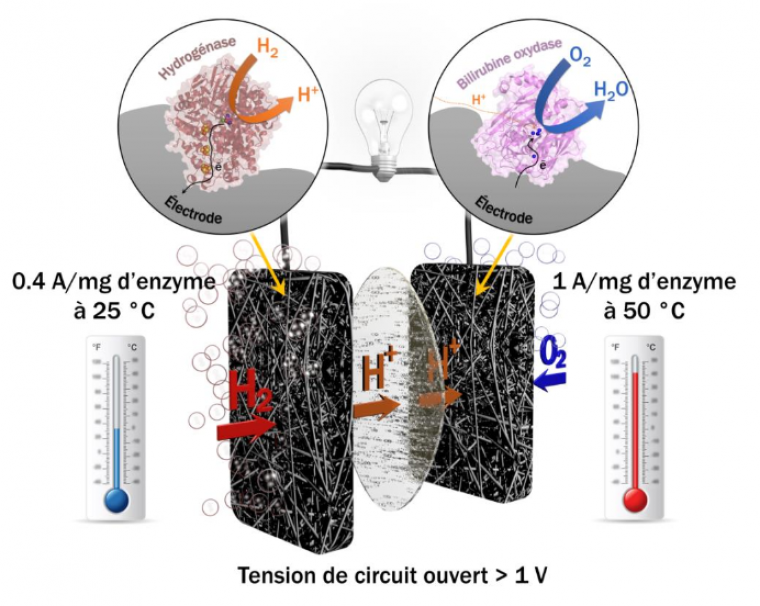
Etymologiquement, la discipline bioélectrochimie ressemble à une sous-discipline de l’électrochimie qui manie ses concepts et théories pour les appliquer au vivant1. Deux sociétés de bioélectrochimie ont d’ailleurs été fondées au XXème siècle sur ces bases. L'une, internationale, créée en 1979 par Giulio Milazzo [1], la Bioelectrochemical Society, qui promeut la « compréhension et coopération entre scientifiques intéressés par l'application de concepts et de techniques électrochimiques à l'étude fondamentale ou appliquée des systèmes vivants ». La seconde est le Groupe Français de Bioélectrochimie qui a fêté ses 30 ans en septembre 2016 et œuvre en 2018 à faire vivre les thématiques suivantes : les biocapteurs, les biopuces, les électrodes modifiées, la bioconversion énergétique et les biopiles, le biomimétisme, l'électrochimie couplée au milieu vivant et enfin les matériaux pour la bioanalyse. Depuis les débuts de l'électrochimie, les liens entre électricité et milieu biologique sont très importants à travers la controverse Galvani/Volta1. En effet, les mécanismes de transfert d’électrons (à l’origine de l’électricité) sont des réactions essentielles dans le monde du vivant (notamment dans la photosynthèse et la respiration). Le domaine de la bioélectrochimie reste vaste et ouvert et regroupe des sujets variés. On peut citer le projet Plant Power (Figure 1) qui a débuté en 2008 et vise à développer des piles vertes et vivantes fonctionnant grâce à des bactéries [2] ou les biopiles enzymatiques H2/O2 développées par des équipes de chercheurs à Marseille et à Bordeaux qui ont récemment produit une biopile aussi efficace qu'une pile à combustible au platine (Figure 2) [3]. Ce domaine recouvre également l'électroanalyse, les biocapteurs à glucose et à ADN, l'électroporation2 et l'électrophysiologie3.
Les Ultramicroélectrodes : définitions, propriétés et applications
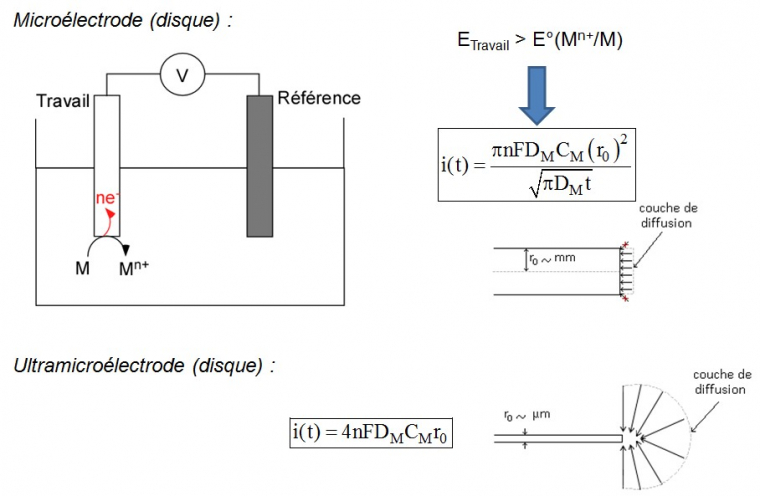
Lorsque l'on parle d'électrochimie ou de bioélectrochimie, il faut définir l'outil essentiel à l'expérimentateur qui est l'électrode. Usuellement, il s’agit d’une électrode millimétrique (un disque d’environ 1 mm de rayon) plongée dans quelques ml de solution. Dans cette configuration, le courant à l'électrode est défini par la loi de Cottrell et dépend du temps :
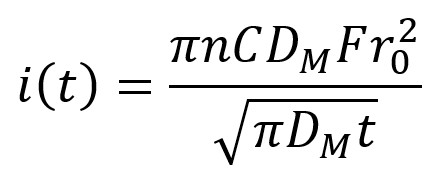
Où n est le nombre d'électrons échangés dans la réaction faradique considérée, F est la constante de Faraday, CM est la concentration de l'espèce considérée, r0 est le rayon de l'électrode, DM est le coefficient de diffusion de l'espèce et t est la variable temporelle.
L'expérience typique consiste à travailler en chronoampérométrie avec une espèce électroactive, c'est à dire susceptible d'être oxydée ou réduite à la surface de l'électrode. On applique alors un potentiel, par exemple suffisamment positif dans le cas d'une oxydation, de telle sorte ici qu'on puisse oxyder aisément l'espèce. Le phénomène cinétiquement déterminant est le transfert de masse de l'espèce oxydante (dans le cas d'une oxydation) du sein de la solution vers la surface de l'électrode. Le profil géométrique du transport des espèces à la surface de l'électrode est dit plan c'est-à-dire que les lignes de déplacement des espèces réagissant à l’électrode sont perpendiculaires à sa surface. Une conséquence est que le courant i(t) recueilli est dépendant du temps avec i(t) inversement proportionnel à la racine carrée du temps t.
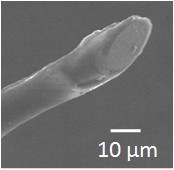
Les électrodes de dimension micrométrique (un disque de rayon ~ 1 µm) présentent des propriétés physico-chimiques particulières. En effet, dans ce cas, les lignes de déplacement des espèces vers l’électrode ne sont plus uniquement perpendiculaires à la surface. Elles forment une demi-sphère, ce qui implique que le courant qui traverse l’électrode ne dépend plus du temps. Ce régime est dit stationnaire (Figure 3). Ces propriétés particulières sont indirectement liées à la taille micrométrique de ces électrodes et découlent aussi de la configuration expérimentale (échelle de temps, convection). Pour différencier ces électrodes des autres, on les a nommées ultramicroélectrodes1.
Comparaison du comportement d'une microélectrode (loi de Cottrell avec diffusion plane des espèces à l'électrode) et d'une ultramicroélectrode (loi des ultramicroélectrodes disques avec diffusion sphérique à la surface). Avec l'aimable autorisation de Mr Frédéric Lemaître pour les images.
Dans cette formule :
- n est le nombre d'électrons échangés dans la réaction faradique considérée d'oxydation,
- F est la constante de Faraday,
- CM est la concentration de l'espèce considérée,
- r0 est le rayon de l'électrode,
- DM est le coefficient de diffusion de l'espèce et t est la variable temporelle.
En bref, ces objets de détection analytique présentent quatre caractéristiques majeures. Premièrement, ces ultramicroélectrodes présentent une faible constante de temps, celle-ci étant proportionnelle à leur rayon. Ainsi elles possèdent un temps de réponse rapide de l’ordre de la ms et lorsqu'elles subissent un changement de condition expérimentale (variation du potentiel qui leur est imposé par exemple), leur inertie est négligeable et elles peuvent donc détecter des phénomènes rapides. Deuxièmement, de par l'existence de ce régime stationnaire cité ci-dessus, leur courant est sensible uniquement à la variation de concentration de l'espèce électroactive détectée. Troisièmement, elles présentent un excellent rapport signal/bruit proportionnel à l'inverse de leur rayon, ce qui leur permet de détecter de très faibles courants (de l'ordre du pA au nA soit 10-12 à 10-9 ampères). Quatrièmement, elles ont des dimensions compatibles avec l’échelle cellulaire (du micromètre à la dizaine de microns, Figure 4), ce qui autorise leur approche physique au voisinage d'un objet vivant isolé de dimensions micrométriques. Tout ceci en a fait des outils de choix pour leur utilisation dans la détection de la sécrétion cellulaire, notamment lors de l'exocytose. Ces ultramicroélectrodes ont émergé à la fin des années 1980 et au début des années 1990, quand leur fabrication et les lois théoriques qui régissent leur comportement physico-chimique particulier ont été mises au point et découvertes [4].
Applications à l'exocytose ou communication cellulaire
Exocytose et communication cellulaire : étapes, régulation et analyse
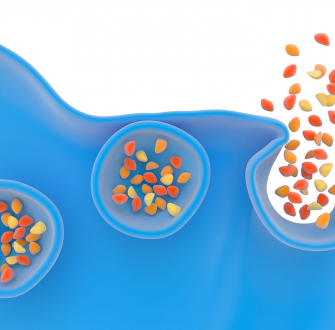
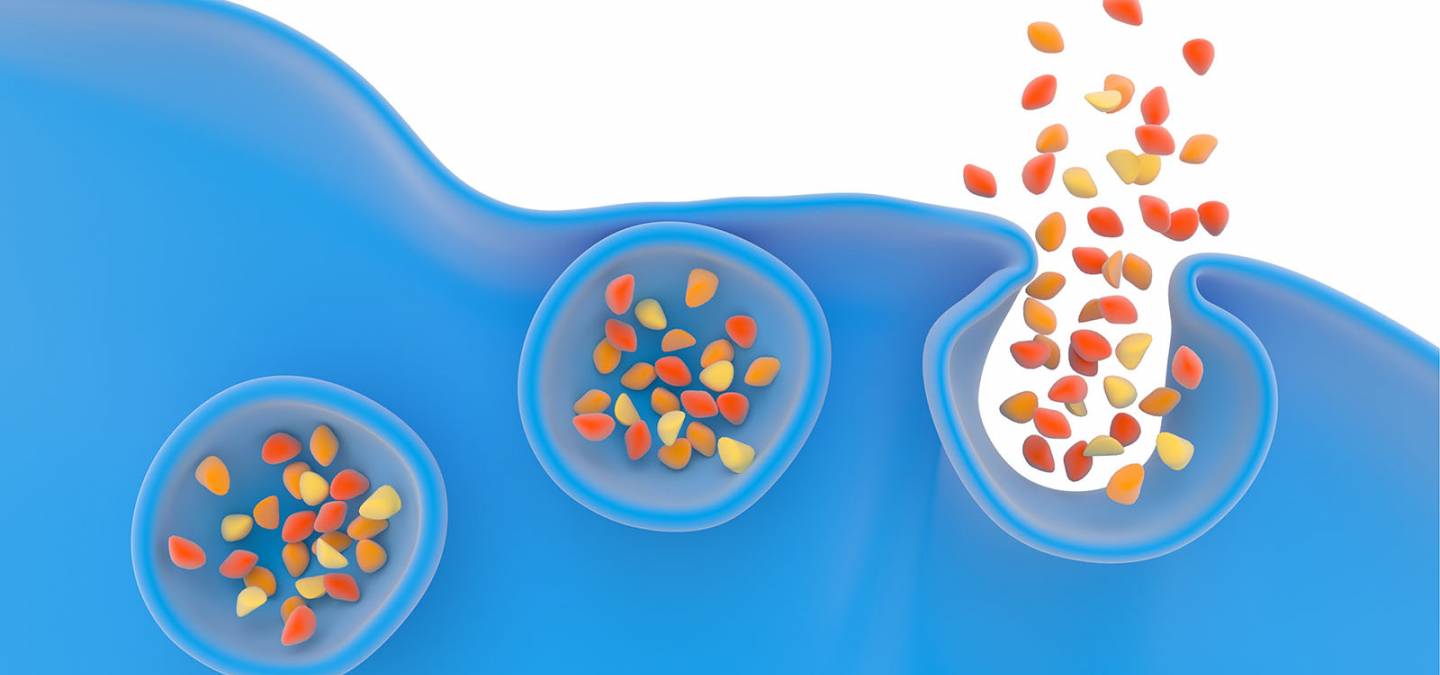
Étymologiquement, l'exocytose signifie « hors de la cavité ou cellule ». C'est en effet le mécanisme par lequel la cellule libère de larges biomolécules à travers sa membrane par le biais de vésicules de sécrétion de dimensions nanométriques qui viennent fusionner avec sa membrane pour relarguer leur contenu. Ce mécanisme de communication cellulaire majeur est régulé et contrôlé par de nombreux facteurs, il intervient dans la transmission de l’information dans le système nerveux ou hormonal. Dans le cas du système nerveux, on peut citer l'expulsion des neuromédiateurs des vésicules synaptiques des neurones dans la fente synaptique et dans le deuxième cas, le relargage des hormones dans le sang. Par exemple dans le système hormonal, des catécholamines sont libérées par les cellules chromaffines de la glande surrénale située au-dessus des reins et responsables de la gestion du stress dans les organismes vivants.
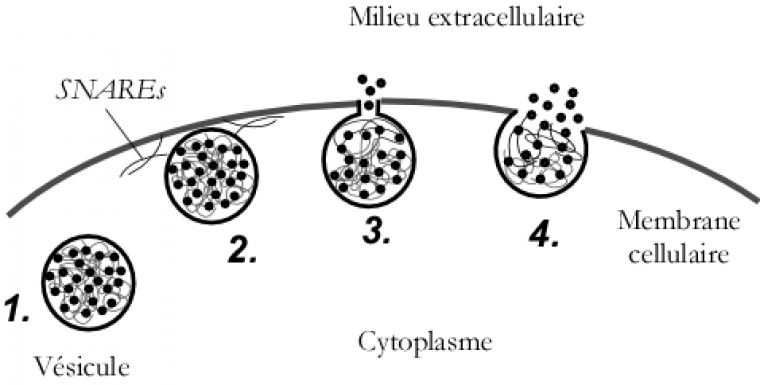
La succession des différentes étapes de l'exocytose est assez bien connue (Figure 5). Il s'agit du déplacement des vésicules (de diamètre environ 80-150 nm selon les types cellulaires) dans le cytoplasme cellulaire (le milieu interne des cellules délimité par leur membrane plasmique) (Figure 5 - étape 1) puis l'accostage et l'arrimage des vésicules à la membrane cellulaire (exactement comme le ferait un navire via des amarres qui sont ici des attaches de nature protéique) (Figure 5 - étape 2). S'ensuit la formation d'un canal nanométrique (2-3 nm) entre l'intérieur de la vésicule et le milieu extracellulaire, appelé pore de fusion (Figure 5 - étape 3), et enfin la fusion de la vésicule dans la membrane cellulaire (Figure 5 - étape 4). La libération des biomolécules débute dès la formation du pore de fusion.
Néanmoins, il subsiste de nombreux débats sur les facteurs de régulation de ce phénomène. Comme, par exemple, sur le déplacement et le transport des vésicules via le réseau d'actine ou le cytosquelette (à quelle vitesse et par quels mécanismes ces vésicules se déplacent ?) ; ou sur la dynamique et la stabilité du pore de fusion (comment et pourquoi s'ouvre-t-il ? quelle est sa stabilité ? comment et pourquoi explose-t-il pour mener à une fusion ?) ; ou encore sur les mécanismes du « baiser volé »1. Il est crucial de connaître le fonctionnement de ces mécanismes et de comprendre ses facteurs de régulation dans un but fondamental mais aussi thérapeutique, vu l'importance de la communication cellulaire dans le vivant. Il est intéressant de noter que la régulation se fait par le biais de facteurs biologiques et de facteurs physico-chimiques qui agissent de manière concertée et parallèle. Les facteurs biologiques sont essentiellement des protéines telles que des assemblages nommés « SNAREs », et d’autres « protéines clés » appelées de noms énigmatiques ou poétiques, comme « syntaxine, SNAP 25, VAMP ou Munc 18 ». Elles sont localisées dans la membrane vésiculaire et cellulaire. La nature du stimulus : ion calcium ou d’autres sécrétagogues2 jouent aussi un rôle. Parmi les facteurs de contrôle physico-chimique de la communication cellulaire on peut mentionner les propriétés membranaires comme la nature des phospholipides3 composant les membranes, la viscosité ou la tension de membrane, sa courbure mais aussi le pH et la composition de l’environnement extracellulaire [5].
Configuration expérimentale et nature des signaux enregistrés sur cellules
L’ultramicroélectrode est utilisée pour détecter la sécrétion de biomolécules électroactives sur cellule unique dans une configuration expérimentale de minimisation de la distance entre la cellule émettrice et l’ultramicroélectrode. Ceci est réalisé dans une cage de Faraday, au laboratoire, pour minimiser le bruit électrique vu la petitesse des courants détectés (quelques picoampères). Les cellules vivantes (une dizaine de microns de diamètre) sont cultivées dans une boîte de Petri dans un incubateur et de telle sorte qu’elles soient suffisamment isolées les unes des autres au fond de la boîte, puisque la détection se fait sur cellule unique (Figure 6). Le jour de l’expérience, cette boîte est placée sur la plateforme de détection d’un microscope inverse. Des micromanipulateurs (de réglage fin, avec une précision submicrométrique) permettent l’approche précise de l’ultramicroélectrode au voisinage immédiat d’une cellule vivante isolée choisie, dans la boîte de Petri en verre ou en plastique. La cellule est observée en transparence grâce au microscope inverse. L’ultramicroélectrode est reliée à un potentiostat placé au potentiel d’oxydation de l’espèce détectée. La distance finale entre l’ultramicroélectrode, ici le capteur, et la cellule, ici l’émetteur, est de l’ordre de quelques centaines de nanomètres. Pourvu que la cellule émette des espèces électroactives, la détection sera rendue possible grâce à cette configuration. En effet, même si des femtomoles (10-15 moles) sont émises dans un tout petit volume (ici de l’ordre du picolitre, soit 10-12 litres), la concentration résultante sera de l’ordre du millimolaire, soit 10-3 mol/l, ce qui est une concentration aisément détectable par l’électrochimiste analyticien. En effet, le courant faradique (c’est à dire résultant d’une oxydation ou d’une réduction) détecté est proportionnel à la concentration des espèces électroactives émises selon la loi du courant stationnaire de l’ultramicroélectrode disque décrite plus haut.
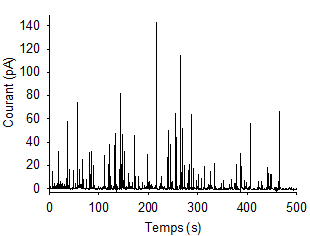
Chronoampérogramme avec succession de pics ampérométriques obtenu sur cellule vivante unique analysée avec une ultramicroélectrode.
Les signaux enregistrés se nomment des « chronoampérogrammes », il s’agit de la mesure de courant au cours du temps à potentiel fixe. Ce potentiel imposé est par exemple de l’ordre de 650 mV (différence de potentiel avec une électrode de référence Ag/AgCl) dans le cas de la détection de catécholamines par des cellules chromaffines qui sont présentes dans la glande surrénale pour la gestion du stress, comme vu ci-dessus. Les chronoampérogrammes obtenus par cette technique d'ampérométrie se présentent comme une succession de pics de courant de taille et largeur variable et représentent la sécrétion cellulaire, chaque pic représentant l’exocytose d’une seule vésicule sécrétrice (Figure 7). De part cette configuration expérimentale simple et ces signaux ampérométriques collectés, on peut analyser très finement la sécrétion cellulaire en accédant à la dynamique et à la quantité de molécules libérées. Il suffit pour cela d'analyser un par un chaque pic ampérométrique d’exocytose détecté individuellement. Ces pics ont la forme de triangle asymétrique avec une montée rapide et une décroissance lente. L’aire, la hauteur et la largeur de ces pics renseignent sur la sécrétion.
Ces expériences permettent une compréhension analytique pointue de la neurotransmission en donnant accès par l’analyse des pics de sécrétion à la fréquence de sécrétion cellulaire, la vitesse du phénomène et la quantité de biomolécules par vésicules. Comme nous allons le voir ci-après dans le cas de la courbure membranaire, les informations collectées renseignent également sur les facteurs physico-chimiques de régulation cités plus haut comme l’osmolarité, la température, le pH, la composition membranaire, la viscosité et le pore de fusion membranaire.
Références
[1] http://www.bioelectrochemical-soc.org/
[2] https://www.espace-sciences.org/sciences-ouest/288/dossier/des-piles-vertes-et-vivantes
[3] http://www2.cnrs.fr/sites/communique/fichier/cp_biopiles_web.pdf
[4] Heinze J., Ultramicroelectrodes in Electrochemistry, Angew. Chem. Int. Ed.,1993, 32 (9), p.1268-1288.
[5] Amatore C., Arbault S., Guille M., Lemaître F., Electrochemical Monitoring of Single Cell Secretion: Vesicular Exocytosis and Oxidative Stress, Chem. Rev., 2008, 108 (7), p. 2585-2621.