La découverte de la radioactivité par Henri Becquerel et Pierre et Marie Curie à la fin du XIXème siècle a permis aux chimistes et physiciens de soulever bon nombre de questions, remettant par exemple en cause la théorie de l’atome immuable ou encore du modèle planétaire de l’atome, et d’accéder ainsi à une connaissance poussée de la matière et de l’infiniment petit.
Introduction
L’étude de ce phénomène physico-chimique n’a pas eu que des répercussions sur les avancées de la recherche fondamentale. Au contraire, des applications ont été trouvées très rapidement, dans des domaines aussi variés que la datation, l’énergie ou le médical, et continuent aujourd’hui de se multiplier.
La datation au carbone 14 est une des applications de la radioactivité.
Le potentiel de la radioactivité pour le traitement des cancers a très vite été perçu par les scientifiques et médecins qui ont mis au point la radiothérapie en se basant principalement sur des éléments émetteurs de rayons bêta.
Actuellement, plusieurs équipes se penchent au contraire sur l’utilisation d’éléments émetteurs de rayon alpha pour le développement de la radioimmunothérapie, et notamment une filiale du groupe AREVA : AREVA Med, qui se spécialise dans l’étude de ce traitement ciblé du cancer.
Dans une première partie, nous verrons les méthodes employées actuellement pour le traitement des cancers, puis les avantages apportés par l’utilisation d’émetteur alpha et enfin le principe même de cette nouvelle méthode associant immunothérapie et émetteurs alpha.
Radiothérapie
Lorsque le cancer est détecté chez un patient, plusieurs traitements sont possibles. Les trois plus utilisés sont la chirurgie, la chimiothérapie et la radiothérapie. La chirurgie est souvent utilisée en association avec un des deux autres traitements. En effet, lors de l’intervention chirurgicale, la tumeur va être retirée dans la mesure du possible, si le cancer est localisé. Pour tuer des amas de cellules cancéreuses qui n’ont pas pu être retirés ou par prévention, le patient va le plus souvent suivre par la suite une chimiothérapie ou une radiothérapie.
La chimiothérapie consiste en la prise de médicaments qui vont limiter la division cellulaire, celle-ci étant accélérée chez les cellules cancéreuses. Les inconvénients de cette méthode restent encore nombreux à ce jour. En effet, le traitement n’étant pas localisé et les molécules utilisées très toxiques, il s’applique à toutes les cellules du corps ce qui entraîne de nombreux effets secondaires.
La radiothérapie consiste à irradier les cellules cancéreuses avec des rayons très énergétiques. Elle peut être pratiquée de deux manières : par voie externe, les rayons traversant la peau pour atteindre la tumeur ou par voie interne, par administration ou injection de produits radioactifs.
Le principe de la radiothérapie repose sur l’utilisation de rayonnements ionisants. Ce sont des rayonnements qui, par leurs grandes énergies, sont capables de provoquer une ionisation. Lors de l’utilisation de ces rayons en radiothérapie, l’ionisation va provoquer directement ou indirectement des lésions au niveau des brins d’ADN dans les noyaux des cellules cancéreuses. Des sources de particules sont utilisées pour émettre les rayons sous forme d’électrons (rayons bêta), de rayons X ou de rayons gamma.
Lors de l’utilisation de la curiethérapie (un produit radioactif est introduit directement au contact des cellules cancéreuses), l’élément injecté dépend de l’organe à traiter, le but étant d’utiliser un élément qui a une grande affinité avec ce dernier. Pour exemple, l’iode 131 est utilisée dans le cas des traitements de la thyroïde et le phosphore 32 dans le cas des leucémies. Comparée à la radiothérapie classique, la curiethérapie a pour avantage de ne pas irradier la peau du patient.
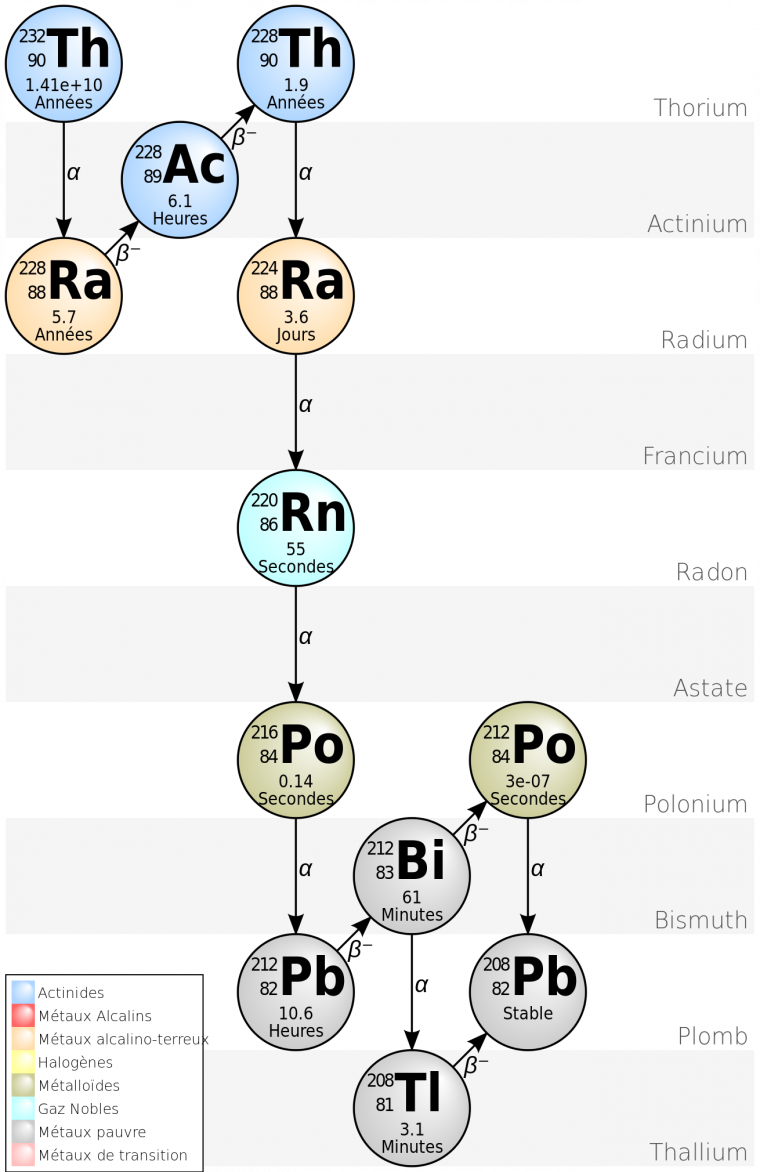
Le Plomb 212
La particularité du traitement qui fait l’objet de nombreuses recherches et qui est actuellement en phase I de test clinique est le fait que le rayonnement utilisé est de type alpha. Ceci apporte plusieurs avantages dans le cas précis de la destruction des cellules cancéreuses.
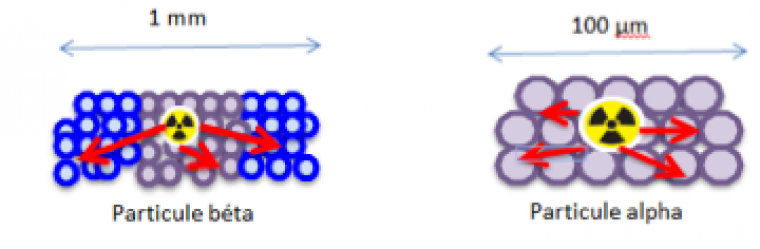
Tout d’abord, la grande masse des particules alpha, constituées de deux protons et de deux neutrons, limite leur propagation à une centaine de micromètres uniquement, tandis que les particules bêta, beaucoup plus petites, et donc légères, peuvent se propager sur des zones de la taille du millimètre. La zone irradiée par les particules alpha est donc environ 100 fois plus petite, et surtout, devient comparable à la taille de la cellule cancéreuse isolée à toucher. La précision de ce type de rayonnement est donc telle que les cellules saines peuvent être parfaitement épargnées.
Ensuite, l’énergie émise par un rayonnement alpha est élevée : environ 100 keV.μm-1, soit 1000 fois supérieure à celle d’un rayonnement bêta. De plus, son pouvoir ionisant est aussi très élevé ce qui lui confère une efficacité particulièrement intéressante. Ainsi, la probabilité de dégrader irrémédiablement l’ADN est telle qu’on considère que la destruction d’une cellule cancéreuse peut se faire par l’action d’une seule particule alpha.
Les émetteurs de particules alpha paraissent donc idéaux pour le traitement des cancers pour lesquels il existe encore trop peu de solutions comme le cancer du pancréas ou celui des ovaires.
| Particule bêta | Particule alpha | |
|---|---|---|
| Composition | 1 électron | 2 neutrons + 2 protons |
| Masse | 9,10938188 × 10-31 kg | 6,644656 × 10-27 kg |
| Énergie | ≈ 0,1 keV.µm-1 | ≈ 100 keV.µm-1 |
| Distance parcourue dans l'air | Quelques mètres | Quelques centimètres |
| Distance parcourue dans le corps humain | Quelques millimètres | Quelques micromètres |
Parmi les différents noyaux radioactifs, il existe de très nombreux émetteurs alpha. Cependant, pour pouvoir être utilisé en thérapie, l’émetteur doit respecter certaines contraintes : avoir un temps de demi-vie suffisamment long pour permettre la préparation, l’injection et le trajet jusqu’à la cellule de l’élément radioactif, mais suffisamment court pour limiter la toxicité en augmentant la précision et en limitant le temps de vie dans le corps, et enfin, la production doit être économiquement viable sur une grande échelle.
Les candidats sont donc finalement peu nombreux. Le bismuth 212, parait intéressant, même si son temps de demi-vie de 61 minutes est un peu court. En fait, le bismuth 212 est issu de la désintégration du plomb 212 par rayonnement bêta. Le plomb 212 ayant lui-même un temps de demi-vie de 10,6 heures, il pourrait générer le bismuth 212 après avoir été injecté, directement dans le corps humain. Le bismuth serait alors prêt à agir sur la cellule.
L’utilisation du plomb 212 semble donc intéressante du point de vue de ses caractéristiques physico-chimiques.
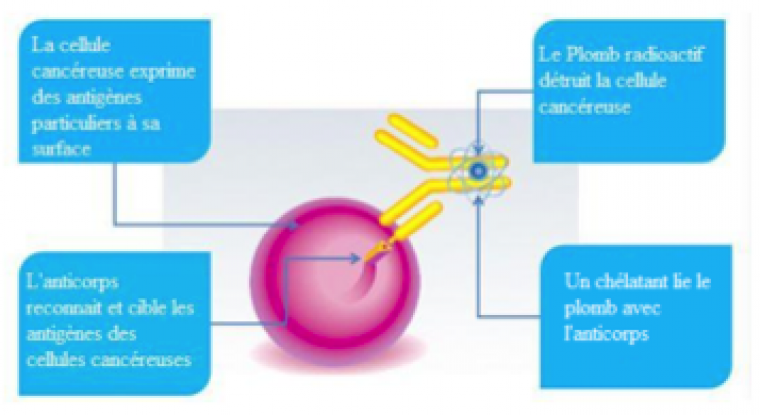
Principe du traitement local : couple antigène/anticorps
Utiliser les rayonnements nucléaires alpha pour venir à bout des cellules cancéreuses semble être une bonne idée. Mais ces rayonnements présentent également un danger pour les cellules saines qui se trouvent au voisinage de la tumeur. Il est donc nécessaire de pouvoir cibler précisément la zone à traiter.
La radioimmunothérapie est une technique qui repose sur le couplage d’un radioélément avec un anticorps dont l’antigène se trouve à la surface des cellules tumorales ciblées.
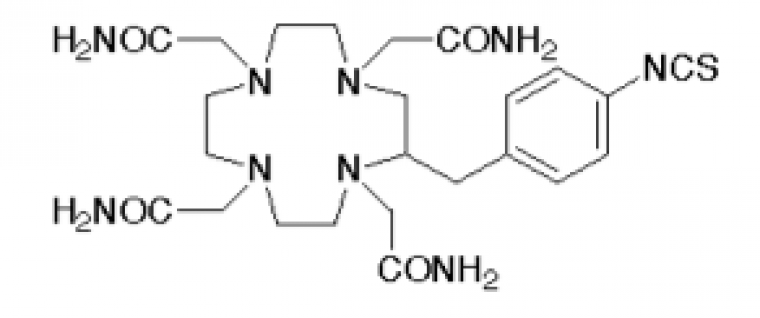
Le premier enjeu a été de trouver un ligand du 212Pb qui forme un complexe stable in vivo avec ce dernier pour éviter tout relargage de l’élément radioactif dans le corps lors de l’injection mais aussi qui se lie facilement avec l’anticorps utilisé.
Le ligand qui a été choisi est le TCMC qui chélate le plomb grâce à ses fonctions amides.
Les anticorps utilisés sont des anticorps monoclonaux. Ils ont la particularité de ne reconnaitre qu’un seul type d’antigène. Dans le cas de la radioimmunothérapie, on cherche donc à produire des anticorps monoclonaux reconnaissant des antigènes uniquement présents à la surface des cellules cancéreuses et non des cellules saines. Dans le cadre des traitements contre le cancer, plusieurs lignées d’anticorps monoclonaux ont été synthétisées comme le Trastuzumab (commercialisé sous le nom de Herceptin®) qui cible les cellules du cancer du sein ou de l’estomac ou bien le Cetuximab pour le cancer colorectal.
Une fois les anticorps synthétisés, on greffe à leur surface le complexe TCMC/212Pb.
L’essai clinique actuellement en cours cible le cancer du péritoine (membrane qui recouvre les organes dans l’abdomen) et qui a pour origine, dans la plupart des cas, la propagation d’un cancer d’un de ces organes (colon, ovaires, estomac ...). C’est le complexe 212Pb-TCMC-trastuzumab qui est injecté chez les patients.
Cet anticorps a une très grande affinité avec HER-2 (human epidermal growth receptor 2) qui est surexprimé à la surface des cellules cancéreuses du cancer de l’estomac. La liaison anticorps / récepteur entraine l’internalisation du complexe. Une fois dans la cellule, le plomb se transforme spontanément en bismuth qui se désintègre en émettant une particule alpha qui va engendrer la mort de la cellule.
Conclusion
L’utilisation du plomb 212, en radioimmunothérapie, dans le traitement des cancers, semble donc apporter différents avantages aux techniques déjà existantes : précision, efficacité, production économiquement viable… Les recherches sont à un stade avancé puisque la méthode est en cours de test clinique de phase 1 dans l’hôpital de l’université d’Alabama, à Birmingham, aux Etats-Unis. Ces tests sont menés en collaboration avec AREVA Med. La vidéo ci-dessous explique leur démarche.
Bibliographie et Ressources en Ligne
- Oranomed
- Thèse de M. Samir Boutaleb, soutenue en 2010.
- Radiothérapie, imagerie : le nucléaire en milieu médical ; par l'Autorité de sûreté nucléaire (ASN), publié sur CultureSciences-Chimie.
- Biomédicaments : amphipols et anticorps thérapeutiques ; publié sur CultureSciences-Chimie.