Les agents de contraste IRM sont des molécules destinées à améliorer la qualité des diagnostics par imagerie médicale par résonance magnétique. Lors d’un examen par IRM, certaines régions sont difficiles à visualiser : on accentue alors les contrastes en utilisant des agents de contraste, qui réagissent aussi au champ magnétique (ils sont dits paramagnétiques).
Introduction
La technique d’imagerie par résonance magnétique (IRM) est basée sur le phénomène de la résonance magnétique nucléaire des noyaux d’atomes d’hydrogène – les protons – présents dans les molécules d’eau. Ces protons sont munis d’un moment magnétique (le spin) qui peut occuper deux positions, et qui, en présence du champ magnétique d’un aimant, correspondent à des énergies distantes de ΔE. L’application d’une onde de radiofréquence d’énergie ΔE permet de modifier les états énergétiques des spins. Lors de la coupure de l’onde de radiofréquence, les spins retournent dans leur état fondamental en restituant de l’énergie sous la forme d’un signal IRM. Ce signal, dit de résonance magnétique nucléaire, dépend de la concentration locale en protons et des relaxations longitudinales et transverses T1, T2 des protons contenus dans les tissus imagés. L’IRM permet ainsi la lecture des images pondérées en T1, T2 ou densité de proton. On localise le signal dans l’espace en modifiant légèrement le champ magnétique à l’aide de gradients de champ. (Figure 1)
Lors d’un examen par IRM, certaines régions sont difficiles à visualiser : on accentue alors les contrastes en utilisant des agents de contraste, qui réagissent aussi au champ magnétique (ils sont dits paramagnétiques).
L’injection d’agents de contraste a pour but d’accélérer les vitesses de relaxation magnétiques 1/T1 et 1/T2 des protons des molécules d’eau, c’est-à-dire de raccourcir le temps pendant lequel les spins de ces protons regagnent leur état initial après excitation par l’onde de radiofréquence. C’est ce qui permet d’augmenter le contraste du signal observé par IRM. Il faut noter que ce n’est pas l’agent de contraste qui est visualisé en IRM mais son influence sur la relaxation des protons de l’eau située autour de l’agent de contraste.
Le rayonnement utilisé étant de faible énergie, le processus d’imagerie médicale par IRM est inoffensif, comparé aux autres techniques d’imagerie (rayons X, imagerie nucléaire…).
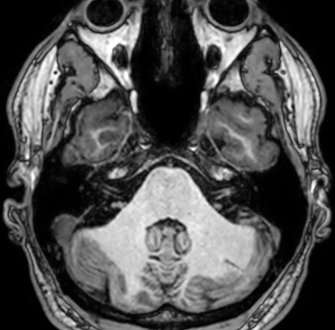
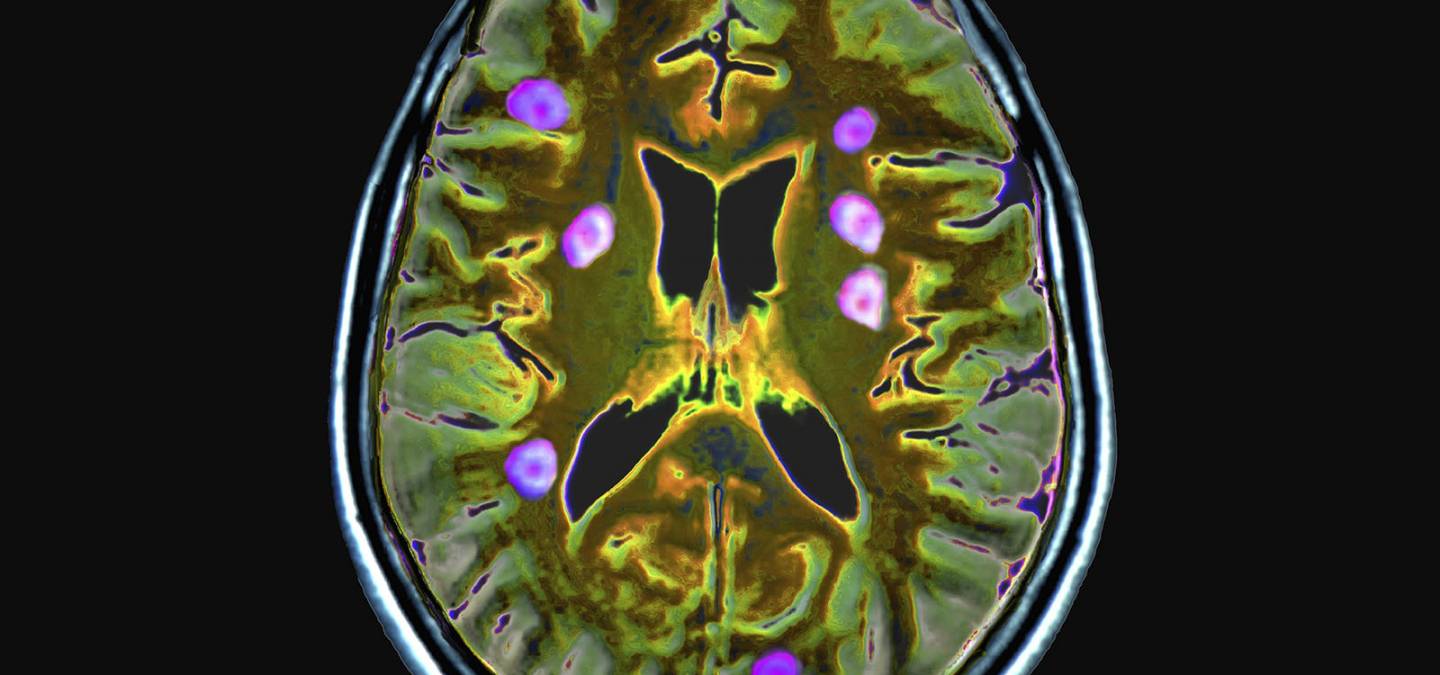
Les agents actuellement commercialisés sont caractérisés par une pharmacocinétique à distribution dite interstitielle, c’est-à-dire qu’après l’injection par voie intravasculaire, l’agent se répartit dans tout l’espace extracellulaire. Ces agents permettent notamment de détecter des tumeurs cérébrales, mammaires…, des pathologies ostéo-articulaires, et permettent de réaliser l’imagerie des vaisseaux, procédure appelée angiographie (Figure 2).
Les agents de contraste : quelles exigences ?
Les agents de contraste : des « médicaments » pas comme les autres
Outre les critères liés à la technique de la résonance magnétique (voir paragraphe 2.3), la conception des agents de contraste doit prendre en compte les contraintes liées à leur utilisation chez l’homme.
La plupart des agents de contraste étant injectables par voie intraveineuse, ils ne rencontrent donc pas le problème du franchissement de la barrière intestinale contrairement à un grand nombre de médicaments. Mais leur dose d’injection est généralement importante : on injecte classiquement à un patient 4 grammes d’agent de contraste dans une seringue de 20 mL, et dans un laps de temps de l’ordre de 3 à 6 secondes, par exemple pour une angiographie… ce qui oblige à prendre en compte les caractéristiques physicochimiques de la solution administrée, à savoir : la solubilité, l’osmolalité et la viscosité.
Au vu des doses importantes utilisées, même pour une injection unique, il est nécessaire de contrôler de très près la tolérance de l’organisme à ces produits. Par définition, les agents de contraste sont des médicaments au sens du Code de la santé publique et n’échappent pas aux lourds protocoles des tests précliniques de toxicité, ainsi qu’aux études cliniques visant à démontrer le bénéfice/risque du médicament. C’est ainsi au stade même de leur conception au laboratoire qu’il faut étudier la toxicité des agents de contraste. C’est ce qui sera abordé dans le paragraphe 2.2.
L’efficacité des agents de contraste en IRM repose sur la capacité des éléments paramagnétiques qu’ils contiennent à modifier les temps de relaxation T1 et T2 de l’eau, et donc à améliorer les contrastes des images. Du fait de ses propriétés paramagnétiques bien adaptées (sept électrons célibataires), l’ion gadolinium Gd3+ est l’élément de choix pour concevoir des agents de contraste IRM. Il est aujourd’hui largement utilisé dans les produits de contraste. Qu’en est-il de la toxicité et de l’efficacité des agents de contraste à base de gadolinium ?
La stabilité des agents de contraste : un enjeu sur la toxicité
Le gadolinium ne peut être utilisé sous sa forme ionique libre Gd3+ à cause de sa haute toxicité. Il possède en fait le même rayon ionique que l’ion calcium Ca2+, élément important dans l’équilibre de l’organisme, lequel serait fortement perturbé si l’on injectait du Gd3+. Il est néanmoins possible de masquer cette toxicité en séquestrant cet ion dans des molécules ligands appartenant à deux grandes familles : les polyaminocarboxylates linéaires et macrocycliques. On obtient ainsi des chélates de gadolinium, aussi appelés contrastophores (Figure 3).
Effectivement, d’après des études menées sur des souris, on observe que la toxicité de l’ion Gd3+ seul est diminuée de cent fois lorsqu’il est chélaté sous forme de contrastophore. Il est important de pouvoir garantir l’innocuité de tels agents de contraste tout au long de leur séjour dans l’organisme. Ainsi se pose la question cruciale de leur stabilité dans l’organisme, question d’autant plus pertinente qu’est apparue dans les années 2000 une nouvelle pathologie, la fibrose systémique néphrogénique, survenue chez des patients souffrant d’une insuffisance rénale sévère. Jusqu’alors connue comme une maladie cutanée systémique se caractérisant par des lésions diffuses, elle s’est avérée être une maladie d’évolution bien plus grave (atteignant le muscle, le poumon, le cœur) et débouchant parfois vers la mort. À ce jour, il n’existe pas de traitement validé de cette pathologie. Il a été suggéré qu’une amélioration de la fonction rénale pourrait ralentir l’évolution de la maladie, et dans certains cas en inverser le cours.
C’est en 2006 qu’un lien causal possible a été établi avec l’administration d’agents de contraste à base de gadolinium chélaté : la plupart des malades avaient subi un examen par IRM avec injection de gadolinium dans les mois précédant les premiers symptômes. Et l’on a effectivement retrouvé des ions Gd3+ dans des biopsies cutanées de ces malades.
Le mécanisme de cette maladie n’a pas encore été clarifié, mais une des hypothèses formulées se base sur la libération des ions Gd3+ par les chélates de gadolinium les moins stables. Ces ions précipiteraient ensuite sous forme de phosphate de gadolinium, qui serait phagocyté par des macrophages, lesquels recruteraient alors des fibrocytes circulants, déclenchant les fibroses.
Cette découverte malheureuse a donc soulevé la question cruciale de la stabilité des agents de contraste en IRM. Les alertes ont été données par les pouvoirs publics. Aux États-Unis, la Food and Drug Administration a émis une alerte sur l’injection de tous les chélates de gadolinium, notamment aux patients en insuffisance rénale sévère ; tandis qu’en Europe, trois des produits les moins stables (Omniscan®, Optimark® et Magnevist®) sont contre-indiqués chez ces patients. L’Agence européenne des médicaments (EMEA) étend la recommandation de prudence à l’utilisation de tous les autres chélates de gadolinium chez les patients en insuffisance rénale sévère.
Outre l’enjeu crucial de la stabilité des chélates de gadolinium en termes de toxicité, il faut pouvoir assurer un bon contraste de l’image IRM, et sans besoin de doses excessives. Un témoin de cette efficacité est la relaxivité.
La relaxivité dans la qualité d’un agent de contraste
La capacité des agents de contraste à accélérer ainsi les vitesses de relaxation 1/T1 et 1/T2 des protons de l’eau est mesurée par une grandeur : la relaxivité. Celle-ci dépend d’un ensemble de paramètres. On définit la relaxivité (r) d’un agent de contraste comme la vitesse de relaxation, normalisée par la concentration de l’agent de contraste (Figure 4).
La relaxivité est une grandeur physique régie par des équations mathématiques aux paramètres multiples : pour celui qui conçoit les agents de contraste, cela peut devenir un véritable cauchemar ! Comment transformer ces équations en conceptions moléculaires ?
Des idées importantes peuvent en ressortir :
- la relaxivité de l’agent de contraste, et donc son efficacité, dépend du nombre de molécules d’eau venant interagir avec l’ion paramagnétique : il est donc important de concevoir des complexes tels que l’eau puisse facilement pénétrer dans leur sphère interne ;
- la relaxivité dépend du temps de résidence (τm) des molécules d’eau dans la sphère interne du complexe de gadolinium, du temps de rotation du complexe (τr) et du temps de relaxation (τs) du gadolinium chélaté (Figure 5).
Le défi du chimiste dans la conception des agents de contraste est donc d’optimiser simultanément l’ensemble de ces paramètres, pour concevoir des molécules efficaces. D’après les calculs théoriques, on trouve que la relaxivité maximale atteignable pour les agents de contraste à base de gadolinium est de l’ordre de 100 mM-1.s-1. Les agents de contraste actuellement commercialisés atteignent des relaxivités de 4 mM-1.s-1, ce qui laisse augurer un gain notable en efficacité durant les années à venir.
Vers des agents de contraste plus efficaces
Le principe : une approche classique de la chimie médicinale
Dans l’objectif de concevoir des agents de contraste au gadolinium stables et efficaces, une approche rationnelle a été adoptée en partant d’une structure d’agent de contraste unique, appelée « plateforme », à partir de laquelle on crée plusieurs agents de contraste dérivés, dont on va essayer de moduler les propriétés pharmacocinétiques et la biodistribution – c’est-à-dire l’accessibilité à des territoires pathologiques précis.
La structure de départ : la plateforme P730
La structure de départ choisie est le complexe DOTA Gd, qui est un agent de contraste à base de gadolinium particulièrement stable. Le ligand macrocyclique DOTA forme en effet une cavité particulièrement bien adaptée à la taille de l’ion Gd3+. À partir de la structure DOTA Gd, les chimistes ont eu l’idée de greffer quatre bras périphériques « glutariques », qui offrent alors quatre sites de fonctionnalisation chimique possibles (Figure 6).
La plateforme P730 s’est révélée aussi stable que le DOTA Gd. Elle se décomplexe très peu au pH physiologique et présente une bien meilleure stabilité que certains agents de contraste commerciaux, incriminés aujourd’hui dans la survenue des fibroses systémiques néphrogéniques.
Dans cette structure, les trois temps caractérisant la relaxivité sont simultanément optimisés. Le temps de relaxation électronique (τs) est optimisé en partant d’une structure dérivée du DOTA Gd. En effet, on sait que le DOTA Gd présente un temps de relaxation électronique long et donc très favorable à la relaxivité. Cela est attribué à la symétrie et à la rigidité du macrocycle DOTA vis-à-vis des chocs des molécules d’eau sur le complexe (Figure 7).
Le temps de résidence (τm) des molécules d’eau dans la sphère interne du complexe de gadolinium est accéléré grâce à l’adjonction de bras glutariques qui induisent une compression autour du gadolinium. Enfin, le temps de rotation du complexe (τr) est efficacement ralenti en plaçant l’ion gadolinium au barycentre de la structure P730 et de ses dérivés.
Fonctionnaliser la plateforme P730 : accès à une série de nouveaux complexes
Les quatre extrémités des chaînes glutariques sont des positions de fonctionnalisation chimique, où l’on a envisagé de greffer une grande diversité de branches hydrophiles par une simple réaction de couplage peptidique (Figure 8).
C’est ainsi qu’a été synthétisée une série de complexes possédant des groupements R de poids moléculaires variés (avec des groupements poly-aromatiques éventuellement basés sur des structures dendrimères). Verdict des tests de relaxivité : on se rapproche de l’optimum prédit par les équations mathématiques avec le complexe de plus haute masse moléculaire de la série ! Des études ont permis de mettre en évidence une corrélation entre masses moléculaires et relaxivité. Et il a été possible de moduler facilement les relaxivités des complexes en faisant varier le groupement R. Qu’en est-il des propriétés pharmacocinétiques de ces produits ?
Une nouvelle classe d’agents de contraste spécifiques : des produits à rémanence vasculaire
Les propriétés pharmacocinétiques de cette nouvelle série de complexes au gadolinium ont été étudiées sur des rats, et l’on observe qu’ils restent confinés plus ou moins longtemps dans le sang, selon leur structure (rigidité, poids moléculaire). Il s’agit là d’une propriété intéressante pour des agents de contraste, qui est la rémanence vasculaire.1
Suite à la synthèse de plusieurs complexes de gadolinium à partir de la plateforme P730, une structure présentant de bons résultats a émergé : le Vistarem®. Au cours des tests d’évaluation, des angiographies ont été réalisées, l’une avec le Vistarem®, l’autre avec le Dotarem®, agent de contraste commercial. On voit qu’avec une dose injectée presque dix fois plus faible pour le Vistarem®, sa rémanence vasculaire est bien supérieure à celle du Dotarem®, après cinq minutes d’injection, et l’on observe bien une compartimentation du produit dans le réseau artériel. Cela permet d’améliorer significativement l’image angiographique, où le réseau artériel et même veineux est mieux délimité. Les images obtenues permettent au radiologue de mieux appréhender les distalités par exemple (Figure 9).
Le Vistarem® permet également de réaliser l’imagerie des artères coronaires (Figure 10).
Ces artères coronaires sont particulièrement difficiles à imager car ce sont des petits vaisseaux (2 mm de diamètre) très tortueux, et qui se déplacent avec les mouvements cardiaques. Reste à savoir si l’on peut quantifier les sténoses dans les coronaires, ce qui est l’objectif diagnostique final.
Peut-on maintenant affiner la technique d’imagerie par résonance magnétique pour des applications encore plus précises ?
Une nouvelle voie de recherche : l’imagerie moléculaire
Le principe
Une voie actuelle de recherche et développement est l’application de l’imagerie par résonance magnétique à l’échelle cellulaire ou subcellulaire, comme une variante de ce que l’on appelle l’imagerie moléculaire, et qui permet de visualiser de manière non invasive de nombreux processus ayant lieu à cette échelle, comme par exemple l’expression d’un gène, d’un récepteur, le fonctionnement d’un système enzymatique, etc. C’est une imagerie fonctionnelle qui permet, grâce à un « traceur », d’étudier le fonctionnement des organes. Elle est nommée imagerie moléculaire ou métabolique, parce qu’on peut imager le devenir d’une molécule dans l’organisme.
L’imagerie moléculaire est déjà utilisée en médecine nucléaire (par utilisation d’isotopes radioactifs). C’est une technique très sensible, mais irradiante et peu résolutive. Elle utilise notamment un traceur efficace, disponible aujourd’hui sur le marché (le 18FDG), qui permet de tracer la consommation de glucose dans des cellules cancéreuses. Utilisé en routine clinique, ce traceur d’imagerie moléculaire représente un apport considérable en diagnostic médical, notamment dans des applications oncologiques.
On souhaite maintenant utiliser des traceurs en tant qu’agents de contraste, mais pour de l’imagerie moléculaire par résonance magnétique, technique non irradiante et permettant d’accéder à de hautes résolutions spatiales. Actuellement, il existe déjà des traceurs de l’activité des macrophages, qui permettent par exemple de détecter des lésions inflammatoires associées à la sclérose en plaques. Ces traceurs ont déjà été évalués en phase II de tests cliniques. Des agents de contraste IRM d’imagerie moléculaire ont également été développés pour suivre les processus angiogéniques (apparition de nouveaux vaisseaux associés à des tumeurs malignes et leurs métastases).
Concevoir un traceur en IRM pour l’imagerie moléculaire : un défi de chimiste
La conception de traceurs en IRM pour l’imagerie moléculaire nécessite de lier une structure moléculaire appelée pharmacophore à un contrastophore, via un « espaceur » (Figure 11).
On va faire varier le pharmacophore, en vue d’optimiser son affinité et sa sélectivité pour une cible déterminée. En faisant varier également le contrastophore, on cherche toujours à optimiser la relaxivité c’est-à-dire l’efficacité du traceur sur le signal IRM. En effet, pour les produits de contraste existants, il est nécessaire d’accumuler le traceur localement à des concentrations de 10 à 100 µM pour obtenir un signal détectable par IRM. Or, la concentration des récepteurs cellulaires intervenant dans les processus pathologiques est de l’ordre d’1 µM à 1 nM. Pour générer un contraste spécifique, il est nécessaire d’obtenir des concentrations locales d’agent de contraste comparables à celle de la cible biologique étudiée.
En conséquence, il faudrait augmenter la sensibilité des agents de contraste de plusieurs ordres de grandeur pour pouvoir visualiser ce qui se passe à l’échelle de l’imagerie moléculaire. L’espaceur est également intéressant, car il peut permettre de modifier les propriétés physicochimiques du produit, comme la solubilité ou la viscosité, mais également d’améliorer l’accessibilité à un territoire bien déterminé, par exemple le passage de la barrière hémato-encéphalique, ou la diffusion dans des tumeurs.
L’IRM moléculaire : vers le diagnostic précoce de la maladie d’Alzheimer
Les recherches ont abouti à trouver un premier traceur efficace, constitué d’un complexe de gadolinium (contrastophore) auquel on a attaché un peptide (pharmacophore) capable de reconnaître les plaques bêta-amyloïdes, ces plaques qui s’accumulent de manière anormale dans la maladie d’Alzheimer. À l’espaceur qui les lie, est greffée une structure putrécine, structure aminée qui va favoriser le passage de la barrière hématoencéphalique. Ce traceur a été testé sur des souris transgéniques modèles de la maladie d’Alzheimer, dont on a analysé le cerveau par IRM ; les images IRM ont bien mis en évidence la présence de plaques bêtaamyloïdes caractéristiques de la maladie.
L’IRM moléculaire : vers le diagnostic précoce du cancer de l’ovaire
Une autre recherche a porté sur la détection des cellules cancéreuses dans certains cancers, notamment celui de l’ovaire. Ce cancer « silencieux et tueur » n’est généralement détecté qu’à des stades trop tardifs ; il représente aujourd’hui un défi notable en diagnostic. Ces cellules se distinguent bien des cellules saines par la surexpression de récepteurs à l’acide folique sur leurs membranes. Ces récepteurs sont d’ailleurs des cibles intéressantes pour véhiculer des médicaments anticancéreux.
Le but est de les détecter par IRM à l’aide d’un traceur, dans l’espoir d’un diagnostic précoce. Pour cela, la stratégie envisagée est de greffer de l’acide folique sur un agent de contraste dérivé de la plateforme P730Gd, en espérant utiliser le mécanisme naturel de l’endocytose, par lequel la cellule cancéreuse va pouvoir internaliser le traceur (Figure 12).
Pour vérification, des tests comparatifs ont été réalisés : on a synthétisé deux agents de contraste, P866 et P999, à partir de la plateforme P730 vue précédemment. Leurs structures sont identiques, à la différence que sur l’un d’entre eux, le P866, on a greffé un « résidu folate » (par réaction avec l’acide folique), tandis que l’autre produit, le P999, ne contient pas ce résidu et constitue donc une molécule témoin (Figure 13).
Une première expérience in vitro a été réalisée sur des cellules tumorales humaines : elle a mis en évidence une affinité particulière du traceur comportant le folate vis-à-vis de ces cellules. On voit bien sur la Figure 14 l’accroissement de plus d’un facteur dix de la quantité de contrastophore P866 fixée sur la cellule tumorale, par rapport au témoin Dotarem®.
Pour vérifier maintenant l’efficacité de la méthode pour l’imagerie médicale IRM, on a réalisé des tests in vivo chez des souris possédant des tumeurs KB surexprimant le récepteur à l’acide folique, auxquelles on a injecté ce nouveau traceur P866. La concentration du gadolinium dans les tissus tumoraux a été dosée quatre heures après l’injection, et l’on s’aperçoit que ce traceur s’accumule spécifiquement dans les organes, contrairement au traceur témoin P999. Toutefois, cette sélectivité n’est obtenue qu’avec des doses injectées inférieures à 10 µmol d’ions gadolinium par kilogramme. Au-delà (30 µmol par kilogramme), il n’y a plus de sélectivité (Figure 15).
Et malheureusement, si l’on reste en dessous de cette dose, le signal IRM n’est pas assez intense (Figure 16).
La perte d’information à 30 µmol par kilogramme peut s’expliquer : l’excès de traceur injecté noie dans un bruit de fond le signal spécifique provenant des molécules de traceurs qui se sont bien liées aux récepteurs de la tumeur. Il s’agit alors d’un problème de sensibilité des sondes de mesure, qu’il faut encore améliorer. On en revient encore au problème de l’amélioration de la relaxivité…
L’IRM moléculaire pour visualiser les processus dans les cellules reste donc un défi. Les chercheurs ont encore plusieurs cartes à jouer, notamment avec l’utilisation de logiciels de traitement d’image ; ou encore le développement de contrastophores plus efficients, en particulier des structures nanoparticulaires à base d’oxydes de fer « super paramagnétiques ». À suivre…
Conclusion : vers des diagnostics plus précoces ?
Les agents de contraste apparus il y a une trentaine d’années permettent de diagnostiquer des pathologies multiples. Leurs caractéristiques en font des outils indispensables dans l’imagerie par résonance magnétique et leur domaine d’application s’élargit. Cependant, la stabilité de ces produits demeure un problème majeur car la toxicité des agents à base de gadolinium n’est pas totalement contrôlée. Il est alors indispensable de chercher à concevoir des produits de plus en plus efficients, dont le risque pour le patient soit moindre, et la chimie peut jouer un grand rôle dans ce domaine.
L’IRM devrait pouvoir offrir bientôt de nouvelles possibilités. Les travaux consistent notamment à fixer sur les molécules de gadolinium – produit aux propriétés paramagnétiques, déjà couramment utilisé – des substances susceptibles d’être captées par les récepteurs de cellules spécifiques. Ainsi, il serait possible d’accéder à l’imagerie moléculaire IRM.
Les promesses de l’imagerie moléculaire sont considérables en sciences fondamentales : pouvoir enfin étudier le vivant, explorer de façon longitudinale migration cellulaire, différentiation, sénescence1 et réponse aux facteurs environnementaux.
En médecine, l’imagerie moléculaire est incontournable pour identifier les déterminants moléculaires des processus pathologiques in situ, évaluer les nouvelles thérapies moléculaires comme la thérapie génique, accélérer le développement des médicaments (délivrance des principes actifs, mesure de l’efficacité des vecteurs), etc. L’imagerie moléculaire IRM est promise à un bel avenir, mais il reste un long chemin à parcourir pour l’intégration de cette nouvelle discipline dans la pratique radiologique courante.
Bibliographie et ressources en ligne
- Introduction à la Résonance Magnétique Nucléaire (RMN) par Dominique Gennet, publié sur CultureSciences-Chimie.
- Les origines de l'IRM : la résonance magnétique nucléaire (RMN), par Hagop Demirdjian, publié sur CultureSciences-Chimie.
- Principes et Applications de la Résonance Magnétique Nucléaire (RMN), un diaporama par Patrick Berthault et Hervé Desvaux ayant fait l'objet d'une conférence lors de la fête de la Science en octobre 2007, publié sur CultureSciences-Chimie.
-
Dossier: la résonance magnétique nucléaire (RMN), publié sur CultureSciences-Chimie.
Note
La notation "M" désigne l'unité "mol.L-1" dans cet article.