Le sida est responsable de 6500 contaminations annuelles et, en France, 120 000 personnes vivent avec le virus VIH. Les contaminations touchent de plus en plus les femmes. De nombreux chimistes et biologistes travaillent pour trouver un remède contre ce virus. Aujourd’hui un nouveau produit antimicrobien est actuellement en études cliniques sur des humains. Ce produit qui a pour nom VivaGel® a été développé par des chercheurs de l’industrie Starpharma®. Il s’agit d’un gel vaginal qui pourrait être utilisé pour la prévention des infections sexuellement transmissibles comme le VIH et l’herpès vaginal. La molécule active de ce gel est une grosse molécule sphérique de taille nano-moléculaire que l’on appelle un dendrimère. La chimie des dendrimères est récente et peu connue : le but de cet article est de présenter cette molécule et son mode d'action face au virus.
Un dendrimère, qu’est ce que c’est ?
Les dendrimères sont une nouvelle catégorie de polymère. Vous ne savez peut-être pas non plus ce que sont les polymères et pourtant ils existent depuis très longtemps et nous les utilisons au quotidien. Ce sont des macromolécules qui résultent de l'enchaînement covalent de motifs de répétition identiques ou différents les uns des autres. Ces motifs de répétition sont appelés monomères. La masse molaire de ces molécules peut atteindre 10 000 g.mol-1 ! Les liaisons covalentes constituant le squelette macromoléculaire sont le plus souvent des liaisons carbone-carbone : c’est le cas des sacs en plastique qui sont en polyéthylène ou en polypropylène. Ces liaisons peuvent également résulter de la liaison d'atomes de carbone avec d'autres atomes, notamment l'oxygène pour faire, par exemple, des polyesters utilisés dans les textiles ou l'azote pour créer des polyamides notamment employés dans l’industrie automobile.
Cet enchaînement de motifs répétés dans les polymères les plus simples présente une structure linéaire, un peu comme un collier de perles détaché. On peut également rencontrer des chaînes latérales (elles-mêmes plus ou moins branchées), résultant d'une réaction de greffage pratiquée volontairement sur le polymère pour en modifier les propriétés physico-chimiques.
Venons en maintenant aux dendrimères qui sont une sorte de polymères. Leur particularité est d’être composée d’une série de branchements, constitués d’un grand nombre de fonctions chimiques autour d’un cœur intérieur. Leur masse molaire, leur fonctionnalisation et leur extension dans les trois dimensions de l’espace sont très grandes mais demeurent contrôlables lors de processus de synthèse répétitifs qui se réalisent autour d’un cœur central plurifonctionnel.
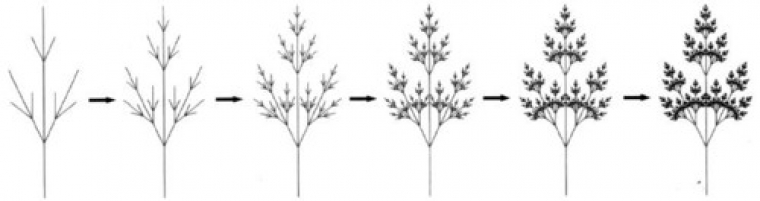
Prenons un exemple plus concret. Dans la nature, on peut observer des formes dendritiques. En effet, la forme des dendrimères est comparable à celle des cristaux de neige ou des arbres (figure 1).
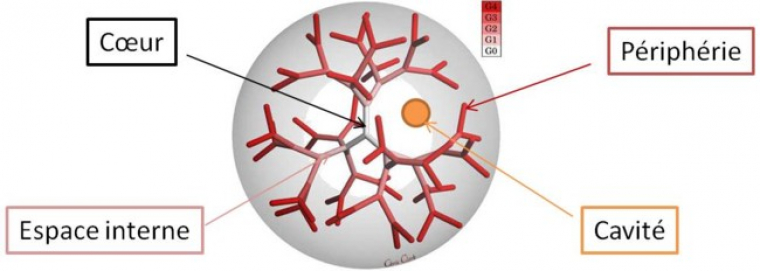
Les dendrimères se présentent sous forme sphérique ou pseudo-sphérique. Ils sont constitués de trois parties : le cœur, la périphérie et l’espace interne (figure 2). Le cœur du dendrimère peut être comparé au tronc de l’arbre. A ce tronc sont rattachées de nombreuses branches qui représentent l’espace interne du dendrimère constitué le plus souvent d’unités répétitives. Ce nombre d’unités augmente avec la génération qui sera détaillée dans le paragraphe suivant. Les branches des arbres permettent d’augmenter l’exposition des feuilles à la lumière du soleil amplifiant ainsi le processus de photosynthèse. De la même manière, l’espace interne permet d’accroître le nombre de fonctions chimiques à la périphérie du dendrimère augmentant ainsi le nombre de sites réactifs. Entre les branches du dendrimères se forment des cavités protégées par la périphérie qui permettent d’abriter d’autres molécules actives. On parle alors d’encapsulation. Cette notion ne sera pas développeée dans cet article mais il faut savoir qu’elle fait l’objet de nombreuses recherches dans le domaine des dendrimères et de la médecine.
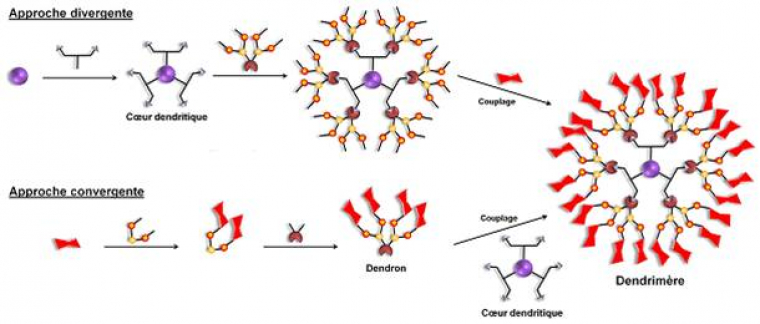
Vous vous demandez peut-être comment il est possible de synthétiser des molécules si grosses et si symétriques ? La synthèse des dendrimères requiert l’utilisation d’une molécule « cœur » possédant des groupes de branchement auxquels d’autres molécules branchées sont ajoutées par couches. Chaque nouvelle couche est appelée une génération. Le cœur est la génération 0 et est noté G0. La première molécule branchée constitue la première génération et est noté G1, et ainsi de suite. La dernière génération incorpore des groupements actifs qui donnent une fonctionnalité particulière au dendrimère. La sélection du cœur, des « branches », et des fonctions de surface détermine les propriétés des différents dendrimères nécessaire pour des applications médicales, chimiques, électroniques ou en matériaux. Le bon contrôle des paramètres tri-dimensionnels et l’introduction des fonctions chimiques en périphérie requiert des stratégies de synthèse efficaces et reproductibles. Deux méthodes sont couramment utilisées. L’approche divergente dite « en cascade » qui consiste en une croissance du dendrimère du cœur vers la périphérie et l’approche convergente qui nécessite d’abord la synthèse du secteur périphérique sous forme de bras hyperbranchés (dendrons) puis le couplage entre ces dendrons avec un cœur dendritique (figure 3).
La chimie des dendrimères est relativement récente et demeure en constante évolution à en croire la forte augmentation des publications dont elle fait l’objet. En raison de l’apparition d’une multitude de structures dendritiques contenant différents types de fonctions chimiques, les dendrimères s’appliquent dans de nombreux domaines tels que la science des matériaux, de la catalyse et la pharmaceutique.
Suite aux avancées importantes sur le développement et les applications des dendrimères en milieu médicinal, plusieurs compagnies pharmaceutiques s’y sont intéressées. L'une des industries de pointe dans ce domaine est Starpharma Holdings Ltd. Celle-ci se consacre essentiellement au développement et à l'utilisation des dendrimères en vue de vaincre des maladies graves.
Le VIH, un virus qu’on aimerait bien éliminer…
Le SIDA ou Syndrome d'ImmunoDéficience Acquise est une des maladies sur laquelle de nombreux chercheurs travaillent. Le SIDA est le dernier stade de l'infection par le Virus de l'Immunodéficience Humaine (VIH) et finit par la mort de la personne infectée, des suites de maladies opportunistes. Ce virus est transmis par plusieurs fluides corporels comme le sang, les sécrétions vaginales, le sperme ou le lait maternel. Le SIDA est aujourd'hui considéré comme une pandémie. 25 millions de personnes en sont mortes entre 1981 (date de la première identification de cas de sida) et janvier 2006 ! Bien qu'il existe des traitements antiviraux luttant contre le VIH et retardant par conséquent l'apparition du SIDA, il n'existe à l'heure actuelle aucun vaccin ou traitement définitif. La prévention, qui passe par l’utilisation du préservatif durant les rapports sexuels, est le moyen de lutte le plus efficace.
Aujourd’hui il semblerait que les scientifiques aient trouvé un nouveau moyen de prévenir l’infection par le VIH. En effet, les chercheurs de Starpharma® ont mis au point un microbicide, le VivaGel®, qui se présente sous forme de gel basé sur une formulation nano-pharmaceutique. Ce gel vaginal féminin pourrait être utilisé dans la prévention des maladies sexuellement transmissibles comme le VIH, l’herpès génital et la chlamydia. Il empêcherait le virus d’entrer en contact avec nos cellules. Actuellement, des essais cliniques sont réalisés sur des humains avant de le mettre sur le marché.
Mais à l’échelle cellulaire, comment le virus fait-il pour infecter notre corps ?
Un mécanisme d’action basé sur la reconnaissance
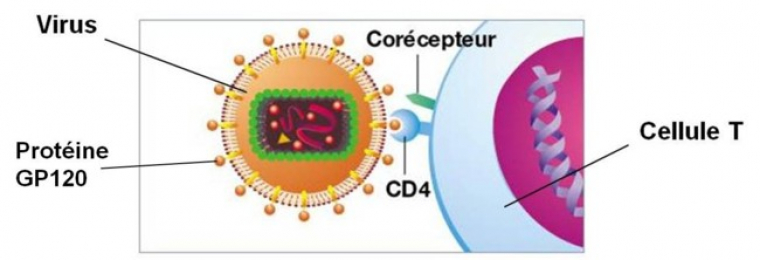
Les lymphocytes sont des globules blancs qui ont un rôle majeur dans le système immunitaire. Les lymphocytes T4 sont les cellules cibles principales du virus du VIH. Le VIH possède une protéine à sa surface : la protéine GP120. La fixation du virus sur nos cellules est la première étape dans l’infection des cellules humaines par le virus du VIH.
Ces lymphocytes T4 possèdent des protéines membranaires, appelées CD4, auxquelles la GP120 virale peut s'accrocher permettant ainsi l'entrée du VIH dans la cellule. Il y a en fait une reconnaissance entre les protéines de surface du virus et ces récepteurs CD4 de la cellule cible T (figure 4).
Ce principe de reconnaissance peut être facilement imagé avec un exemple de la vie de tous les jours, celui de la clef et de la serrure. En effet, votre clef est capable d’ouvrir uniquement votre porte car elle est la seule à avoir la forme complémentaire de votre serrure. Ainsi chaque virus ne peut se lier qu’à un seul type de cellule par complémentarité des interactions.
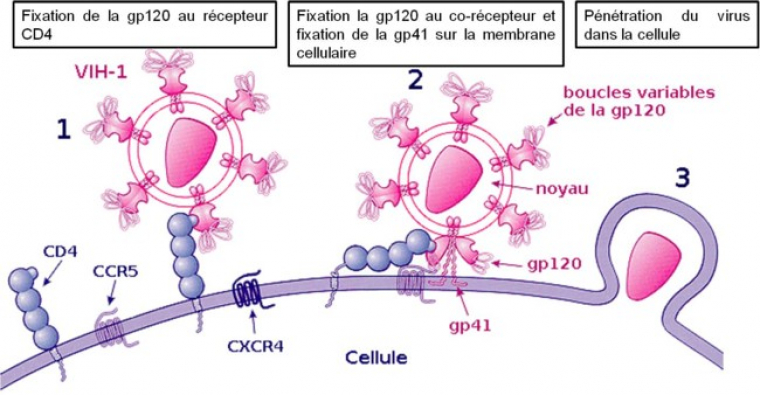
Cette reconnaissance entraîne un changement de conformation de la protéine GP120 qui va permettre au virus de se lier à un corécepteur membranaire, le CCR5, du lymphocyte T4. Cette reconnaissance s’effectue grâce à de multiples interactions non-covalentes de type protéine-protéine appelées interactions multivalentes. Ce principe de reconnaissance ligand-récepteur, est un phénomène d’associations spécifiques et simultanées entre les protéines du virus (ligand) et les récepteurs des cellules.
Après la reconnaissance, une autre protéine virale (gp41), va permettre au VIH d’insérer un peptide de fusion dans la cellule hôte, permettant ainsi la pénétration du virus dans la cellule. Il s’agit d’un processus coopératif. La figure 5 schématise le principe d’action du VIH.
Les dendrimères, un espoir dans la lutte contre le VIH
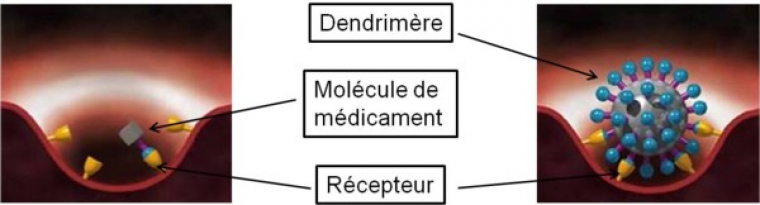
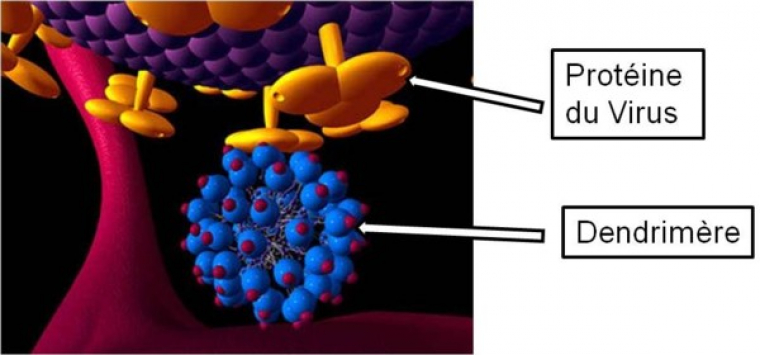
Les chercheurs ont pensé que les dendrimères pouvaient intervenir lors du principe d’infection précoce des cellules par le virus du VIH du fait de leur taille similaire aux protéines. De ce fait, ils offrent un mode d’interactions avec les systèmes biologiques qui les distinguent des thérapies basées sur des petites molécules de médicament. En effet, ces dernières interagissent avec un seul récepteur alors qu’un dendrimère est capable d’avoir plusieurs interactions avec les récepteurs de la cellule membranaire ou du virus comme on peut le voir sur la figure 6. Le nombre d’interactions de type ligand-récepteur qui peut se former entre des molécules (protéines) présentes à la surface des virus (ou des cellules) et une autre entité s’appelle la valence. Les dendrimères sont donc des composés multivalents.
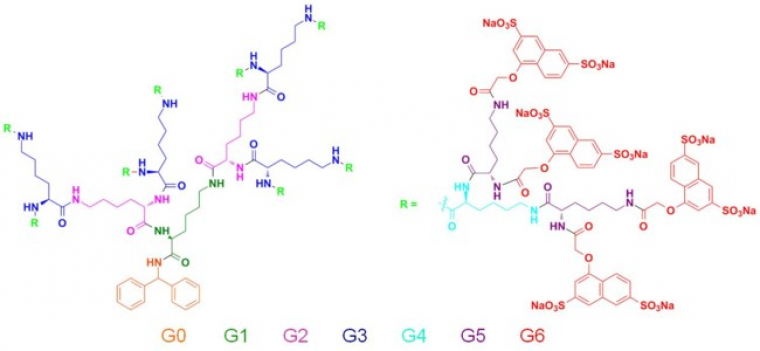
Voyons maintenant la structure du dendrimères actif de VivaGel®. Ce dernier est de type polysulfonate c'est-à-dire qu’à sa périphérie se trouve un grand nombre de fonctions sulfonates (-SO3-). La figure 7 permet de mieux se rendre compte que le dendrimère ressemble à un arbre et des différentes générations que contient le dendrimère. En effet, le « cœur » en orange serait le tronc, les générations 1, 2, 3, 4, et 5 seraient les branches et les groupements périphériques rouges peuvent être comparés aux feuilles de l’arbre.
Cette macromolécule se lie à la surface des protéines du VIH et de ce fait prévient les lymphocytes T4 humains contre l’infection du virus. C’est un dendrimère anionique car il possède des fonctions sulfonates (SO3-), chargées négativement, en périphérie. Ces dernières miment artificiellement la surface cellulaire. Ainsi, il y a une reconnaissance entre les protéines du VIH et les groupements à la surface du dendrimère (figure 8). Le virus ne va donc plus pouvoir se fixer aux récepteurs des cellules T4 car les protéines GP120 de sa surface seront déjà occupées par les dendrimères. On dit que le dendrimère agit en tant qu’inhibiteur lors de l’entrée du virus.
Des résultats cliniques encourageants
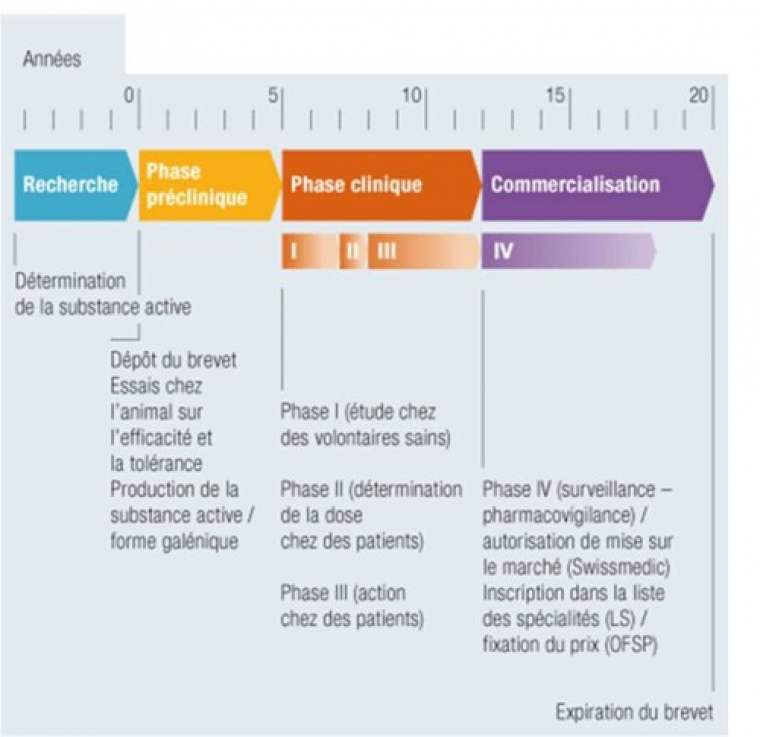
La figure 9 résume les différentes phases qui interviennent lors de la naissance d’un médicament. Vous aurez donc compris qu’il faut beaucoup d’années pour qu’un médicament soit mis sur le marché.
Les tests cliniques en phase clinique I effectués sur 36 femmes saines se sont avérés significatifs, montrant que le gel est efficace et bien toléré au niveau vaginal.
D’après les résultats cliniques, VivaGel® serait efficace contre le VIH mais également contre le Virus Herpes Simplex (HSV), le PapillomaVirus Humain (HVP), et des bactéries vaginales.
Compte tenu de ces résultats positifs, VivaGel® a été reconnu, en 2004, comme l'une des plus grandes avancées dans le domaine des nanotechnologies par le Forbes/Wolfe Nanotech. Report. Le programme clinique s’étend actuellement et son succès éventuel représenterait une des premières démonstrations de la puissance de ce type d’architectures pour des applications pharmaceutiques.
A l’heure actuelle, VivaGel® est testé en phase clinique II contre différent virus : HIV, HSV, HPV (Papillomavirus humains) et les bactéries vaginales lactobacilli sppG. vaginalis, Bacteroides, Prevotella. Il est également testé en combinaison avec des préservatifs.
Pour le coté commercial, il se présentera sous forme de tube applicateur (figure 10).
Il reste encore du chemin à parcourir à ce nouveau médicament avant de pouvoir être commercialisé mais il constituerait l'une des plus grandes avancées en nanotechnologies, en attendant un jour l’arrivée d’un vaccin contre le VIH….