L'ibuprofène est un analgésique (anti-douleur) et un anti-inflammatoire au même titre que l'aspirine. C'est le constituant actif de nombreux produits commerciaux et il fait partie des anti-douleurs en vente libre les plus répandus. La molécule a été découverte par la société Boots dans les années 1960 et cette société a breveté une synthèse qui a longtemps été la méthode de choix pour la production industrielle. Dans les années 1990, la société BHC à mis au point un procédé « vert », c'est à dire reposant sur les principes de la chimie verte.
Introduction
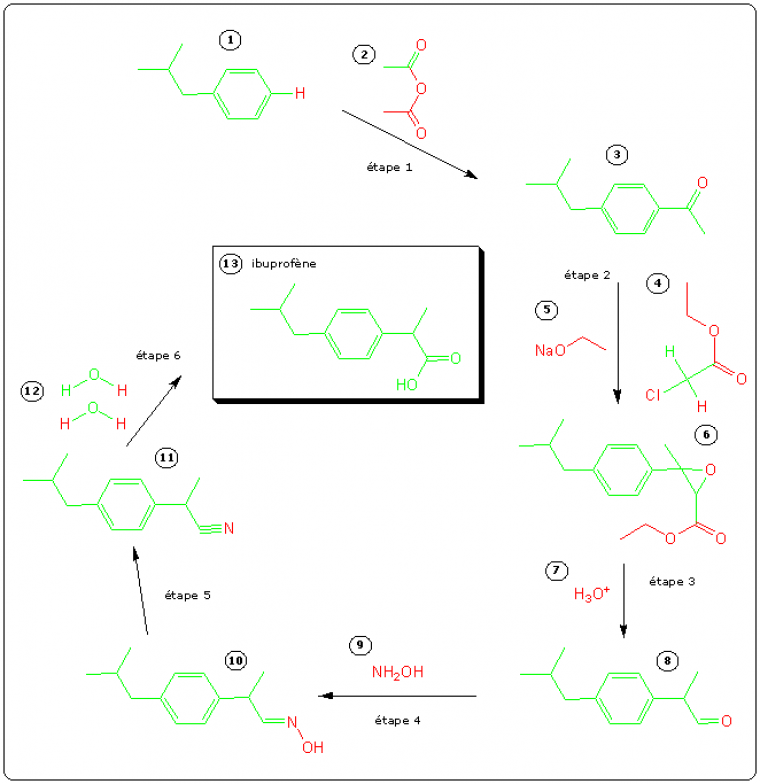
L'ibuprofène est un analgésique1 (anti-douleur) et un anti-inflammatoire au même titre que l'aspirine. C'est le constituant actif de nombreux produits commerciaux et il fait partie des anti-douleurs en vente libre les plus répandus2. La molécule a été découverte par la société Boots dans les années 1960 et cette société a breveté une synthèse qui a longtemps été la méthode de choix pour la production industrielle. Cette synthèse a permis de produire annuellement des milliers de tonnes d'ibuprofène mais elle s'est accompagnée de la formation d'une quantité encore plus importante de sous-produits non utilisés et non recyclés qu'il a fallu détruire ou retraiter.
Dans les années 1990, la société BHC à mis au point un procédé « vert », c'est à dire reposant sur les principes de la chimie verte : une chimie qui réduit la pollution à la source et qui est plus respectueuse de l'environnement. La nouvelle voie de synthèse est beaucoup plus efficace que la voie traditionnelle : la quantité de sous-produit est considérablement réduite, de plus l'unique sous-produit formé est valorisé. Cet article présente les deux procédés et compare leur efficacité.
L'efficacité d'un procédé est traditionnellement mesurée par le rendement chimique, sans tenir compte de la quantité de sous-produits formés. Dans une optique de réduction de la pollution à la source, la chimie verte propose une évolution du concept d'efficacité qui prend en compte la minimisation de la quantité de déchets. On utilise comme indicateur de l'efficacité d'un procédé son utilisation atomique (UA).
L'utilisation atomique est définie comme le rapport de la masse molaire du produit recherché sur la somme des masses molaires de tous les produits qui apparaissent dans l'équation stoechiométrique. Si les sous-produits de la réaction ne sont pas tous identifiés, alors la conservation de la matière permet de remplacer le dénominateur par la somme des masses molaires de tous les réactifs. Cette notion est détaillée sur des exemples dans l'article « les concepts de la chimie verte : utilisation atomique et facteur E »
Calcul
Le tableau suivant permet de faire le bilan des atomes mis en jeu dans la synthèse. Pour chaque nouveau réactif, on classe les atomes en deux catégories : ceux qui entrent dans la constitution de la molécule cible d'ibuprofène (ils sont représentés en vert dans le schéma précédent) et ceux qui se retrouvent dans des sous-produits (en rouge).
| Réactifs (g.mol-1) | Atomes utilisés dans l'ibuprofène | Atomes non-utilisés dans l'ibuprofène | ||||
| 1 | 134 | 10 C, 13 H | 133 | 1 H | 1 | |
| 2 | C4H6O3 | 102 | 2 C, 3 H | 27 | 2 C, 3 H, 3 O | 75 |
| 4 | C4H7ClO2 | 122,5 | 1 C, 1 H | 13 | 3 C, 6 H, 1 Cl, 2 O | 109,5 |
| 5 | C2H5ONa | 68 | 0 | 2 C, 5 H, 1 O, 1 Na | 68 | |
| 7 | H3O | 19 | 0 | 3 H, 1 O | 19 | |
| 9 | NH3O | 33 | 0 | 1 N, 3 H, 1 O | 33 | |
| 12 | H4O2 | 36 | 1 H, 2 O | 33 | 3 H | 3 |
| Total (g.mol-1) | Ibuprofène | Déchets | ||||
| C20H42NO10ClNa | 514,5 | C13H18O2 | 206 | C7H24NO8ClNa | 308,5 | |
L'utilisation atomique de ce procédé est donc UA = 206 / 514,5 x 100 % = 40 %. La production annuelle d'ibuprofène est de l'ordre de 13000 tonnes ; si c'est ce procédé qui est utilisé, il génère plus de 20000 tonnes de sous-produits par an. Ces sous-produits ne sont pas directement exploitables, ils doivent donc être retraités ou détruits ce qui a un coût économique et environnemental.
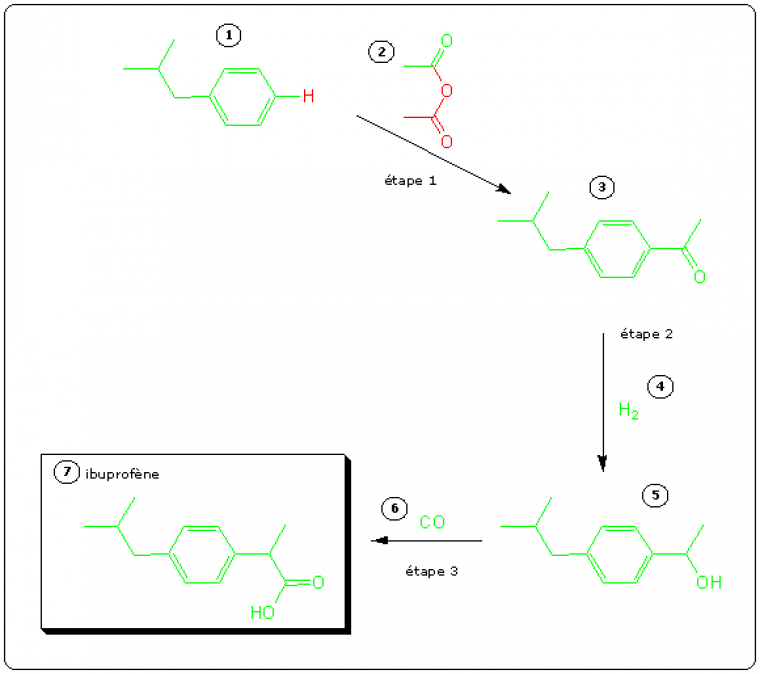
Cette synthèse est effectuée en 3 étapes et fait appel à des réactions catalysées. Le schéma de synthèse reprend les conventions précédentes : les atomes qui se retrouvent dans la molécule cible sont en vert et ceux qui forment des sous-produits en rouge. On remarque immédiatement que l'utilisation atomique de ce procédé est plus élevée, donc meilleure, que celle du précédent.
Utilisation atomique
Le tableau suivant dresse le bilan des atomes qui interviennent dans la synthèse.
| Réactifs (g.mol-1) | Atomes utilisés dans l'ibuprofène | Atomes non-utilisés dans l'ibuprofène | ||||
| 1 | 134 | 10 C, 13 H | 133 | 1 H | 1 | |
| 2 | C4H6O3 | 102 | 2 C, 3 H, 1 O | 43 | 2 C, 3 H, 2 O | 59 |
| 4 | H2 | 2 | 2 H | 2 | ||
| 5 | CO | 28 | 1 C, 1 O | 28 | ||
| Total (g.mol-1) | Ibuprofène | Déchets | ||||
| C15H22O4 | 266 | C13H18O2 | 206 | C2H4O2 | 60 | |
L'utilisation atomique de ce procédé est UA = 206 / 266 x 100 % = 77,4 %. Le gain offert par le procédé vert sur le procédé Boots est considérable. Il faut de plus noter que le sous-produit obtenu au cours de l'étape 1, qui est le seul sous-produit, est l'acide éthanoïque. Il est séparé du mélange réactionnel et purifié : l'unité de production d'ibuprofène est dans la pratique couplée à une unité de production d'acide éthanoïque1 L'utilisation atomique peut donc être considérée comme égale à 100 %.
Le procédé vert permet dans ce cas particulier de réduire la quantité de déchets à retraiter à zéro. Il offre aussi d'autres avantages. Comme il ne fait appel qu'à trois étapes contre six pour le procédé traditionnel, le débit de la chaîne de synthèse est plus important, ce qui peut se traduire en avantage économique pour le fabricant.
Il est capital de remarquer que le procédé vert n'est pas seulement un procédé moins polluant, il permet également au fabricant de réduire ses dépenses grâce à :
-
la diminution de la quantité de déchet (donc des frais de retraitement).
-
la diminution du nombre d'étapes qui entraîne d'une part une réduction des coûts de séparation et de purification, et d'autre part une augmentation de la capacité de production puisque la synthèse prend désormais moins de temps.
Les procédés verts sont donc conçus pour être à la fois respectueux de l'environnement et économiquement viables. En effet, la rentabilité du procédé est un prérequis indispensable dans le monde industriel.