Dans les complexes des métaux de transition, le métal M est entouré d’entités que, traditionnellement, on appelle « ligands » : M(lig)n. La liaison entre le métal et les ligands peut être de deux types, selon le schéma de liaison proposé par Lewis : soit le ligand apporte les deux électrons de la liaison (liaison « dative »), soit chaque partenaire apporte un électron à la liaison (liaison « covalente »). L’objet de cet article est d’analyser comment les électrons se répartissent dans le complexe en fonction de la nature du métal et des ligands.
Ce premier article est accompagné de trois autres volets :
- 2ème volet, apportant des justifications théoriques et se terminant par l'établissement de la règle des 18 électrons ;
- 3ème volet, montrant les applications des décomptes électroniques aux complexes de borohydrures et au complexe TiCl4 ;
- 4ème volet, traitant du phénomène de rétro-donation et des complexes de dihydrogène.
Notion de ligand
On appelle ligand toute entité chimique susceptible de se coordonner à un métal de transition : il peut s’agir d’un atome, d’une molécule ou d’un ion. Seuls les autres métaux de transition ne peuvent pas être considérés comme des ligands ; on préférera parler de dimère de métal de transition.
Site de coordination
Dans le cas de ligands tels que les phosphines, les amines ou le monoxyde de carbone, le ligand se lie au métal par l’intermédiaire d’un seul atome. Celui-ci est appelé le « site de coordination » du ligand.
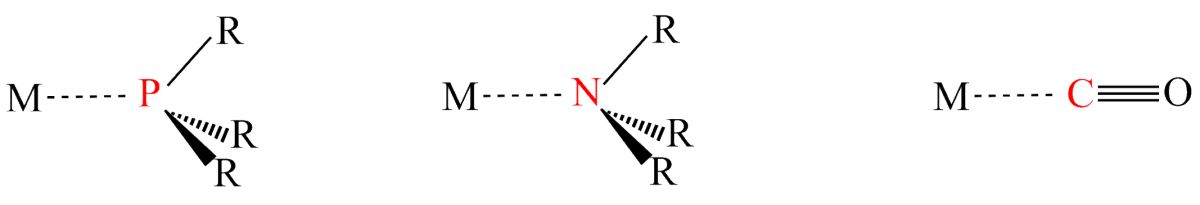
Il peut y avoir plusieurs sites de coordination sur un même ligand. Par exemple l’éthylène diamine H2N-CH2-CH2-NH2 peut se lier à un métal par les deux atomes d’azote. On parle dans ce cas de ligand « bidente » pour signifier qu’il possède deux sites de coordination distincts. Il existe de même des ligands tridentes, tétradentes etc.

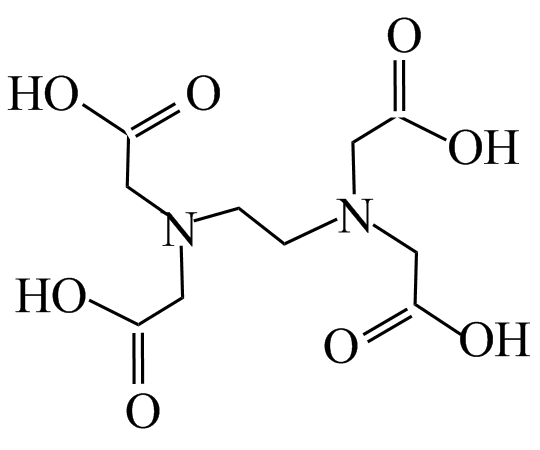
Un exemple très courant est l’EDTA (éthylènediaminetétraacétique) qui est un ligand hexadente sous sa forme tétraanionique :
Hapticité
L’éthylène, ainsi que de nombreuses molécules insaturées, peut se coordonner à un métal de transition. C’est alors la liaison p de l’éthylène (ou éthène) qui interagit avec le métal ; le site de coordination implique ainsi plusieurs atomes. On utilise alors la notion d’« hapticité » (notée η) du ligand qui indique le nombre d’atomes dans la sphère de coordination du métal. Ainsi, l’éthylène est un ligand η2 ; dans le chrome-dibenzène, le ligand benzène est η6 etc.
Certains ligands présentent une hapticité variable : par exemple, le ligand cyclopentadiényle peut être un ligand η5 (tous les atomes de carbone sont dans la sphère de coordination,) ou η3 ou même η1.
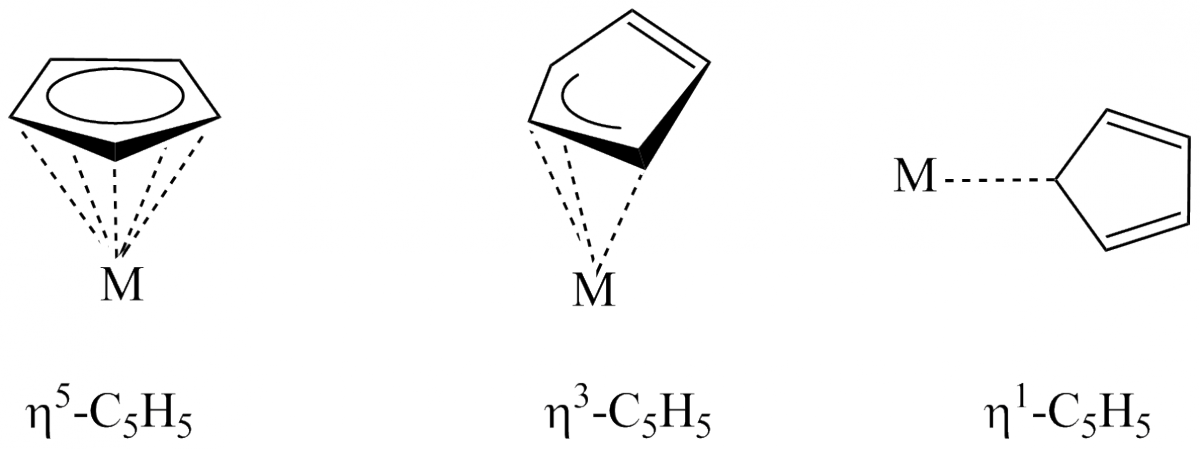
La classification des ligands
Les deux grandes familles
On distingue principalement deux familles de ligands : les ligands L qui apportent une paire d’électrons au métal et les ligands X qui n’en apportent qu’un. L’établissement de la structure de Lewis du ligand permet le classement des ligands dans l’une ou l’autre famille.
- Les ligands L : toutes les bases de Lewis de la chimie sont des ligands L. On trouve par exemple les amines, les phosphines, l’eau, le monoxyde de carbone etc. Dans le cas de complexes éthyléniques, ce sont les deux électrons de la liaison p de l’éthylène qui assurent la liaison métal-ligand bien qu’on ait affaire à une paire liée et non libre comme dans le cas des bases de Lewis. Il est même possible, dans certains cas, que les deux électrons de la liaison proviennent d’une paire de liaison s : c’est le cas des liaisons Si-Cl, Si-H, et même de H2.
- Les ligands X : ce sont tous les radicaux de la chimie : H, CH3 et tous les radicaux alkyles, OH, Cl etc.
Site de coordination LaXb
Dans de nombreux cas, un même site de coordination peut engager plus d’un (X) ou de deux (L) électrons dans son interaction avec le métal. Un premier exemple est celui de la molécule d’eau, H2O dont la structure de Lewis indique qu’elle porte deux paires libres sur l’atome d’oxygène. Formellement, c’est un ligand L2. Cependant, les quatre électrons qui constituent les deux paires libres ne sont pas toujours utilisés simultanément pour former une double liaison métal-OH21. En revanche, une paire d’électrons (L) est nécessaire et suffisante pour assurer la liaison avec le métal. C’est le type de cette interaction principale qui est retenu dans la nomenclature du ligand. C’est la seule qui est toujours présente ; les autres interactions possibles, secondaires, peuvent ou non se manifester et seront à considérer au cas par cas.
D’une façon générale, un site Ln sera donc considéré comme un site L. De même, si un site possède à la fois un électron célibataire et des paires libres (LnX), seul l’électron célibataire, responsable de l’interaction principale, sera retenu et on parlera de ligand X. C’est par exemple le cas du ligand amino NR2 qui est un ligand X bien que l’atome d’azote présente à la fois une paire libre et un site radicalaire. En revanche, un site possédant n électrons non appariés sera considéré comme un ligand Xn, car les n électrons sont toujours simultanément engagés dans l’interaction principale. Ainsi, l’atome d’oxygène est un ligand X2 (ligand oxo comme par exemple dans MnO4- ou Cl3VO) et l’atome d’azote un ligand X3 (ligand nitrure comme dans [Cl5OsN]2- ou [(NH3)5OsN]3+). L’ensemble de ces règles est résumé ci-dessous :
Ln = L LnX = X Xn = Xn LpXn = Xn
Les ligands insaturés
Dans de nombreux cas, le ligand se coordonne au métal par plusieurs atomes : prenons l’exemple du (η4-butadiène) dont l’interaction avec le métal met en jeu quatre atomes de carbone. Chaque liaison éthylénique interagit avec le métal et le butadiène se comporte ainsi comme un ligand L2. De même le benzène est un ligand L3 etc. Le ligand cyclopentadiényle (CH)5 est facilement identifié à l’aide de sa structure de Lewis : il s’agit d’un ligand L2X qui apporte cinq électrons au métal.
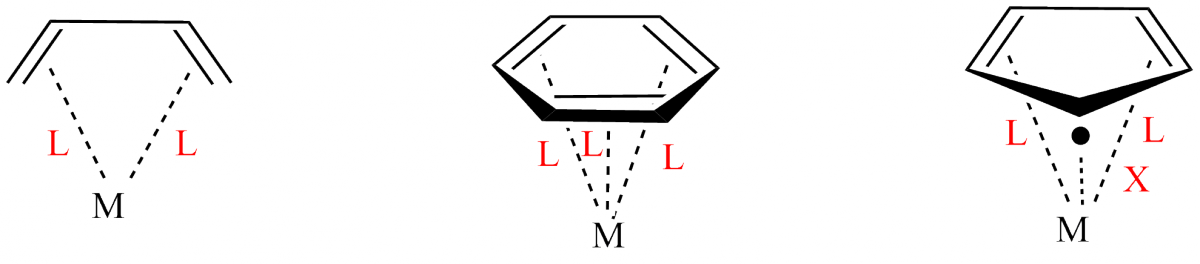
Les décomptes d’électrons
Le nombre total d’électrons
Compte tenu des règles énoncées ci-dessus, chaque ligand pourra être écrit sous la forme LaXb. Le complexe pourra ainsi s’écrire (MLlXx)q où q est la charge du complexe considéré. Si le métal de transition possède m électrons de valence, le nombre total d’électrons Nt dans la sphère de coordination du métal (appelé nombre total d’électrons par la suite) se calcule facilement : chaque ligand L apporte deux électrons et chaque ligand X un seul. On a ainsi :
Nt = m + 2l + x - q
Plusieurs exemples de ce décompte seront donnés plus loin.
Le nombre d’oxydation
Le nombre d’oxydation (NO) du métal est obtenu de la façon suivante : on brise les liaisons métal-ligand en attribuant à chaque ligand la paire d’électrons de liaison quelle que soit la nature L ou X de celui-ci. Chaque ligand L reste neutre alors qu’un ligand X devient anionique X-. Cette répartition n’est pas totalement arbitraire car, dans leur immense majorité, les ligands sont plus électronégatifs que le métal. Le nombre d’oxydation est la charge qui reste sur le métal à l’issue de cette fragmentation ; elle est égale à (x + q) afin de respecter la conservation des charges :
(MLlXx)q → 1L + x(X-) + M(x + q)
Remarque :
Dans de nombreux cours, la différence entre ligands L et X n’est pas utilisée et chaque ligand est supposé posséder deux électrons. Ainsi, une liaison M-Cl est considérée comme une liaison ionique M+ Cl- ; le chlore est alors considéré comme un ligand chlorure L qui a oxydé le métal. Ce décompte dit « ionique », est parfaitement équivalent au décompte présenté.
La configuration dn
Une fois les deux électrons de la liaison métal-ligand attribués au ligand, les n électrons restant sur le métal sont placés dans les orbitales d du métal. Cette répartition, a priori arbitraire, sera justifiée dans le cas d’un complexe octaédrique (voir le deuxième article du dossier, paragraphe 4.2).
n = m – x – q
On définit ainsi la configuration dn du métal dans le complexe.
Exemples
Dans le tableau 1 sont présentés quelques exemples de décomptes électroniques. La première colonne donne la formule du complexe : on y trouve, entre autres, le catalyseur d’hydrogénation de Vaska (Ir(PPh3)2(CO)Cl) ; deux métallocènes (M(η5-C5H5)2 avec M = Fe, Ni) le complexe de Kubas, W(CO)3(PR3)2(H2), qui a été le premier complexe de l’hydrogène moléculaire caractérisé. On notera dans ce dernier cas que c’est la molécule de dihydrogène (H2) qui est liée au métal et non deux atomes d’hydrogène (H)2 comme dans le complexe Fe(H)2(CO)4.
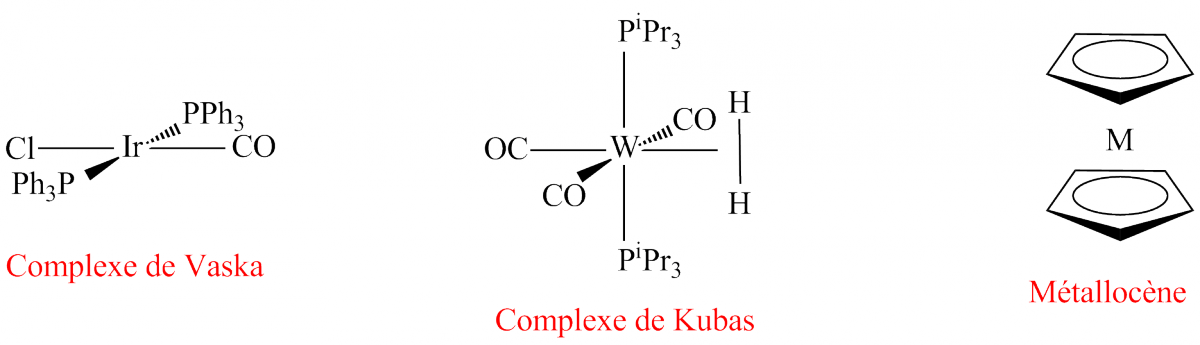
Dans la deuxième colonne on trouve la configuration électronique de valence de l’atome de métal et dans la troisième l’identification du complexe en nomenclature LX ; les autres colonnes sont relatives aux grandeurs présentées plus haut.
|
Complexe |
|
|
m |
2l |
x |
q |
Nt |
NO |
dn |
|---|---|---|---|---|---|---|---|---|---|
|
Fe(CO)5 |
4s23d6 |
FeL5 |
8 |
10 |
0 |
0 |
18 |
Fe(0) |
d8 |
|
Ir(PPh3)2(CO)Cl |
6s25d7 |
IrL3X |
9 |
6 |
1 |
0 |
16 |
Ir(I) |
d8 |
|
Cr(C6H6)2 |
4s13d5 |
CrL6 |
6 |
12 |
0 |
0 |
18 |
Cr(0) |
d6 |
|
Fe(H)2(CO)4 |
4s23d6 |
FeL4X2 |
8 |
8 |
2 |
0 |
18 |
Fe(II) |
d6 |
|
Fe(η5-C5H5)2 |
4s23d6 |
FeL4X2 |
8 |
8 |
2 |
0 |
18 |
Fe(II) |
d6 |
|
Ni(η5-C5H5)2 |
4s23d8 |
NiL4X2 |
10 |
8 |
2 |
0 |
20 |
Ni(II) |
d8 |
|
Ti(PR3)2Cl3(CH3) |
4s23d2 |
TiL2X4 |
4 |
4 |
4 |
0 |
12 |
Ti(IV) |
d0 |
|
W(CO)3(PR3)2(H2) |
6s23d4 |
WL6 |
6 |
12 |
0 |
0 |
18 |
W(0) |
d6 |
|
Ni(H2O)62+ |
4s23d8 |
NiL62+ |
10 |
12 |
0 |
2 |
20 |
Ni(II) |
d8 |
|
CrO42- |
4s13d5 |
CrX82- |
6 |
0 |
8 |
-2 |
16 |
Cr(VI) |
d0 |
m est le nombre d’électrons de valence du métal, l et x désignent le nombre de sites L ou X, q la charge du complexe, Nt son nombre total d’électrons, NO le nombre d’oxydation du métal et n le nombre d’électrons dans les orbitales d.
On remarquera sur ces exemples que la plupart des complexes possèdent au plus 18 électrons, résultat très général qui est connu sous le nom de la « règle des 18 électrons ».